黑木耳多糖的抑菌活性与单糖组分分析
2014-08-25,,
,,
(浙江工业大学 海洋学院,浙江 杭州 310014)
黑木耳又称木耳,为担子菌纲目耳科代表种,是一种药食兼用真菌.世界上90%以上的黑木耳产自于我国,具有巨大的开发潜力[1].黑木耳多糖具有丰富的生物活性,能够预防冠心病、高血脂、高血压等疾病,并具有抗衰老、抗血栓、抗癌防癌、调节免疫等功效[2].研究发现黑木耳多糖的组分与其生理功能密切相关[3].因此,深入研究黑木耳多糖,开发其功能性食品、保健品和药品是黑木耳资源利用的发展方向之一.
黑木耳多糖的提取多采用传统热水浸提法,但该方法耗时长、产量低,需要进一步优化.目前,对于黑木耳多糖活性的研究,大多围绕其免疫调节等展开.据少量研究报道,黑木耳多糖具有抑菌活性.樊黎生等[4]研究了黑木耳多糖的抗菌效果,得出黑木耳多糖AAP-Ⅱa级分对大多数革兰氏阳性细菌和革兰氏阴性细菌均有较强的抑菌作用.李公斌等[5]研究了硫酸酯化黑木耳多糖的抑菌功能,得出硫酸酯化黑木耳多糖对金黄色葡萄球菌、大肠杆菌、黑曲霉有不同程度的抑制.但是,对于黑木耳多糖的抑菌活性的研究仍处于探索阶段.研究发现,多糖活性与其单糖组分有关[6-7].陈琼华等[8]利用纸层析和气相色谱技术分析黑木耳多糖的组成,确定该多糖主要由L-岩藻糖、D-木糖、L-阿拉伯糖、D-葡萄糖醛酸和D-甘露糖等单糖组成.Morisaki等[9]采用酸水解、乙酰化等技术处理,对黑木耳中两种酸性杂多糖的单糖组成进行分析,得到D-木糖、D-葡萄糖醛酸和D-甘露糖是两种多糖的主要单糖成分.黑木耳多糖的单糖组成与其生物活性和构效关系密切相关,因此,深入分析黑木耳多糖的结构组成有利于该多糖生物活性的研究,进一步推动黑木耳产品的开发.
1 材料与方法
1.1 仪器与材料
黑木耳产自浙江金华,金黄色葡萄球菌、大肠杆菌、藤黄色微球菌、枯草芽孢杆菌等细菌,黑曲霉、啤酒酵母等真菌由浙江工业大学微生物实验室提供.
L-岩藻糖、D-木糖、D-甘露糖、L-阿拉伯糖、D-半乳糖、D-葡萄糖、L-鼠李糖,硼氢化钠,二甲基亚砜,三氟乙酸,碘甲烷等试验试剂购买于美国Sigma公司.填料DEAE-Sepharose Fast Flow和SephacrylS400购于美国GE公司.氯仿、甲醇、乙醇、乙酸、醋酐、甲苯、无水硫酸钠等均为分析纯.
恒温数显水浴锅(金坛市医疗仪器公司);三频恒温数控超声清洗仪KQ-300 GVDV(昆山超声仪器有限公司);旋转蒸发器SENCO(申生科技有限公司);高速冷冻离心机(日本Hitachi公司);Agilent气相色谱7890A(美国Agilent公司);752型紫外-可见分光光度计(上海光学仪器有限公司);气相色谱-质谱联用(美国Agilent公司).
1.2 实验方法
1.2.1 黑木耳粗多糖的提取
取黑木耳子实体烘干(60 ℃,6 h)至恒重后粉碎.称取子实体干粉10 g,用95%乙醇脱脂24 h后热水浸提,趁热过滤.滤液经10 000 r/min离心10 min.取上清液,用Sevag法脱蛋白后,加入无水乙醇至质量分数为80%,摇匀后放置24 h,10 000 r/min离心10 min,取沉淀,冷冻干燥得粗多糖AAP80.
1.2.2 黑木耳粗多糖的多糖质量分数的测定
以葡萄糖为标准样品制作标准曲线,采用硫酸-苯酚法测定多糖质量分数.精确称取无水葡萄糖0.5 g,稀释至100 mL,再取该溶液1 mL溶于50 mL容量瓶并定容.分别取0.2,0.4,0.6,0.8,1.0,1.2 mL各补水至2 mL.分别依次加6%苯酚1 mL和5 mL浓硫酸,震荡后置于沸水浴中加热15 min.取出各试管放在冰水中迅速冷却,用紫外分光光度计在490 nm处测定其吸光值.得到回归方程y=0.705 6x+0.054 5,R2=0.999 3.
粗多糖得率测定式为
多糖得率=多糖质量分数/原料质量×100%
1.2.3 黑木耳粗多糖抑菌活性
1) 抑菌圈法测定抑菌效果
于超净工作台,分别将已活化各菌种接种到已灭菌的培养基三角烧瓶中,细菌37 ℃恒温振荡培养24 h,真菌28 ℃恒温振荡培养48 h后置冰箱中保存,供试菌分别稀释成10-7~l0-8cfu/mL备用[7].
抑菌效果的检测采用牛津杯法[10].牛津杯放入干燥培养皿,121 ℃高压蒸汽灭菌30 min.趁热将灭菌后固体培养基倒入平皿,冷却凝固后在表面加入混有1 mL菌液的半固体培养基,然后将各平皿倒置于恒温培养箱中.每个平皿中放入2个牛津杯,一个注射200 μL的多糖溶液,另外一个加入无菌水作为对照.每种菌3次重复,测量抑菌圈的平均值.
2) 最小抑菌质量浓度(MIC)
用两倍稀释法[11-12]将黑木耳多糖溶液稀释成3.125,6.25,12.5,25,50和100 mg/mL,向牛津杯中加入各浓度多糖溶液200 μL,放入恒温培养箱中在适宜温度下培养,观察各个质量浓度每种菌液抑菌情况并测定对各种菌液最小抑制质量浓度.
1.2.4 粗多糖AAP80纯化
取粗多糖AAP80溶于蒸馏水中,配制成1 mg/mL的溶液,10 000 r/min离心10 min.取上清液过孔径为0.45 μm微孔滤膜,滤液先过DEAE-Sepharose Fast Flow预装柱进行预实验,确定梯度洗脱时间,盐浓度的选择.确定上样量为20 mL,以蒸馏水洗脱,再用0.1,0.2,0.4,2 mol/L的NaCl进行梯度洗脱,自动部分收集仪分步收集流分,洗脱液每10 mL收集一管.采用苯酚-硫酸法检测,以吸光值为纵坐标,洗脱管号为横坐标,绘制洗脱曲线,将0.2 mol/L NaCl洗脱液浓缩、脱盐、冷冻干燥得AAP80-3.
采用Sephacryl S-400凝胶层析柱对样品进行纯化.称量离子层析后冻干样品适量,溶于蒸馏水中配成5 mg/mL的多糖溶液,高速离心后过孔径为0.45 μm的微孔滤膜.取滤过液上S-400的凝胶层析系统,洗脱液采用流速为1 mL/min的蒸馏水,上样体积为1 mL,采用分部收集器收集流分,以吸光度对洗脱体积作图.
1.2.5 单糖组成的测定
1) 标准单糖样品的乙酰化
精密称量等摩尔的L-阿拉伯糖、L-岩藻糖、L-鼠李糖、D-半乳糖、D-木糖、D-甘露糖和D-葡萄糖,分别溶解在3 mL蒸馏水中成2 mmol/L溶液.加20~30 mg硼氢化钠(NaBH4),置于25 ℃条件下,间歇振荡3 h.用冰乙酸中和过量的NaBH4至溶液不再产生气泡为止,再加入3 mL甲醇,减压浓缩蒸干,重复操作4到5次.浓缩样品在烘箱中110 ℃下加热15 min,除去多余水分.干燥样品加4 mL醋酐,100 ℃条件下反应1 h,冷却后加3 mL甲苯,旋转蒸发仪旋干,重复4到5次.将乙酰化后得到的产物溶解于3 mL氯仿,加适量蒸馏水充分震荡,除去水溶液,重复4到5次.氯仿层用适量的无水硫酸钠干燥,定容至10 mL待测[6].
2) 样品乙酰化的处理
称量多糖样品2 mg,置于梨型瓶中,平行处理三个样,分别加4 mL浓度为2 mol/L的三氟乙酸(TFA),110 ℃下水解2 h.将水解液在40 ℃以下减压旋干,加3~4 mL甲醇混匀后减压蒸干,重复4到5次.按照标准单糖样品乙酰化方法进行还原、乙酰化,用氯仿定容至5 mL,待测[13-14].
3) 气相色谱-质谱联用分析
HP-5毛细管柱(30 m×0.25 mm×0.25 μm),FID检测器,高纯氮作载气,柱流速1 mL/min.升温程序:柱初温120 ℃,以10 ℃/min升至240 ℃,保持6.5 min.进样量为1 μL,分流比1∶30,氢气35 mL/min,空气350 mL/min,尾吹气30 mL/min.接口温度和离子源温度均为250 ℃.质量数扫描时间
为0.28 s,扫描范围是40~500 amu[15].
2 结果与讨论
2.1 黑木耳多糖提取单因素实验
2.1.1 液料比对黑木耳多糖提取的影响
称10 g黑木耳干粉末,选取不同液料比,设定浸提温度100 ℃,提取时间3 h,4次,得到的黑木耳粗多糖得率如图1(a)所示.从图1(a)中可以看出:当液料比低于60时,随着液料比的增加多糖得率增加,而当液料比为60多糖的得率(5.47±0.07)%后,多糖得率增加缓慢.
2.1.2 温度对黑木耳多糖提取的影响
称10 g黑木耳干粉末,选取不同提取时间,设定液料比60∶1,浸提时间3 h,次数4次,得到的黑木耳粗多糖得率如图1(b)所示.该图显示,黑木耳多糖的得率随温度升高而逐步逐提高,因此选择浸提温度100 ℃最佳.
2.1.3 时间对黑木耳多糖提取的影响
称10 g黑木耳干粉末,选取不同提取时间,设定液料比60∶1,浸提温度100 ℃,次数4次,得到的黑木耳粗多糖得率如图1(c)所示.由图1(c)中可以看出:1~4 h多糖得率随着提取时间的增加逐渐增加,多糖得率在4 h最高(5.36±0.14)%,之后曲线变化不大.
2.1.4 提取次数对黑木耳多糖提取的影响
称10 g黑木耳干粉末,设定浸提温度100 ℃,液料比60∶1,时间4 h时,不同的提取次数得到的黑木耳粗多糖得率如图1(d)所示.随着提取次数的增加,黑木耳多糖的得率也有相应提高,但是3次提取后多糖得率为(5.41±0.11)%,以后增幅不明显.
2.2 黑木耳提取工艺优化
通过单因素实验,料液比、浸提时间、提取次数、浸提温度对多糖的得率均有影响.因此,本研究通过L9(3)4正交实验优化设计获得黑木耳多糖的最佳提取工艺.实验设计见表1,2.
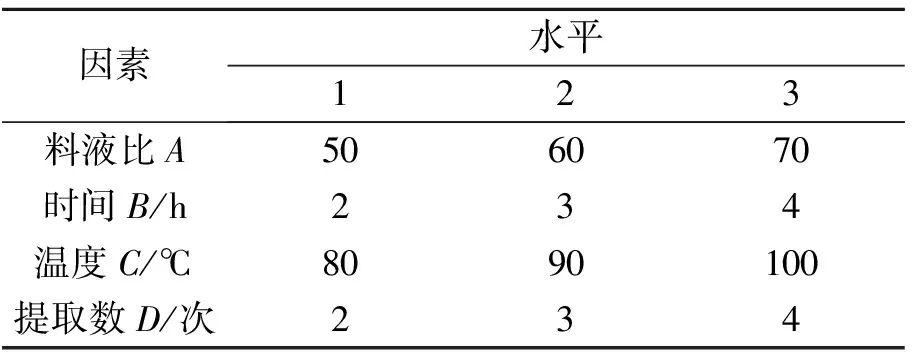
表1 单因素试验的因素-水平
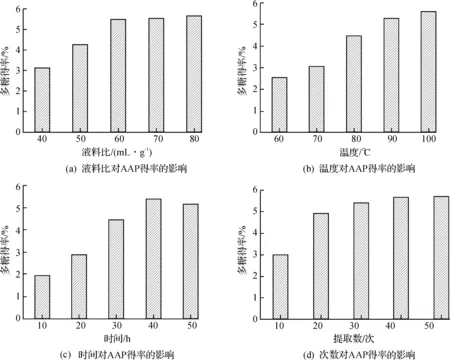
图1 不同因素对黑木耳粗多糖得率的影响

表2 黑木耳多糖正交实验设计表
通过正交实验方差分析得出,影响黑木耳多糖得率的各因素大小顺序A>B>D>C,最佳提取工艺组合A3B3C2D3,即:料液比1∶70,提取时间4 h,温度90 ℃,提取次数4次,得率6.89%.
2.3 黑木耳粗多糖抑菌实验
2.3.1 黑木耳粗多糖抑菌效果
从图2中可以看出:大肠杆菌和金黄色葡萄球菌在黑木耳粗多糖的作用下有明显的抑制,且对大肠杆菌的抑制效果小于金黄色葡萄球菌,抑菌圈分别为(5.55±0.182)mm和(9.84±0.076) mm.对枯草芽孢杆菌、藤黄微球菌和两种真菌没有抑菌活性.

1—金黄色葡萄球菌;2—大肠杆菌;3—枯草芽孢杆菌;4—藤黄微球菌;5—啤酒酵母;6—黑曲霉;7—无菌水
2.3.2 最小抑制质量浓度的测定(MIC)
从图3中可以看出:随着质量浓度的减小,粗多糖的抑菌活性减弱.黑木耳多糖质量浓度低于12.5 mg/mL对大肠杆菌没抑制作用.质量浓度低于6.25 mg/mL对金黄色葡萄球菌无抑制作用.因此,黑木耳粗多糖对金黄色葡萄球菌和大肠杆菌最低抑制质量浓度分别为6.25和12.5 mg/mL.

图3 黑木耳粗多糖最小抑菌质量浓度
2.4 黑木耳粗多糖离子交换柱层析纯化
黑木耳粗多糖AAP80经过DEAE-Sepharose Fast Flow分离后,得到了4个组分,分别为AAP80-1,AAP80-2,AAP80-3和AAP80-4,如图4所示.AAP80-1为纯水洗脱下来的多糖部分,其他3个组分分别为0.1,0.2,0.4 mol/L的NaCl溶液洗脱下来的部分.其中AAP80-3峰面积较大,质量分数最多,收集此部分洗脱液.通过Sephadex G25凝胶柱脱盐,用示差检测器跟踪收集脱盐后组分,浓缩后冷冻干燥.

图4 黑木耳多糖洗脱曲线
2.5 AAP80-3凝胶柱层析纯化
得到粗多糖AAP80-3的分子量分布和结构并不一致,需要对其进行进一步纯化.如图5所示为AAP80-3经SephacrylS-400凝胶柱层析得到的洗脱曲线,收集17—25管洗脱液,浓缩冻干后命名为AAP80-3a.如图6所示0~20 min内AAP80-3a在HPLC的凝胶层析中为单一对称峰,证明其为均一组.

图5 AAP80-3的Sephacryl S400层析洗脱曲线

图6 AAP80-3a的HPLC曲线
2.6 AAP80-3a单糖组成
图7为气相色谱混标总离子流图,表3为混标中各单糖的保留时间和各组分的平均面积百分含量,RSD1为混合重复进样6次的相对标准偏差值,RSD2平行处理6组混标的相对标准偏差值,算出RSD1与RSD2都小于5%,说明所用乙酰化方法可操作性较好.由平均面积百分含量推算出各单糖组分相对于仪器的响应因子,以备后续样品组分摩尔比的计算.
由单糖标品乙酰化衍生物气质色谱图的出峰时间,可以判断混标气相色谱图的出峰顺序为L-鼠李糖、L-阿拉伯糖、L-岩藻糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖.
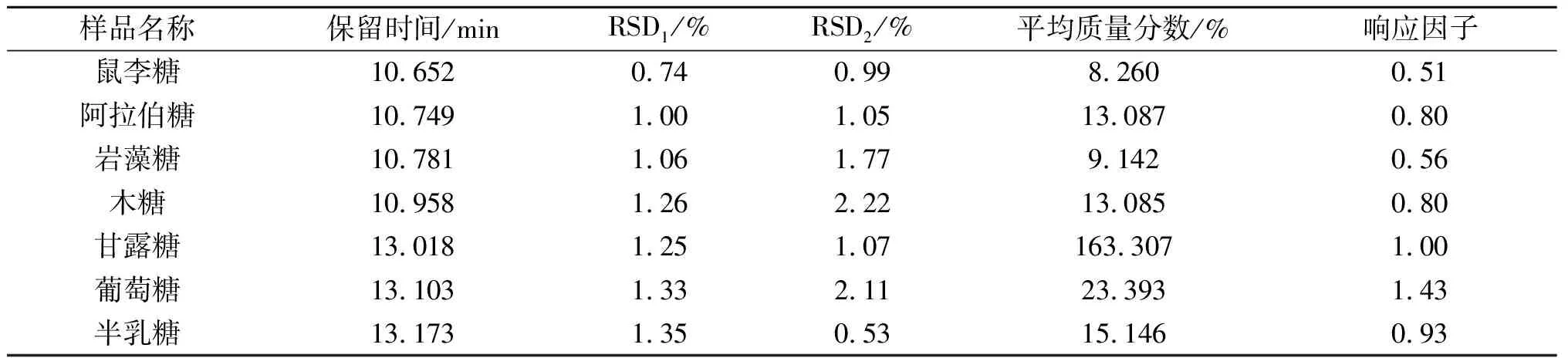
表3 混合标准品气相色谱结果及分析
经GC-MS测定图8,比对图7可以看出:AAP80-3a中主要含有一种多糖,另含的两种单糖量很少,对照单糖混标的出峰时间表3,可以看出其主要含有D-葡萄糖,另外还含有少量的D-甘露糖和D-半乳糖,其摩尔比为1∶0.26∶0.15.

1—鼠李糖(10.652 min);2—阿拉伯糖(10.749 min);3—岩藻糖(10.781 min);4—木糖(10.958 min);5—甘露糖(13.018 min);6—葡萄糖(13.103 min);7—半乳糖(13.173 min)

图8 AAP80-3a的乙酰化衍生物总离子流图
3 结 论
本研究采用传统的水提醇沉提取工艺,得到了提取温度90 ℃,提取时间4 h,提取次数4次,料液比1∶70的黑木耳多糖最佳提取工艺.黑木耳多糖得率为6.89%,多糖质量分数为71.62%.黑木耳粗多糖对大多数革兰氏阳性细菌金黄色葡萄球菌和革兰氏阴性细菌大肠杆菌均有较强的抑菌作用,且对金黄色葡萄球菌的抑制作用大于大肠杆菌,而对于枯草芽孢杆菌和藤黄微球菌没有抑制作用.对真菌啤酒酵母菌和黑曲霉也没有抑制生长作用.实验中得出了黑木耳粗多糖最低抑菌浓度低,但是黑木耳粗多糖的抗菌机理有待进一步研究.从黑木耳子实体提取的多糖AAP80经DEAE-Sepharose Fast Flow离子交换层析后得到组分AAP80-3,AAP80-3经SephacrylS-400凝胶柱层析纯化得到单一多糖组分AAP80-3a.AAP80-3a主要含有D-葡萄糖、D-甘露糖和D-半乳糖,其摩尔比为1∶0.26∶0.15.
参考文献:
[1] 张大为,赵亮,刘同军,等.黑木耳多糖及其生物活性[J].食品与药品,2007,9(9):68-70.
[2] 郑炯,黄明发,张坤.黑木耳多糖生物活性研究进展[J].粮食与油脂,2006(10):45-47.
[3] 王雪.AAPⅠ-a黑木耳多糖的分离纯化及其抗衰老功能的研究[D].哈尔滨:哈尔滨理工大学,2009.
[4] 樊黎生.黑木耳多糖AAP-Ⅱa级分的制备及其生物活性的研究[D].武汉:华中农业大学,2006.
[5] 李公斌.硫酸酯化黑木耳多糖的抑菌功能[J].食品研究与开发,2011,32(2):31-33.
[6] 邓颖琳.金针菇子实体多糖的提取、分离纯化及结构鉴定[D].杭州:浙江工业大学,2011.
[7] 许媚.秀珍菇子实体多糖的分离纯化、结构鉴定和生物活性研究[D].杭州:浙江工业大学,2013.
[8] 夏尔宁,陈琼华.黑木耳多糖的分离、纯化和鉴定[J].生物化学与生物物理学报,1988,20(6):614-618.
[9] UKAI S, MORISAKI S, GOTO M, et al. Polysaccharides in fungi. VII. Acidic heteroglycans from the fruit bodies of auricularia auricula-judae quél[J]. Chemical & Pharmaceutical Bulletin,1982,30(2):635-643.
[10] 戴五好,钱利武,杨士友,等.苦参、山豆根生物碱及其总碱的抑菌活性研究[J].中国实验方剂学杂志,2012,18(3):177-180.
[11] BELLIK Y. Total antioxidant activity and antimicrobial potency of the essential oil and oleoresin of Zingiber officinale Roscoe[J]. Asian Pacific Journal of Tropical Disease,2014,4(1):40-44.
[12] CHENG Hao-ran, FENG Shi-ling, SHEN Shi-an, et al. Extraction, antioxidant and antimicrobial activities of Epimedium acuminatum Franch polysaccharide[J]. Carbohydr Polym,2013,96(1):101-108.
[13] ZANETTA J P, BRECKENRIDGE W C, VINCENDEN G. Analysis of monosaccharides by gas-liquid chromatography of the O-methyl glycosides as trifluoroacetate derivatives:application to glycoproteins and glycolipids[J]. Journal of Chromatography A,1972,69(2):291-304.
[14] RUMPEL C, DIGNAC M F. Gas chromatographic analysis of monosaccharides in a forest soil profile: analysis by gas chromatography after trifluoroacetic acid hydrolysis and reduction-acetylation[J]. Soil Biology and Biochemistry,2006,38(6):1478-1481.
[15] 刘俊花,孙勇民.酸浆宿萼水溶性多糖纯化及结构研究[J].食品科学,2008,28(11):94-98.
