人RANKL胞外结构域原核表达载体的构建及表达条件优化
2014-08-24潘继承汪劲松
张 琴,潘继承,汪劲松
(湖北师范学院 生命科学学院, 湖北 黄石 435002)
人RANKL胞外结构域原核表达载体的构建及表达条件优化
张 琴,潘继承,汪劲松
(湖北师范学院 生命科学学院, 湖北 黄石 435002)
细胞核因子κB受体活化因子配体(Receptor activator of the NF-κB ligand , RANKL)是TNF超家族的重要成员之一,属于Ⅱ型跨膜蛋白,通过与其受体核因子κB受体活化因子(RANK) 构建的信号通路参与乳腺癌的发生、肿瘤骨转移、骨质疏松、关节炎等病理过程。人RANKL胞外结构域基因片段与原核表达载体pET-21b融合并转化至表达菌Rosetta,并对其表达条件进行了优化。通过对诱导时机,诱导温度,异丙基-β-D-硫代吡喃半乳糖苷(IPTG) 浓度,诱导时间及甘油浓度的条件优化表明,当IPTG的浓度为0.2 mmol/mL, 20 ℃振荡诱导培养6 h 时,甘油浓度为4%时,可在上清中获得高效表达的pET-21b-RANKL融合蛋白,为该蛋白的进一步纯化及结构与功能研究打下了良好的基础。
人RANKL胞外结构域;大肠杆菌;重组蛋白;表达条件
细胞核因子κB受体活化因子配体(Receptor Activator of Nuclear Factor-κB Ligand, RANKL),是肿瘤坏死因子(TNF)受体超家族成员之一,源于滑膜组织[1,2],主要表达于破骨细胞前体细胞的表面,在淋巴组织(淋巴结、 胸腺、 脾、 胎肝)及骨组织(骨骼、骨髓)中含量高,而在心、胎盘、骨骼肌、胃和甲状腺等非淋巴样组织中仅有低度表达[3,4]。成骨细胞、 骨髓基质细胞、 软骨基质周围的原始间充质细胞和肥大型软骨细胞T以及激活的淋巴细胞均表达RANKL[5]。
RANKL是由单个基因编码。然而,可变剪接导致了三个亚型的表达。在人体中,有两种亚型均为II型跨膜蛋白,分别含有317个氨基酸[6]和270个氨基酸,含有270个氨基酸的RANKL与含有317个氨基酸的区别仅在于具有较短的胞内结构域[7]。第三种亚型只含有243个氨基酸,没有跨膜结构域和胞内结构域,而是一种可溶性蛋白,称为sRANKL[7,8]。每一种亚型只有当他们各自聚合成同源三聚体以后才具有生物活性[9,10]。RANKL与其受体RANK以六聚体的形式结合并将信号传递至NF-κB信号通路,最终促进破骨细胞前体细胞的分化与成熟。因此,RANKL在破骨细胞增殖、分化、活化、存活以及肿瘤细胞凋亡、肿瘤发生、肿瘤转移等一系列生理过程中起着十分重要的作用。
本研究首先通过基因工程技术将人RANKL基因克隆到原核表达载体上,再转化到大肠杆菌Rosetta中,诱导使其表达目的蛋白。通过诱导时机、诱导温度、IPTG 浓度、诱导时间、甘油浓度等五个影响因子对重组人RANKL胞外结构域的菌株进行可溶性表达及条件优化,旨在为该蛋白进一步的分离纯化、功能鉴定和配体筛选奠定基础。
1 材料与方法
1.1质粒与菌株
原核表达载体pET-21b、克隆菌株DH 5α、表达菌种Rosetta由实验室保存。
1.2试剂及工具酶
Ex-Taq DNA 聚合酶、T4 DNA 连接酶购自大连TaKaRa公司;限制性内切酶 NdeI、XhoI购自Sigma公司;蛋白质Marker购自上海生工生物工程有限公司;胶回收纯化试剂盒为天根生化科技(北京)有限公司产品;异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、氨苄青霉素(Amp)购自Amresco公司, 其余所用试剂均为国产或进口分析纯试剂。
1.3引物设计与合成
根据在NCBI上人RANKL基因cDNA序列(GenBank 登陆号: NM_003701.3)的开放阅读框设计,利用Primer 5软件设计一对特异性引物。
上游引物:RANKL-F: 5'-GGAATTCCATATGAGAGCAGAGAAAGCGATGGT-3'
下游引物:RANKL-R: 5'- CCGCTCGAGATCTATATCTCGAACTTTAAAAG-3'
由上海生工生物工程有限公司合成。预期扩增片段 532 bp,其中在上游和下游引物5'端各引入Nde I和Xho I酶切位点(下划线标出)和保护碱基。
1.4目的片段的扩增与回收
采用人工合成的人RANKL 基因作为模板进行 PCR 扩增。PCR 反应体系为:RANKL-F (10
μ mol) 0.5 μL, RANKL-R (10 μ mol) 0.5 μL, cDNA模板0.5 μL, 超纯水11 μL, Mix混合物12.5 μL.
PCR 反应条件为:94℃预变性3 min;94℃变性 30 s, 58℃退火30 s, 72℃延伸45 s, 35个循环;72℃延伸10 min. PCR 扩增产物以1.0%琼脂糖凝胶电泳检测分离,采用DNA 凝胶回收试剂盒回收目的条带。
1.5重组质粒pET-21b-RANKL的构建与鉴定
将回收的 PCR产物与pET-21b用Xho I和Nde I进行双酶切,电泳检测,将目的条带切胶过柱回收DNA片段。在T4连接酶作用下将RANKL基因与线性pET-21b载体连接,构建表达载体pET-21b-RANKL,转化 DH 5α后利用Amp抗性平板筛选阳性克隆进行PCR、双酶切及测序(上海生工生物工程有限公司)鉴定,以确定开放阅读框编码正确。DH 5α的转化参照文献[5]进行。
1.6RANKL基因在大肠杆菌中的表达
将重组质粒pET-21b-RANKL 转化至Rosetta感受态细胞,构建重组菌株 Rosetta/pET-21b-RANKL,挑取含阳性重组表达质粒的单克隆菌落接种于LB 液体培养基 (含Amp 100 μg/mL) 中,37℃活化过夜,再按1∶100 稀释到LB 中,37℃培养至OD600约为0.6-0.8时,加入IPTG 至终浓度为1.0 mmol/mL , 于 37℃、200 rpm培养5 h , 将诱导表达后收集的菌体置于冰水浴中超声破菌, 12000 rpm离心10 min , 取上清和沉淀与上述菌体一起进行15% SDS- PAGE电泳,分析目的蛋白的可溶表达情况,方法参照文献[11]进行。
1.7重组菌株原核表达条件优化
将重组菌株Rosetta/pET-21b-RANKL按照1%接种量分别接种到含 100 mL LB液体培养基 (含Amp 100 μg/mL) 三角瓶中,做多个平行实验,进行以下条件优化:
1) 诱导时机
在37℃条件下培养至OD600分别为 0.4、0.6、0.8和1.0时,加入IPTG使其终浓度为1.0 mmol/mL , 37 ℃继续培养6 h.
2)温度
在37 ℃条件下培养至 OD600为0.6时,加入IPTG使其终浓度为1.0 mmol/mL , 后将菌液均分为5份,分别于15 ℃、20 ℃、25 ℃、30 ℃和 37 ℃诱导6 h.
3)IPTG 浓度
在37 ℃条件下培养至OD600为0.6 时,均分为6份,加入 IPTG 使其终浓度分别为0、0.2、0.4、0.6、0.8、1.0 mmol/mL , 37 ℃继续培养6 h.
4)诱导时间
在37 ℃条件下培养至 OD600为 0.6时,加入 IPTG 使其终浓度为1.0 mmol/mL , 37 ℃继续培养,分别于0、2、4、6、8 和10 h 取样。
5)甘油含量
将重组菌株Rosetta/pET-21b-RANKL按照1%接种量分别接种到1个含 100 mL LB液体培养
基(含Amp 100 μg/mL)三角瓶中,于37 ℃条件下培养至OD600为0.6时,加入IPTG使其终浓度为
1.0 mmol/mL , 分别加入甘油,使其占总体积的2%、4%、6%、8%、10% , 37 ℃继续培养6h.
上述条件下获得的样品,进行15% SDS- PAGE电泳,分析目的蛋白的可溶表达情况,方法参照文献[11]进行。
2 结果与分析
2.1pET-21b-RANKL表达载体PCR和酶切检测
由图1可以看出,表达载体PCR 产物经琼脂糖凝胶电泳显示,在550 bp左右的位置有清晰的特异性条带;重组质粒经双酶切后,得到大小约为550 bp和5300 bp的两个片段,与预期结果一致(如图2);测序结果显示RANKL基因开放阅读框连接正确,说明已成功构建重组质粒pET-21b-RANKL.

图1 PCR产物的琼脂糖凝胶电泳
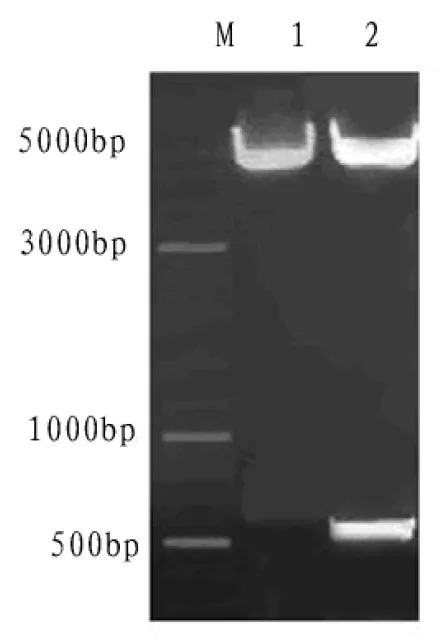
图2 重组质粒pET-21b-RANKL经NdeI/XhoI酶切后的琼脂糖凝胶电泳
2.2重组质粒pET-21b-RANKL在Rosetta中的表达
由图3中可以看出,Rosetta/pET-21b-RANKL重组菌株诱导后在20 kDa处有一条显著表达条带,与软件预测大小相一致;经超声破碎后电泳发现重组目的蛋白主要形成包涵体,可初步确定重组目的基因实现在E.coli 中的表达。
2.3重组菌株原核表达条件优化
1)诱导时机对重组蛋白表达的影响
选择OD600为0.4-1.0的菌液分别进行诱导培养,图4所示为不同菌液OD600诱导目的蛋白表达的差异性,诱导时机对重组蛋白表达量的影响较大,菌体的蛋白含量呈现先增加后下降的趋势,当菌液OD600为0.6时,诱导菌体蛋白可溶性表达量最大。
2)诱导温度对重组蛋白表达的影响
通过图5的 SDS-PAGE电泳图可以看出,诱导温度对重组蛋白表达量的影响较大。在20 ℃条件下震荡培养6 h后,可获得较高的可溶性目的蛋白表达量。
3)诱导时间对重组蛋白表达的影响
由图6可以看出,诱导两小时后就有融合蛋白开始表达,随着诱导时间的延长,可溶性蛋白表达量逐渐提高,在6 h时表达量最大,继续延长诱导时间则蛋白表达量没有继续增加,而杂蛋白的量却有所增加。

图3 重组菌株Rosetta /pET-21b-RANKL 诱导蛋白表达的SDS-PAGE 图( M. 标准蛋白marker; 1.未诱导上清; 2.未诱导沉淀; 3.诱导上清;4.诱导沉淀;黑色箭头所示为目标蛋白)

图4 Rosetta /pET-21b-RANKL在不同OD600诱导蛋白表达量的SDS-PAGE 图( M. 标准蛋白marker; 1-4.重组菌株OD600值分别为0.4、0. 6、0. 8、1. 0 诱导6h;黑色箭头所指为目标蛋白)

图5 Rosetta /pET-21b-RANKL在不同诱导温度下目的蛋白表达量的SDS-PAGE 图( M. 标准蛋白marker; 1-5.重组菌株在15 ℃、20 ℃、25 ℃、30℃、37 ℃诱导6h;黑色箭头所指为目标蛋白)
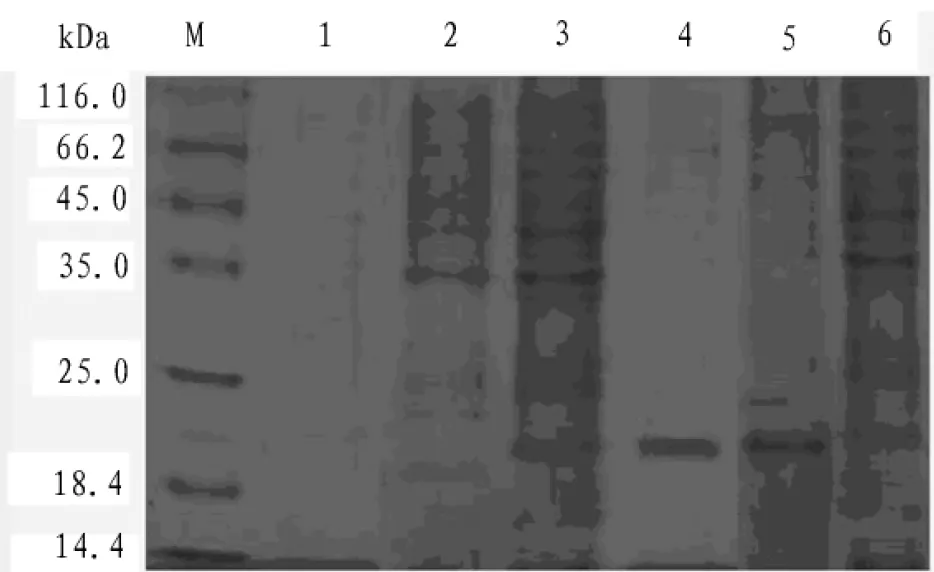
图6 Rosetta /pET-21b-RANKL在不同IPTG 浓度诱导下的蛋白表达量的SDS-PAGE 图( M.标准蛋白marker; 1-.重组菌株在诱导时间分别为0、2、4、6、8、10 h 诱导;黑色箭头所指为目标蛋白)
4)IPTG 浓度对重组蛋白表达的影响
通过SDS-PAGE电泳图可以看出,重组菌株Rosetta/pET-21b-RANKL蛋白表达量在终浓度为0.2 mmol/mL时,可溶性蛋白表达量最大,继续增加IPTG浓度并未出现表达量增加(见图7)。
5)甘油含量对重组蛋白表达的影响
通过SDS-PAGE电泳图可以看出,甘油含量对重组蛋白表达量的影响较大。在加入2%甘油下诱导,蛋白表达量增加,在4%的甘油诱导条件下,可溶性蛋白表达量最大(见图8)。
3 讨论
RANKL及RANKL/RANK/OPG系统目前已经成为代谢性骨疾病领域最引人关注的科研热点[12]。目前关于RANKL在骨代谢系统和免疫系统中的作用、介导骨吸收的信号传递过程以及它与其它骨吸收调节因子的调控关系等有待于深入研究。采用基因工程的方法制备RANKL蛋白质可为其进一步研究奠定基础。
本实验所用的pET-21b即是一类高效融合蛋白表达载体。本研究在设计RANKL引物时,在上游引物RANKL-F和下游引物RANKL-R的两端加入了限制性内切酶 Nde I和Xho I位点。通过酶切使目的片段和载体切成含粘性末端的DNA 片段,有利于下一步克隆连接。采用抗性筛选、PCR鉴定以及测序分析相结合的方法对重组质粒进行阳性筛选,增加了实验结果的可靠性。
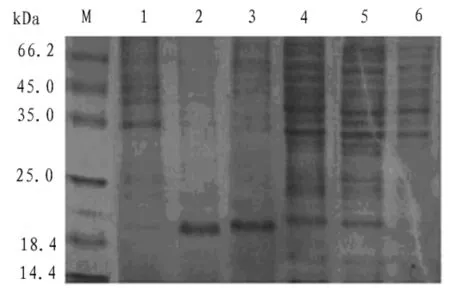
图7 Rosetta/pET-21b-RANKL在不同的IPTG诱导浓度下蛋白表达量的SDS-PAGE图 (M.标准蛋白marker;1-6.重组菌株在IPTG浓度为0.0 mM、0.2 mM、0.4 mM、0.6 mM、0.8 mM、1.0 mM诱导6 h;黑色箭头所指为目标蛋白)

图8 Rosetta/pET-21b-RANKL在不同浓度甘油诱导的蛋白表达量的SDS-PAGE电泳图(M.标准蛋白marker;1-5;重组菌株在2%、4%、6%、8%、10%甘油;黑色箭头所指为目标蛋白)
利用基因工程法获得大量廉价的肽类物质和稀有蛋白,能够解决天然资源匮乏分离纯化困难化学合成昂贵等问题[13]。但是外源基因在异源表达时,受多种因素影响[14]。本实验通过对诱导时机、诱导温度、IPTG浓度、诱导时间及诱导时加入甘油含量等条件的摸索,找出最佳的诱导条件,对重组体在大肠杆菌中实现高效可溶性表达。当菌液OD600为0.6时诱导菌体蛋白表达量最高,OD值过低或过高都不利于蛋白的表达。因此过早诱导造成生物质和目的蛋白产量偏低,同时也增加了染菌的机会;诱导较晚虽可获得高产量的生物质,但细胞表达外源蛋白的时间则减少,总的蛋白量仍然偏低。温度可能是影响外源蛋白在大肠杆菌中获得高水平表达的最重要因素之一[15]。本实验结果表明20 ℃时目的蛋白表达量最高。温度过高过低都会影响酶系统催化作用,从而降低目的蛋白的表达量。诱导时间的不同会影响到外源基因的表达以及工程菌的稳定性和活性。在本实验中,随着诱导时间的延长,目的蛋白的表达量逐渐增加,但是当诱导时间大于6 h后,目的蛋白的表达量逐渐减少,这与有关文献报道一致[16]。当IPTG 浓度为 0.2 m mol/mL时目的蛋白表达量最高, 随着 IPTG浓度增加目的蛋白表达量有下降趋势,过高或过低都会影响目的蛋白的表达量。IPTG浓度较低时蛋白表达量较低,可能是诱导剂对T7启动子的诱导强度较低所致;而较高浓度对目的蛋白表达的影响,可能是由于IPTG对细菌生长有一定的抑制作用导致[17]。甘油含量对重组蛋白表达量的影响较大。在甘油含量为4%时,可获得较高的目的蛋白表达量,甘油含量过低或过高都可能会导致蛋白形成包涵体量的增加。
综上所述,我们已经成功地构建了重组原核表达质粒pET-28b-RANKL.通过对重组菌株Rosetta/pET-28b-RANKL蛋白表达条件优化,确定了最佳诱导时机OD600及诱导时间分别为0.6和6 h, 最佳诱导温度为20℃, 最佳IPTG浓度为0.2 m mol/mL, 最佳甘油含量为4%. 为该蛋白进一步的分离纯化、功能鉴定和配体筛选奠定了基础。
[1]GravIIese EM, Manning C, Tsay A. Synovial tissue in rheumatoidarthritis is a source of osteoclast differentiation factor[J]. Arthritis Rheum,2000, 43:250~252.
[2]Kayanagi H, Iizuka H, Juji T. Involvement of receptor activator of nuclear factor B ligand osteoclast differentiation factor in osteoclastogenesis from synoviocytes in rheumatoid arthritis[J]. Arthritis Rheum,2000, 43:259~261.
[3]Lacey D L, Timms E, Tan H-l, et al. Osteoprotegerin (OPG) ligand is a cytokine that regulates osteoclast differentiation and activation[J].Cell,1998, 93:165~176.
[4]Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL[J]. Proc Natl Acad Sci,1998, 95:3597~3602.
[5]刘继中,纪宗玲, 陈苏民. OPG/RANKL/RANK系统与骨破坏性疾病[J]. 生物工程学报,2003,19:55~659.
[6]Warren G. Sorting signals and cellular membranes 2nd ed, 1993:72~166.
[7]Ikeda T, Kasai M, Utsuyama M, et al. Determination of three isoforms of the receptor activator of nuclear factor-KB ligand and their differential expression in bone and thymus[J]. Endocrinology.2001, 142: 1419~1426.
[8]Sordillo EM, Pearse RN. RANK-Fc: a therapeutic antagonist for RANK -L in myeloma[J]. Cancer.2003, 97:802~812.
[9]Drugarin D, Drugarin M, Negru S, et al. RANKL-RANK/OPG molecular complex-control factors in bone remodeling[J]. Timisora Med J 2003, 53:297~302.
[10]Ito S, Hata T. Crystal structure of RANK ligand involved in bone metabolism[J]. Vitam Horm,2004, 67:19~33.
[11]萨姆布鲁克 J, 拉塞尔 D W, 黄培堂. 分子克隆实验指南[M]. 3版.北京: 科学出版社, 2002.
[12]姚 静, 侯加法. OPG/RANKL/RANK系统的研究进展[J]. 动物医学进展, 2006, 27(2):5~9.
[13]张 姝, 王 敏, 韩梅琳,等. 基因重组大肠杆菌表达 HrpNEcc 蛋白的发酵条件及诱导条件优化[J]. 中国生物工程杂志, 2009, 29 (10) : 44~49.
[14]卢晟晔, 王丽颖. 大肠杆菌中外源蛋白高效表达的影响因素及策略研究的新进展[J]. 中国实验诊断学, 2006,10(9):1100~1103.
[15]Joseph Sambrook,David W Russell. 分子克隆实验指南[M]. 3 版.黄培堂,译. 北京: 科学出版社, 2002.
[16]潘 滨, 吴建祥, 李桂新,等. 烟草曲茎病毒复制相关蛋白基因原核表达条件优化[J].浙江大学学报(农业与生命科学版), 2007, 33(1): 24~28.
[17]陆 海, 吴 薇, 曾庆银,等.大肠杆菌 BL21(DE3)中表达重组蛋白的研究[J].北京林业大学学报, 2001, 23(6): 1~4.
TheconstructionofprokaryoticexpressionvectorandoptimizationofexpressionconditionsoftheextracelluarDomainofHumanRANKL
ZHANG Qin,PAN Ji-cheng,WANG Jin-song
(College of Life Sciences, Hubei Normal University, Huangshi 435002,China)
The receptor activator of nuclear factor-kappa B ligand (RANKL) is an important member of the TNF superfamily, which is a type II transmembrane protein, and its cognate ligand, RANK (receptor activator of nuclear factor-kappa B) built the signaling pathway in the occurrence of breast cancer, bone metastases, osteoporosis, arthritis and other pathological processes. In this article, the extracellular domain of human RANKL gene were cloned into prokaryotic expression vector pET-21b and transformed into the expression bacteria E. coli Rosetta. We successfully constructed recombinant human RANKL gene Rosetta/pET-21b-RANKL. And it was induced to express the target protein. We optimized its expression conditions. When the IPTG concentration was 0.2 mmol/mL, the induced timing OD600 for 0.6, oscillation induced culture for 6 h in 20 ℃ and glycerol concentration for 4%, we can efficiently expressed the extracellular domain of human RANKL fusion protein (pET-21b-RANKL) in the supernatant. It provided a foundation for further purification of the protein and researched its structure function.
the extracellular domain of human RANKL;Escherichia coil;recombinant protein;expression conditions
2013—04—28
张琴(1987— ),女,湖北十堰人,硕士,研究方向为蛋白质结构与功能.
Q7
A
1009-2714(2014)01- 0048- 06
10.3969/j.issn.1009-2714.2014.01.010
