聚乙二醇介导细胞融合的优化条件探究
2014-08-24严镇钧张小兵
严镇钧,张小兵
(1.湖北师范学院 生命科学学院, 湖北 黄石 435002;2.湖北省黄石市第十八中学,湖北 黄石 435001)
聚乙二醇介导细胞融合的优化条件探究
严镇钧1,张小兵2
(1.湖北师范学院 生命科学学院, 湖北 黄石 435002;2.湖北省黄石市第十八中学,湖北 黄石 435001)
细胞融合技术是细胞工程中的一项核心基础技术,聚乙二醇(PEG)是最常用的促融剂,广泛地被应用于农业、医药、环保等多个领域。探讨更符合细胞工程要求的、融合后的细胞更大限度地保持生理活性的、快速、有效的细胞融合条件。以牛红细胞为实验材料,PEG作促融剂介导牛红细胞融合,研究不同的融合温度、PEG作用时间、PEG的相对分子质量和PEG的质量分数等因素对细胞融合率的影响。实验结果表明,选择融合温度为39℃,时间为15min,选用相对分子质量为2000、质量分数为45%的PEG,可以在细胞受毒害较小的同时得到最佳的融合效果,融合率能达到21.26%.
细胞工程;聚乙二醇;使用条件优化研究
细胞工程是四大生物工程之一,其核心基础技术之一是细胞融合技术。细胞与组织不同,不排斥异类、异种细胞,因此细胞融合不受种属的局限,可实现种间生物体细胞的融合,使远缘杂交成为可能,因而是改造细胞遗传物质的有力手段。它的意义在于从此打破了仅仅依赖有性杂交重组基因创造新种的界限和生殖壁垒,极大地扩大了遗传物质的重组范围;细胞融合技术避免了分离、提纯、剪切、拼接等基因操作,在技术和仪器设备上的要求不象基因工程那样复杂,投资少,有利于广泛开展研究和推广,有着重大的实践意义。
人工细胞融合开始于20世纪50年代,60年代到70年代作为一门新兴的技术发展很快,有力地推动了生物科学各领域的发展,目前,细胞融合技术已成为研究细胞遗传、细胞免疫、肿瘤和生物新品种培育的重要手段,其应用范围极广,已在农业、医药、环保等领域取得了开创性的研究成果,而且应用领域不断扩大,其发展前景及产生的影响日益显著。
目前有许多促使细胞融合的技术,但有些技术还处于刚刚起步阶段,尚不成熟,或者存在某种生产应用方面的缺陷,例如利用灭活的仙台病毒介导细胞融合尽管可以得到较高的融合率,对各种动物细胞都适宜,并且仙台病毒能在牛胚中大量繁殖,但其缺点是操作复杂、不稳定,在保存过程中促融合活性会降低,并且制备过程比较烦琐,而且病毒引进细胞后,可能会对细胞的生命活动产生干扰,正是由于这些缺点,目前灭活的仙台病毒已逐渐被聚乙二醇(Polyethyleneglycol,PEG)取代;利用激光融合技术虽然易于实现特异性细胞融合,参数易于控制,操作方便,而且实验重复性好,但它只能逐一处理细胞,不能像PEG一样同时处理大量细胞[1]。
自从20 世纪70 年代Kao和Michayluk用PEG成功介导大麦、大豆等植物原生质体融合后[2],PEG法介导细胞融合以其容易制备、活性稳定、不需要特别的仪器设备、操作简便等优点, 被普遍地
应用于生物、遗传、医药等研究领域,并且是目前应用最广泛的细胞融合的促融剂。2009年,Huynh NT等利用聚乙二醇介导细胞融合技术发展了纳米医学中的一个新领域-脂质毫超微囊剂技术[3]。Ogawa F等用PEG介导经紫外线照射形成的肿瘤细胞和转入了IL-2基因或LacZ基因的树状细胞融合,融合细胞表达出了组织相容性复合体(Major Histocompatibility Complex,MHC)classI、MHCclassII、CD86、CD11c和CD8alpha[4]。Dan K等用PEG介导细胞融合的技术证明了能高效抑制单纯疱疹病毒(HSV)复制的多金属氧酸盐PM-19并非是在病毒感染的融合阶段起作用[5]。
另外,单克隆抗体技术就是通过细胞融合技术发展起来的,对生命科学的研究及医学方面的应用产生了重大影响,其中,PEG作为促融剂发挥了不可替代的作用,比如,Bhanuprakash V等用激活的淋巴细胞和骨髓瘤细胞通过PEG介导融合制造了蓝舌病病毒的单克隆抗体[6]。Changhee Yoo等用PEG(Mr=1500)介导经热处理后的前列腺癌细胞(DU145 cells)和成熟的抗原呈递细胞树状细胞(Dendritic cells ,DCs)进行杂交,制备前列腺癌细胞系疫苗[7]。Guo GH等用50% PEG介导食管癌细胞系(esophageal carcinoma cell line 109,EC109)和树状细胞(Dendritic cells ,DCs)融合产生抗肿瘤的杂交疫苗[8]。Homma S等用自体树状细胞和自体胃癌细胞通过PEG介导融合,使细胞产生抗体,再将融合后的细胞每两周一次地注射到严重胃癌的患者皮下,取得了有效的临床治疗效果[9]。总之,利用PEG作促融剂的细胞融合技术,已经得到了广泛应用,而在这些应用中,学者们采用的实验条件是不一样的[10~14]。
目前,人们有时采用PEG介导融合技术和一些物理手段如激光融合技术相结合的方法,以进一步提高融合率。但是,影响PEG作用效果的因素较多,加大了获得理想细胞融合率的难度[15]。本文从融合温度、时间、PEG质量分数和相对分子质量等几个方面,对PEG应用于细胞工程中的最适条件做了探讨。
1 材料和方法
1.1材料
Alsver 液(pH7.4)、0.85%生理盐水、GKN 液、PEG(Mr=600)、PEG(Mr=1000)、PEG(Mr=2000)、PEG(Mr=4000)、PEG(Mr=6000)、健康牛静脉血。
1.2方法
1.2.1 牛红细胞的获得 取健康牛静脉血10mL至盛有40mL Alsver溶液的瓶中,混匀后置于4℃冰箱,可保存一周。实验时取牛血1mL,移入10mL离心管, 加入4mL 0.85%生理盐水混匀,1200r/min离心5 min;弃上清液,加0.85%生理盐水5mL,用指弹法将细胞团块弹散,混匀后1000r/min离心5min,重复上述条件,再离心洗涤1次。收集最后1次离心沉淀的红细胞。
1.2.2 细胞融合温度的选择 用血细胞计数法计数,将红细胞以预热的GKN液稀释成细胞密度为2×107/mL的牛红细胞悬液;分别取悬液1mL到5个试管中,每个试管加入0.5mL预热的质量分数为50%的PEG(Mr=4000)混匀,将试管分别置于33℃、35℃、37℃、39℃、41℃水浴中温浴15min;取融合后的细胞观察并统计融合率。
1.2.3 细胞融合时间的选择 在最适融合温度下,分别温浴5min、8min、13min、15min、17min,取融合后的细胞统计融合率。
1.2.4 PEG质量分数的选择 在最适温度下,分别用质量分数为35%、40%、45%、50%、55%、60%、65%的PEG作为促融剂进行细胞融合,在最适融合时间取融合后的细胞统计融合率。
1.2.5 对PEG的选择 在最适温度下,分别用最适质量分数的PEG(Mr=600)、PEG(Mr=1000)、PEG(Mr=2000)、PEG(Mr=4000)、PEG(Mr=6000)作为促融剂进行细胞融合,在最适融合时间取融合后的细胞统计融合率。
1.2.6 细胞融合率的计算 每一次计算融合率时观察统计5个视野。在显微镜视野内,计数观察到的所有细胞核数以及其中已经发生融合的细胞的细胞核数,计算已经发生融合的细胞的细胞核数占细胞核总数之百分比即为融合率。
2 结果与分析
2.1PEG介导细胞融合条件的选择
2.1.1 细胞融合温度 温度是影响细胞融合的重要因素。从实验数据可以看出,当温度不超过39℃时,细胞的融合率随着温度的升高而增加,温度在39℃时融合率达到最大值,为23.24%,继续升高融合温度,融合率呈迅速的下降趋势,当温度升至41℃仅为17.75%(图1)。因此,融合温度选择在35℃~39℃.
2.1.2 细胞融合时间 将细胞融合温度控制在39℃,融合时间为15min时,融合率达到最大值25.45%,当继续延长融合时间时,融合率并没有随着时间的增加而增加,至17min时,融合率为25.34%(图2),并且随着时间的增加,视野中出现了越来越多的细胞破碎现象,表现为观察到的完整细胞越来越少(表1)。因此,融合时间选择在8~15 min.
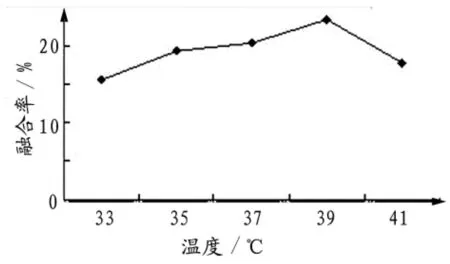
图1 温度对牛红细胞融合率的影响
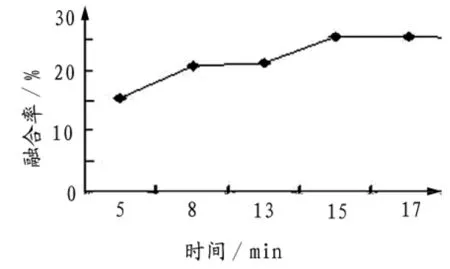
图2 PEG作用时间对牛红细胞融合率的影响
2.1.3 PEG质量分数 分别用不同质量分数的PEG作为细胞融合的促融剂,结果表明,融合温度在39℃,融合时间为15min时,细胞融合的效率随着PEG质量分数的增加而升高(图3)。但是,PEG具有一定的毒性,且其质量分数越大对细胞的毒性越大,极大地影响了融合率和融合后细胞的存活率[16],因此,PEG的质量分数选择在45%~55%.
2.1.4 PEG的相对分子质量分别用Mr为600、1000、2000、4000、6000的五种PEG来进行比较研究,结果表明,在这几种PEG中,相对分子质量为600的PEG介导细胞融合的效率最低,只有14.55%,随着相对分子质量的增加,融合率也增加,到相对分子质量为4000时,融合率高达25.73%,当PEG的相对分子质量为6000时,融合率略微升至25.87%(图4)。考虑到PEG的相对分子质量越大,对细胞的毒性也越大,因此,PEG的相对分子质量选择在1000~4000.
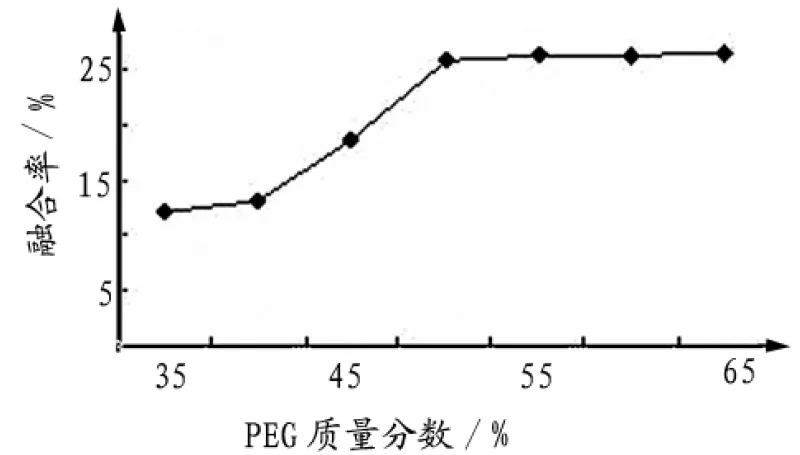
图3 不同的PEG质量分数对牛血细胞融合率的影响
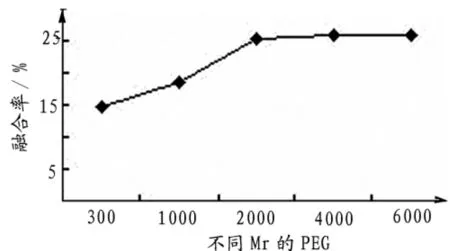
图4 不同Mr的PEG对牛红血细胞融合率的影响
2.2PEG介导细胞融合条件参数的优化和选择
以融合温度、融合时间、PEG质量分数和相对分子质量分别为实验因子,每因子分别取3水平作正交实验。正交因素水平表见表1,结果见表2.

表1 正交实验水平因素表

表2 L9 (34)正交实验结果
从表2可以看出:对细胞融合率的影响最大的因素是时间,其次是温度,然后依次是PEG的相对分子质量和PEG的质量分数;所以,融合条件的最优水平组合是A3B3C3D3.最佳条件重复性实验结果见表3.

表3 最佳条件的重复性实验
由表3知,最佳条件的重复性较好,故可确定最佳融合条件:温度为39℃、时间为15min、PEG的相对分子质量为4000、质量分数为55%,融合率为25.69%.
但是, PEG的相对分子质量越大、质量分数越高,对细胞的毒性也就越大,而这两个因素相对而言并不是影响融合率的主要因素,所以,在实际应用中,可以在保证融合效果的前提下,尝试使用对细胞毒性较小的条件。
由于PEG的质量分数相对于其他因素而言,对融合率影响最小,PEG的相对分子质量对融合率的影响也比较小,所以分别用A1、A2代替A3B3C3D3中的A3,用B1、B2代替A3B3C3D3中的B3,将所得融合率值与表3中理论最佳条件的融合率值进行卡方分析,结果见表4.
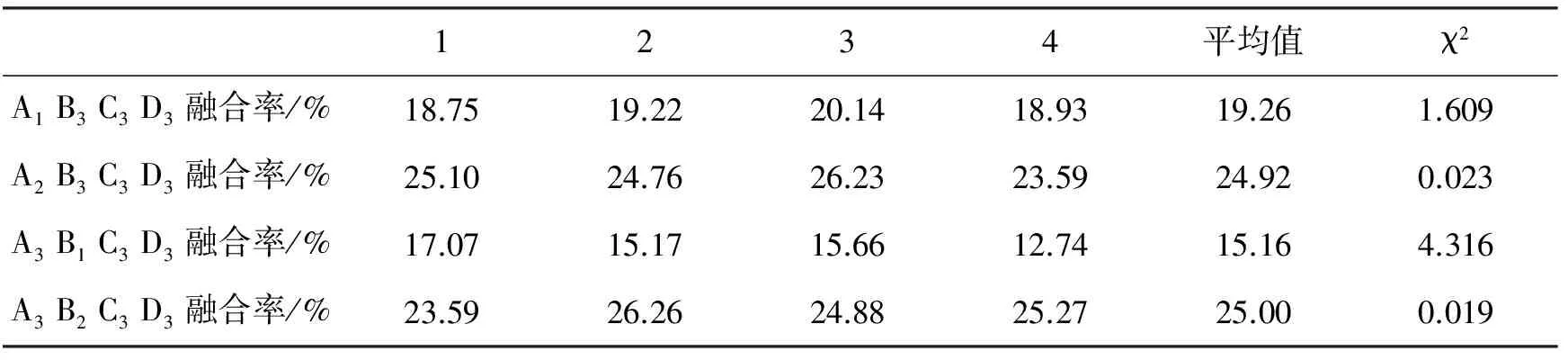
表4 选择条件的优化实验
由表4可知,P(A2B3C3D3)、P(A1B3C3D3)均大于0.05,故在实践中可用A2或A1代替A3.如果用A2代替,则可以获得较多的融合细胞;如果用A1代替,则可以更大程度地减少对细胞的毒害,从减少对细胞的毒害这一思想出发,用A1代替A3更好。P(A3B2C3D3)大于0.05,P(A3B1C3D3)小于0.05,故在实践中如用B1代替B3则得到的融合率太低,而可用B2代替B3.
所以,在实践上,细胞融合条件的一种较理想水平组合宜为A1B2C3D3,重复性实验结果见表5.
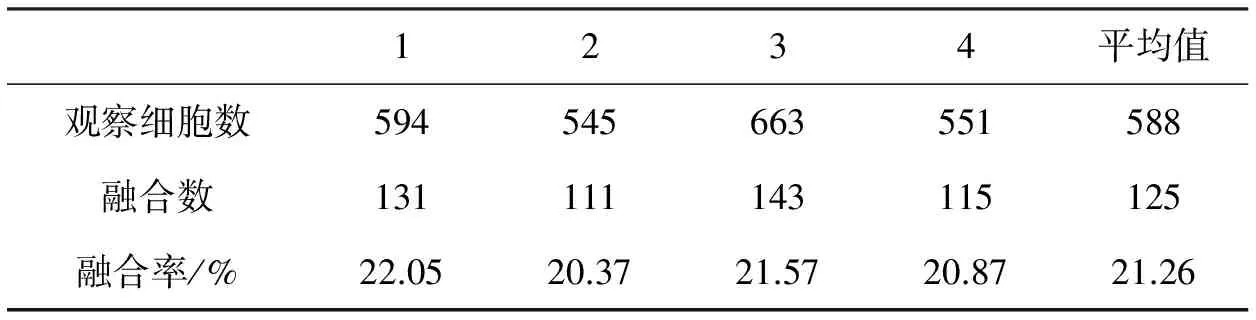
表5 理想选择条件的重复性实验
由表5可看到,该理想选择条件的重复性较好,故可确定在实践中的一种理想融合条件为温度为39℃、时间为15min、PEG的相对分子质量为2000、质量分数为45%,融合率为21.26%.
3 讨论
融合率在一定范围内随温度的升高而增大,在39 ℃时最大,继续升高温度时不仅融合率下降,而且细胞状态不良。细胞融合的最适时间为15 min, 但是随着融合时间的延长,融合率反而有所下降, 这可能是因为PEG作用时间过长, 对细胞毒害太大,导致了更多融合细胞变形甚至破裂所致。
细胞融合率与PEG的相对分子质量及其质量分数成正比, 但PEG的相对分子质量越大、体积分数越高, 对细胞的毒性也就越大。为了兼顾二者, 在以往实验时常常采用的PEG相对分子质量一般为4000和6000,质量分数一般为40%~60%。尽管本实验在选择范围内所用的PEG当相对分子质量为4000,质量分数为55%时,融合率最高,但是时间、温度是影响融合率的主要因素,PEG的相对分子质量和质量分数是次要因素,在实际生产中,对主要因素选取使综合平均值最好的水平,对次要因素可以选取使综合平均值最好的水平,也可以选取细胞受毒害较小的水平进行最优水平组合。用45%的PEG(Mr=2000)取代55%的PEG(Mr=4000),同样也得到了很高的融合率21.26%,而且对细胞的毒害更小,所以在生产实践中较宜选用45%的PEG(Mr=2000),而不是55%的PEG(Mr=4000)。
PEG介导细胞融合受很多因素的影响,只要控制好作用时间与温度,将PEG的质量分数、相对分子质量等调节到适当的范围,就能获得较高的细胞融合率。当然,对于不同种类细胞,其最适融合条件之间的差别还有待于进一步研究探讨。
[1]Steubing R W, Cheng S, Numajir I Y, et al. Laser Induced Cell Fusion in Combination With Optical Tweezers[J].The Laser Cell Fusion Trap Cytometry,1991, 12: 505~510.
[2]Kao K N , Wetter L R. Advances in techniques of plant protoplasts fusion and culture of heterokaryocytes[A] . International Cell Biology, 1976-1977 [C] . Boson, MA, TheRockefeller University Press,1977 : 216~224.
[3]Huynh N T, Passirani C, Saulnier P,et al. Lipid nanocapsules: a new platform for nanomedicine[J]. Int J Pharm, 2009 Sep 11,379(2):201~209.
[4]Ogawa F, Iinuma H, Iwasaki K, et al. Fusion vaccine therapy by IL-2-gene-transduced dendritic cells and tumor cells[J]. Gan To Kagaku Ryoho,2005,32(11):1580~1582.
[5]Dan K, Miyashita K, Seto Y, et al. The memory effect of heteropolyoxotungstate (PM-19) pretreatment on infection by herpes simplex virus at the penetration stage[J]. Pharmacol Res, 2002,46(4):357~361.
[6]Bhanuprakash V, Hosamani M, Balamurugan V, et al. Production and characterization of Monoclonal antibodies to bluetongue virus[J]. Virol Sin,2011 Feb,26(1):8~18.
[7]Yoo C, Do H A, Jeong I G, et al. Efficacy of dendritic cells matured early with OK-432 (Picibanil), prostaglandin E2, and interferon-alpha as a vaccine for a hormone refractory prostate cancer cell line[J]. J Korean Med Sci,2010 Sep,25(9):1284~1290.
[8]Guo G H, Chen S Z, Yu J, et al. In vivo anti-tumor effect of hybrid vaccine of dendritic cells and esophageal carcinoma cells on esophageal carcinoma cell line 109 in mice with severe combined immune deficiency[J]. World J Gastroenterol,2008,14(8):1167~1174.
[9]Homma S, Matai K, Irie M, et al. Immunotherapy using fusions of autologous dendritic cells and tumor cells showed effective clinical response in a patient with advanced gastric carcinoma[J]. J Gastroenterol,2003,38(10):989~994.
[10]Kao W J, Lee D. In vivo modulation of host response and macrophage behavior by polymer networks grafted with fibronectin-derived biomimetic oligopeptides: the role of RGD and PHSRN domains[J]. Biomaterials,2001 Nov,22(21):2901~2909.
[11]Kao W J, Lee D, Schense J C, et al. Fibronectin modulates macrophage adhesion and FBGC formation: the role of RGD, PHSRN, and PRRARV domains[J]. J Biomed Mater Res,2001 Apr,55(1):79~88.
[12]Archer M, Rodrigues M L, Aurélio M, et al. Crystallization and preliminary x-ray diffraction analysis of beta-cinnamomin, an elicitin secreted by the phytopathogenic fungus Phytophthora cinnamomin[J]. Acta Crystallogr D Biol Crystallogr,2000 Mar,56(Pt 3):363~365.
[13]Pontecorvo G. Production of mammalian somatic cell hybrids by means of polyethylene glycol treatment[J]. Somatic Cell Genet,1975, Oct,1(4):397~400.
[14]Davidson R L, Gerald P S. Improved techniques for the induction of mammalian cell hybridization by polyethylene glycol[J]. Somatic Cell Genet,1976 Mar,2(2):165~176.
[15]Hopwood D A. Genetic studies with bacterial protoplasts[J] .Ann Rev Microbial ,1981,35 : 237~259.
[16]徐承水,党本元.现代细胞生物学技术[M].青岛:青岛海洋大学出版社,1995.
Astudyonconditionoptimizationofcell-fusionwithPEGastheRevulsant
YAN Zhen-jun1,ZHANG Xiao-bing2
(1.College of Life Sciences, Hubei Normal University, Huangshi 435002,China;2.Huangshi No.18 Middle School,Huangshi 435002,China)
The cell-fusion technique is a core basic technology,as the most frequently revulsant,PEG is widely used in many fields such as agriculture、medicine、environmental protection,and so on. To find a more effective and rapid cell-fusion method that can answer for the cell-engineering needs which need the fused cells to keep more physiological activities better, here, ox red cells were taken as the material, which were made to fuse induced by PEG, the author studied the effects of fusion temperature、PEG role time、PEG molecular weight and mass fraction on cell fusion.The results showed that when the fusion temperature、PEG role time、PEG molecular weight and mass fraction was 39℃、15min、2000、45%,respectively, the fusion frequency reached to the peak value at the same time that the poison to cells was much less,and the cell fusion rate reached to 21.26%.
cell engineering;PEG;the optimum use condition
2013—10—23
严镇均(1976— ),男,湖北武汉人,讲师,研究方向为遗传学.
Q813.2
A
1009-2714(2014)01- 0014- 06
10.3969/j.issn.1009-2714.2014.01.004
