晚期慢性肾脏病进展相关因素分析
2014-08-22俞小敏肖洁黄咏璋
俞小敏 肖洁 黄咏璋
慢性肾脏病(CKD)的进展受多种因素影响,并且有非常大的个体差异[1]。虽然既往研究已确立了很多危险因素,但其真正的作用尚未清楚,经典的风险因素(如年龄、性别、糖尿病、代谢综合征、蛋白尿、高血压病等)对一些结果仍无法解释[2]。钙磷代谢紊乱及PTH水平的异常是晚期CKD尤其是透析患者的重要并发症,其与CKD的关系日益引起人们的重视[3]。认识危险因素有助于识别高危患者,及时给予必要的监测和治疗,从而延缓CKD进展至终末期肾病(ESRD)。为此,本研究回顾性观察了62例CKD分期4~5期患者19个月的临床资料,探讨晚期CKD患者肾小球滤过率(eGFR) 下降的危险因素,现报告如下。
对象与方法
一、研究对象
选取2010年至2013年在我院门诊和住院、确诊CKD至少6个月、临床资料完整的62例晚期CKD(CKD 4期、5期)患者,进行纵向回顾性观察研究。
二、 方 法
1.研究方法
收集62例患者19个月的临床资料,患者入组后随访至少6个月,观察患者的血清肌酐、血磷、血钙、血尿酸、全段甲状旁腺素(iPTH)和24 h尿蛋白定量检查结果,记录降血压药使用情况。
2.检测方法
使用本院自动生化分析仪检测血清肌酐、血磷、血钙、血尿酸及尿蛋白水平,用瑞士罗氏电化学发光分析仪测定iPTH水平(参考正常范围15~65 ng/L)。
3.诊断标准
采用适合中国人群的MDRD公式[175×(血清肌酐,mg/dl)-1.234×年龄-0.179×(0.79,女性)]计算eGFR[4]。CKD的分期根据肾脏病预后质量倡议(KDOQI)指南界定:CKD4期:eGFR 15~<30 ml/(min·1.73 m2);CKD 5期:eGFR<15 ml/(min·1.73 m2)。每日蛋白摄入量的评估根据Maroni等[5]方法用24 h尿素氮估计。高血压病标准:平均收缩压/舒张压≥130/80 mm Hg或目前正在使用降血压药。eGFR下降程度的评估以研究单位时间(年)的eGFR (ml/min)表面积(1.73 m2)校正,表示为ml/(min/1.73 m2·年),以至少4次eGFR及相应随访时间作直线回归斜率分析,负斜率越大,即eGFR下降程度越大,CKD进展越快。
4.分组
依据eGFR斜率分为eGFR不稳定(回归直线的斜率为负值)组与eGFR稳定(回归直线的斜率为正值)组,eGFR不稳定组43例,eGFR稳定组19例,对两组进行追踪,分别观察19.2、19.0 个月。
三、 统计学处理
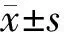
结 果
一、62例CKD患者一般情况、临床特征及基本生化检查结果
62例中,男38例,女24例,年龄(66.6±15.0)岁,中位年龄61岁,BMI(27.5±6.5)kg/m2,随访(19.2±9.6)月。合并高血压病56例,合并糖尿病15例。血红蛋白(120±18)g/L,血白蛋白(35.9±5.6)g/L,血钙(2.2±0.2)mmol/L,血磷(1.4±0.5)mmol/L,iPTH(276±184) ng/L。血清肌酐(292±71)μmol/L,血尿酸(428±81)μmol/L,尿蛋白(0.94±1.21)g/24 h,尿素氮(7.8±1.9) g/24 h。eGFR(23.5±6.1)ml/min。 eGFR平均变化(-1.84±6.64)ml/(min/1.73 m2·年)。
二、eGFR斜率与研究变量的关系
1.双变量相关分析
eGFR斜率与血磷、iPTH、尿蛋白水平和所使用的降压药数量呈负相关,与血钙、尿素氮呈正相关(P均<0.05),与年龄、BMI、血尿酸、血白蛋白和血红蛋白无关(P均>0.05)。血压正常的CKD患者与高血压者比较eGFR下降更少(P<0.05),性别或糖尿病与CKD的进展无关(P均>0.05),见表1。
2.多变量相关分析
血磷、iPTH和尿蛋白水平与eGFR斜率的陡峭程度明显相关(P均<0.05),见表2。
三、eGFR稳定组与不稳定组CKD患者的各参数比较
与eGFR不稳定组相比,eGFR稳定组CKD患者年龄较大,尿蛋白、血磷和iPTH水平较低,血钙水平较高(P均<0.05),见表3。
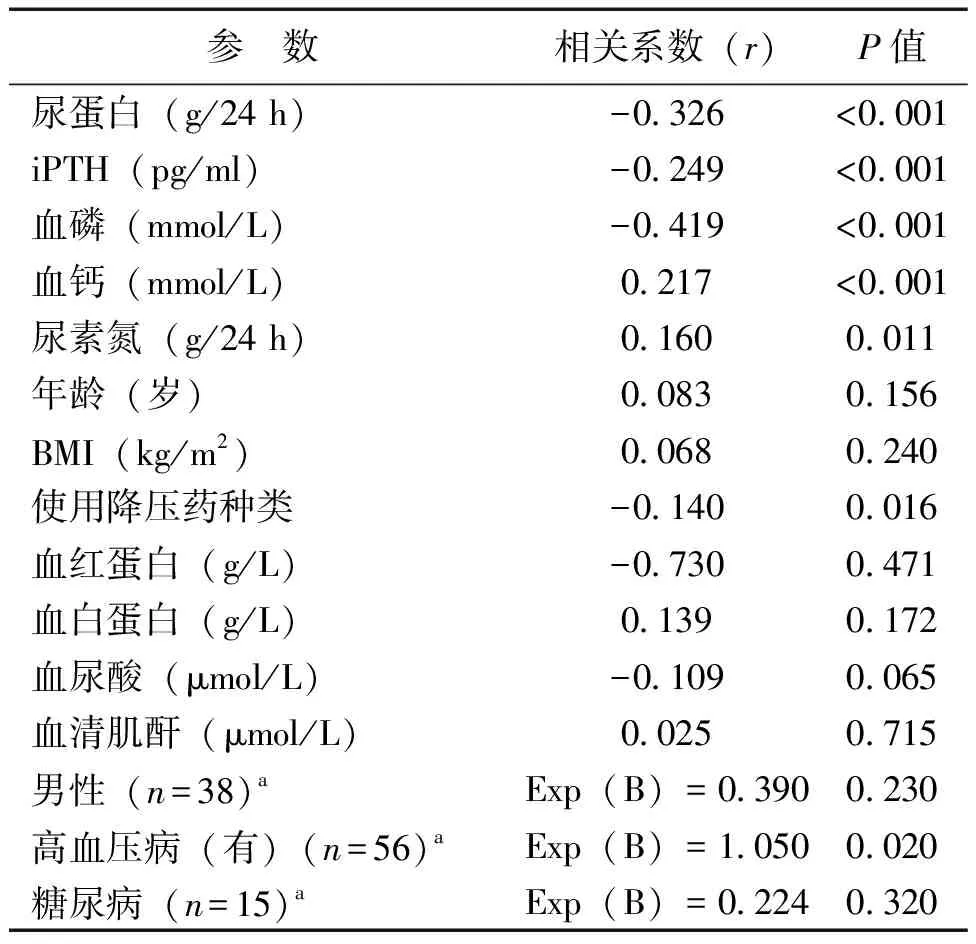
表1 eGFR变化与各参数的双变量相关分析

表2 eGFR下降斜率与各参数的多因素线性回归分析
四、稳定eGFR的相关因素分析
稳定eGFR与血磷、血钙、iPTH及尿蛋白水平有关(P均<0.01),见表4。
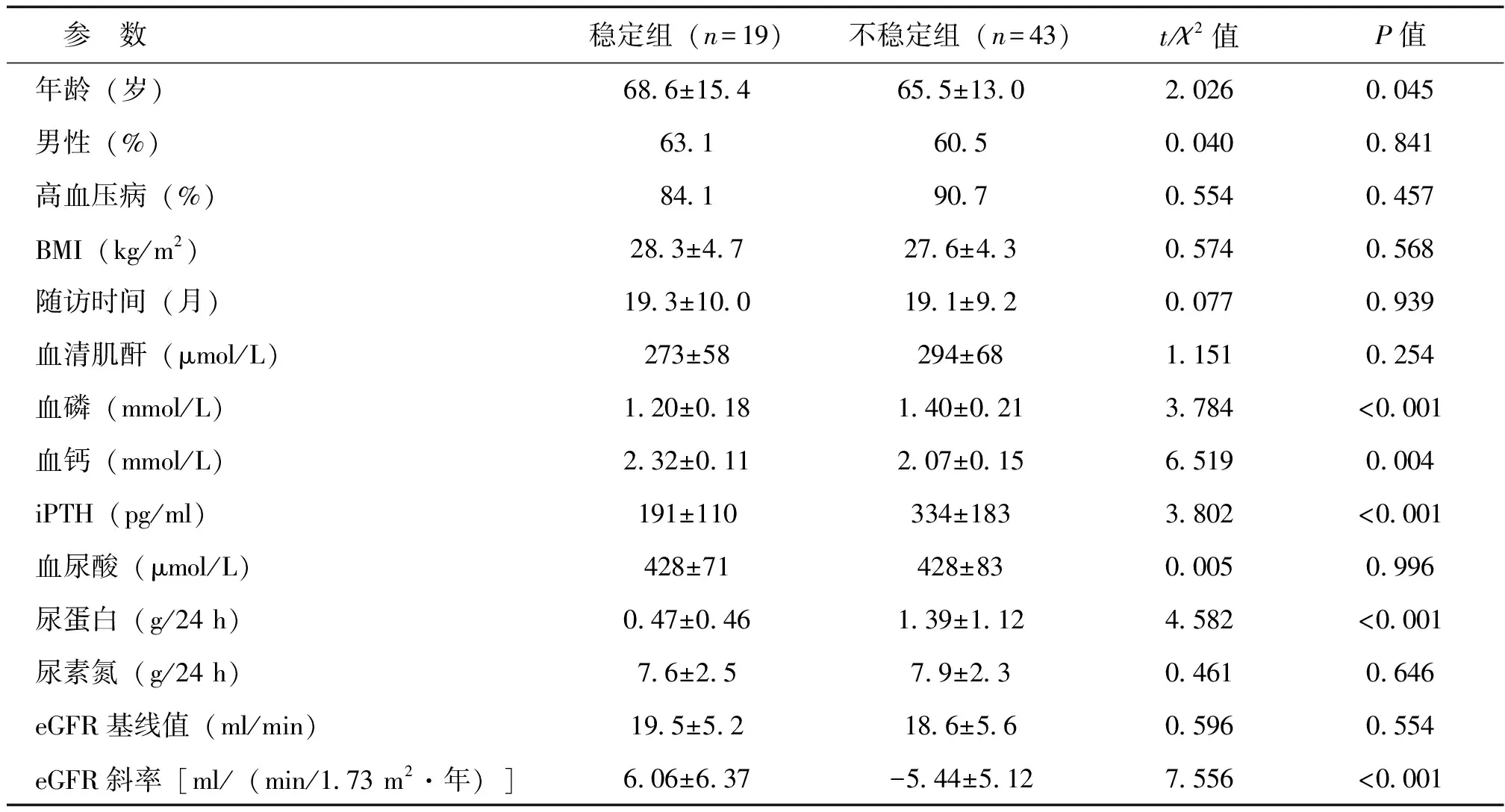
表3 eGFR稳定组与不稳定组CKD患者的各参数比较

表4 稳定eGFR相关因素的Logistic回归分析
讨 论
本研究发现,晚期CKD肾功能下降较快与血磷、iPTH和尿蛋白密切相关;高血压病、使用多种抗高血压药物可加速肾功能损害,但这种关系在多因素分析中未发现具统计学意义;另外,BMI、糖尿病、年龄或性别与肾功能下降无关。
CKD患者的血清肌酐值因饮食、体质量等影响下可能出现差异,因此,基于单次血清肌酐来计算肾功能的下降不能真实反映肾功能的进展,所以本研究在计算肾功能下降斜率前,每例患者至少每3个月接受一次eGFR分析,平均随访19个月。与CKD 1~3期相比,CKD晚期患者经单次血清肌酐值计算的eGFR值变化较小。本研究中,62例患者基线eGFR的平均值为23.5 ml/(min·1.73 m2),虽然肾功能平均下降1.84 ml/(min/1.73 m2·年)似乎较慢,但对该期患者已是明显的变化。CKD患者在密切观察、及时治疗的情况下,30%患者的eGFR可保持在稳定状态下。
骨代谢在肾功能下降过程中的作用仍不清楚,FGF-23、钙磷代谢紊乱可能与CKD发生、发展有关[6]。Schwarz等[7]报道,在CKD 1~5期中,血磷水平高于1.23 mmol/L可加速肾功能的损害。Voormolen等[8]报道,血磷每增加0.32 mmol/L,肾功能则每月下降0.154 ml/min。Lorenzo等[9]在一项纳入333例GFR 低于50 ml/min患者的研究中发现,血磷每增加0.32 mmol/L,ESRD的风险增加2.1倍;Zoccali等[10]报道,基线血磷水平是肾脏疾病进展的独立危险因素。本研究显示,CKD进展与血磷、PTH水平有关,与上述报道一致。最近亦有研究建瓯覅, FGF-23与钙磷代谢紊乱在ESRD发展中起重要作用[11-13]。但对于是否要更密切监测血磷水平和控制PTH以预防肾损害,尚需进一步的干预研究探讨。
众所周知,蛋白尿是CKD进展的危险因子,而且是糖尿病和非糖尿病患者肾脏疾病进展的预测因素[14]。氯沙坦减少非胰岛素依赖型糖尿病终点事件(RENAAL)研究数据的二次分析表明,高基线蛋白尿患者比低基线蛋白尿患者进展至ESRD的风险高5.2倍,发展至CKD风险高8.1倍。另外,有报道糖尿病患者头6个月尿蛋白每减少50%,ESRD风险减少36%、CKD风险减少45%[15]。Lorenzo等[9]发现,糖尿病无蛋白尿与非糖尿病CKD患者在尿蛋白分层后其进展速度是相同的,尿蛋白水平稍增加则伴随着明显加速的CKD进展。本研究结果与上述研究相似。一般建议CKD患者限制饮食中蛋白质的摄入量。然而,有研究发现CKD患者限制蛋白质饮食与否,其GFR平均下降幅度比较差异无统计学意义[16]。本研究中,多因素分析并未发现尿素氮与eGFR下降幅度之间的关系,由此假设,CKD患者最佳的饮食建议应该保证充分蛋白质摄入,可能只有磷含量高的饮食才会导致肾功能的丧失[2,11]。
虽然本研究在总体未发现年龄和eGFR下降幅度之间有关,但是eGFR稳定组患者明显年龄较大,可能是年轻患者病因方面有如多囊肾病和肾炎等加剧因素。El-Ghoul等[17]等研究纳入了一组CKD 4~5期的老年(>80岁)患者,结果发现超过33%没有进展到ESRD,CKD无进展与低蛋白尿、有效控制血压和较少的心血管合并症相关。因此年龄可能是CKD的启动因素,但并非是持续因素。
高血压一直被认为是CKD进展的一个重要因素。RENAAL研究对控制血压在低目标与标准目标患者随访2.2年,结果发现两者CKD的进展速度比较差异无统计学意义[18]。本研究多变量分析亦发现,eGFR下降幅度与高血压及使用降压药数量无关,高血压并非CKD进展的危险因素。既往对于性别、肥胖、贫血和尿酸在CKD进展中的作用,研究结果不一[19-20]。本研究显示,CKD进展与上述因素无关。
鉴于本研究为一个关联性分析,故无法区分因果的确定关系,然而本研究提示,在治疗CKD患者时必须严密监测其血磷、血钙、PTH、尿蛋白水平,并积极干预,以延缓CKD的进展并推迟其进入肾脏替代治疗的时间,改善患者预后。
[1] Lucove J, Vupputuri S, Heiss G, et al. Metabolic syndrome and the development of CKD in American Indians: the Strong Heart Study. Am J Kidney Dis,2008,51:21-28.
[2] Taal MW, Brenner BM. Predicting initiation and progression of chronic kidney disease: developing renal risk scores. Kidney Int,2006,70:1694-1705
[3] Kronenberg F. Emerging risk factors and markers of chronic kidney disease progression. Nat Rev Nephrol,2009,5:677-689.
[4] 全国eGFR 课题协作组.MDRD 方程在我国慢性肾脏病患者中的改良和评估.中华肾脏病杂志,2006,22:589-595.
[5] Maroni BJ, Steinman TI, Mitch WE. A method for estimating nitrogen intake of patients with chronic renal failure. Kidney Int,1985,27:58-65.
[6] Kuro OM. Phosphate and Klotho. Kidney Int Suppl,2011,121:S20-S23.
[7] Schwarz S, Trivedi BK, Kalantar-Zadeh K, et al. Association of disorders in mineral metabolism with progression of chronic kidney disease. Clin J Am Soc Nephrol,2006,1:825-831.
[8] Voormolen N, Noordzij M, Grootendorst DC, et al. High plasma phosphate as a risk factor for decline in renal function and mortality in pre-dialysis patients. Nephrol Dial Transplant, 2007,22:2909-2916.
[9] Lorenzo V. Similar renal decline in diabetic and non-diabetic patients with comparable levels of albuminuria. Nephrol Dial Transplant,2010,25:835-841.
[10] Zoccali C, Ruggenenti P, Perna A, et al. Phosphate may promote CKD progression and attenuate renoprotective effect of ACE inhibition. J Am Soc Nephrol,2011,22:1923-1930.
[11] Fliser D, Kollerits B, Neyer U, et al. Fibroblast growth factor 23 (FGF23) predicts progression of chronic kidney disease: the Mild to Moderate Kidney Disease (MMKD) Study. J Am Soc Nephrol,2007,18:2600-2608.
[12] Kendrick J, Cheung AK, Kaufman J, et al. FGF-23 associates with death, cardiovascular events, and initiation of chronic dialysis. J Am Soc Nephrol,2011,22:1913-1922.
[13] Haruna Y, Kashihara N, Satoh M, et al. Amelioration of progressive renal injury by genetic manipulation of Klotho gene. Proc Natl Acad Sci U S A,2007,104:2331-2336.
[14] Remuzzi G, Ruggenenti P, Perico N. Chronic renal diseases: renal protective benefits of rennin- angiotensin system inhibition. Ann Intern Med,2002,136: 604-615.
[15] de Zeeuw D, Remuzzi G, Parking HH, et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int,2004,65:2309-2320.
[16] Klahr S, Levey AS, Beck GJ, et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease: modification of Diet in Renal Disease Study Group. N Engl J Med,1994,330:877-884.
[17] El-Ghoul B, Elie C, Sqalli T, et al. Nonprogressive kidney dysfunction and outcomes in older adults with chronic kidney disease. J Am Geriatr Soc,2009,57:2217-2223.
[18] Taal MW, Brenner BM. Renal risk scores: progress and prospects. Kidney Int,2008,73:1216-1219.
[19] Xu R, Zhang LX, Zhang PH, et al. Gender differences in age-related decline in glomerular filtration rates in healthy people and chronic kidney disease patients. BMC Nephrol, 2010,11:20.
[20] Keane WF, Zhang Z, Lyle PA, et al. Risk scores for predicting outcomes in patients with type 2 diabetes and nephropathy: The RENAAL Study. Clin J Am Soc Nephrol,2006,1:761-767.
