无锡女性MTHFR和MTRR基因多态性研究
2014-08-22田宇胡玉芝鲁衍强马少杰杨琦
田宇 胡玉芝 鲁衍强 马少杰 杨琦
叶酸为水溶性B族维生素,在体内主要参与一碳单位的转运,是核酸合成的必要元素,也是细胞生长和组织修复必需物质。5,10-亚甲基四氢叶酸还原酶(MTHFR)和甲硫氨酸合成酶还原酶(MTRR)是叶酸转运和代谢的关键酶。MTHFR基因C677T位点、A1298C位点与MTRR基因A66G位点的多态性会影响MTHFR与MTRR的酶活性降低,造成叶酸代谢异常,阻碍同型半胱氨酸转化成甲硫氨酸,引起高同型半胱氨酸血症,临床上会增加孕妇生产神经管畸形胎儿、唇腭裂胎儿、唐氏综合征胎儿与先天性心脏病胎儿的风险[1-5]。为此,本研究对无锡市育龄妇女叶酸代谢基因MTHFR和MTRR相关位点多态性分布进行分析,了解无锡地区妇女叶酸代谢相关基因的分布特点与群体遗传学特征,为本地区预防出生缺陷制定针对性的干预措施提供科学依据。
对象与方法
一、研究对象
选取无锡市2009年3月至2012年6月在无锡虹桥医院进行孕前与孕期检查的无亲缘关系女性,根据知情同意原则,经受检者本人同意后,采集其口腔黏膜细胞进行后续研究。对所有口腔黏膜细胞进行基因组DNA抽提,排除抽提不符合要求者,共获得有效样本524例,其中,汉族521例,少数民族3例。样本提供者年龄(27.0±4.8)岁。
二、方 法
采集受检者的口腔黏膜上皮细胞,利用硅胶吸附方法抽提样本的基因组DNA。采用荧光定量PCR技术,分别检测分析叶酸代谢相关的3个DNA单核苷酸多态性位点(MTHFR C677T、A1298C和MTRR A66G)。每个反应体系总体积10 μl,包含20 ng/μl的模板DNA 1 μl, Taqman通用混合物5 μl, Taqman-MGB探针0.5 μl,去离子水3.5 μl。其中,MTHFR C667T、A1298C与MTHRR A66G具体探针信息见表1,相关仪器、试剂均购自美国ABI公司。反应条件为95℃预热10 min,其后,扩增20个循环,每个循环92℃变性15 s,60℃延伸1 min,再改变条件扩增30个循环,每个循环89℃变性15 s, 60℃延伸90 s。反应完成后,在ABI7900 型荧光定量 PCR仪上读取样品孔中的终点荧光,利用分析软件确定各个样本的基因分型结果。

表1 Taqman-MGB探针所在位置
三、统计学处理
对研究人群进行Hardy-Weinberg遗传平衡检验后,采用SPSS 18.0软件对所有数据进行统计分析,并将无锡地区3个基因多态性位点的分布频率分别与山东省[6]、河南省[6]、广东省[7]、海南省[6]等地区的多态性分布频率相比较,两地区间的基因多态性频率分布的差异比较采用行×列χ2检验。以P<0.05为差异有统计学意义。
结 果
一、MTHFR C677T、A1298C和MTRR A66G基因分型
基因组样本经荧光定量PCR反应后,所得结果利用分析软件分析确定各样本基因型,结果见图1,从左往右依次是MTHFR C677T、MTHFR A1298C、MTRR A66G。

图1 基因分型图
二、Hardy-Weinberg平衡分析
无锡女性MTHFR C677T、A1298C和MTRR A66G位点Hardy-Weinberg遗传平衡检验结果均为优良(C677T:χ2=0.525,P>0.05;A1298T:χ2=1.8,P>0.05;A66G:χ2=0.341,P>0.05),样本具有区域群体代表性。
三、无锡女性MTHFR C677T、A1298C和MTRR A66G位点基因多态性分布频率域特点
1.MTHFRC677T
无锡女性MTHFR基因 C677T位点TT基因型的分布频率为18.9%,低于CC基因型(35.3%)和杂合子CT基因型(45.8%),纯合子基因型的分布情况与山东省、河南省该基因位点多态性的分布情况相反;与广东省、海南省的基因多态性分布类似,其TT基因型的出现频率高于广东省(7.4%)和海南省(9.4%),比较差异均有统计学意义(P均<0.05)。MTHFR C677T等位基因的构成与上述4个地区比较差异均有统计学意义(P均<0.01),见表1。
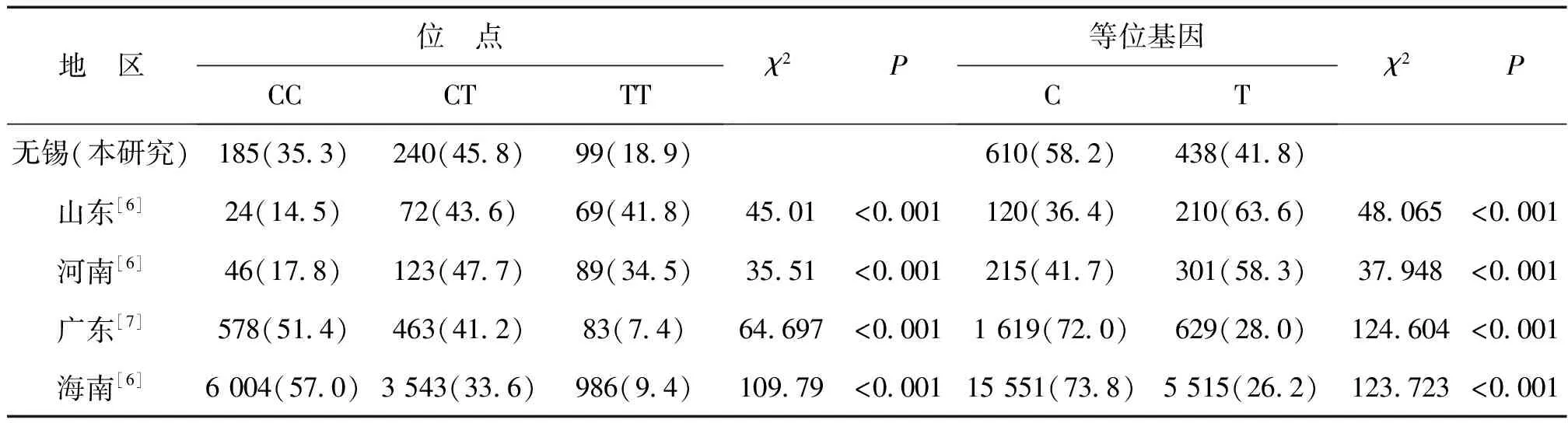
表2 无锡地区与其他地区女性MTHFR C677T位点基因型频数和频率分布比较 例(%)
2.MTHFRA1298C
MTHFR基因A1298C位点的基因型构成与广东省和海南省的基因型构成比较差异有统计学意义(P<0.01)。A1298C位点无锡女性的CC基因型出现频率为3.4%,低于广东省(5.3%)和海南省(6.9%)。无锡女性中,A1298C位点A等位基因的出现频率(82.7%)远高于C等位基因(17.3%)。等位基因构成与山东省、河南省的数据比较差异均无统计学意义(P>0.05),与广东省和海南省的等位基因构成比较差异有统计学意义(P<0.01),见表3。
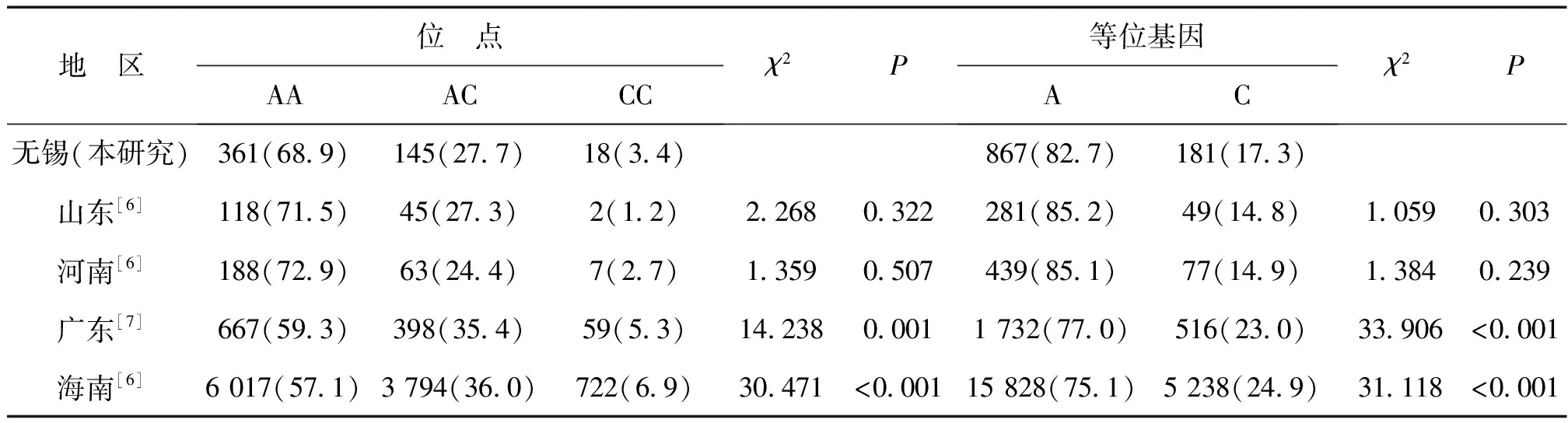
表3 无锡地区与其他地区女性MTHFR A1298C位点基因型频数和频率分布比较 例(%)
3.MTRRA66G
MTRR基因A66G位点G等位基因的出现频率为24.9%,低于A等位基因(75.1%);其中纯合子GG基因型的出现频率为6.7%,低于海南省(9.1%)。A66G位点基因型的构成与海南省比较差异有统计学意义(P<0.01),与其他3个地区数据比较差异均无统计学意义(P>0.05)。等位基因构成与山东省、河南省的数据比较差异均无统计学意义(P>0.05),与广东省和海南省的等位基因构成比较差异有统计学意义(P<0.01),见表4。
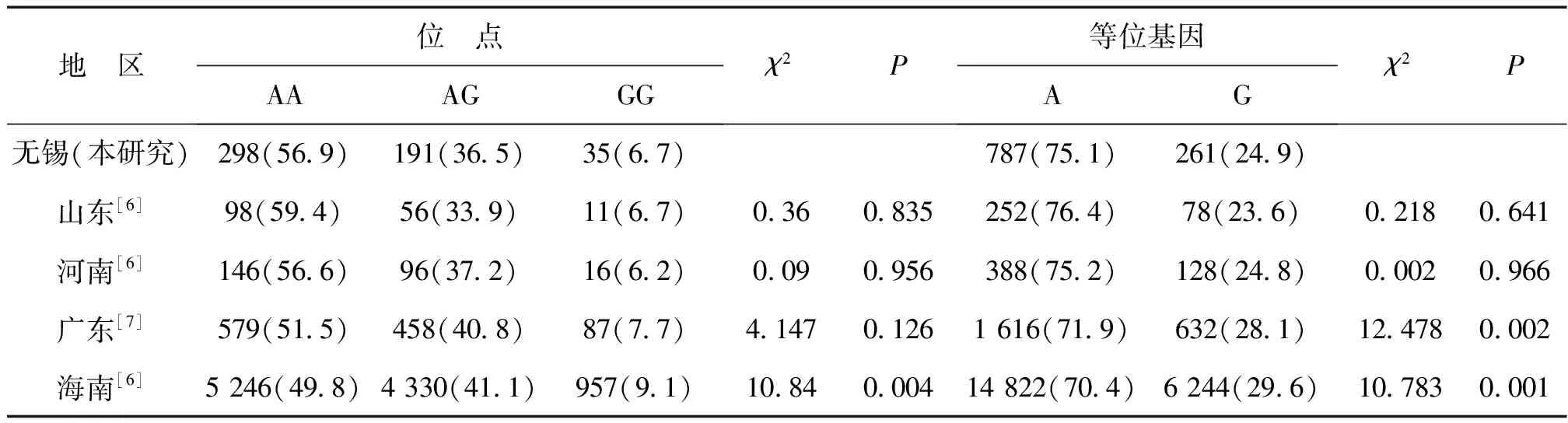
表4 无锡地区与其他地区女性MTRR A66G位点基因型频数和频率分布比较 例(%)
讨 论
近年来,我国出生病死率有所下降,但出生缺陷率却逐年增高。目前认为,MTHFR与MTRR这两个叶酸代谢过程中的关键酶,其酶活性水平与人体内叶酸浓度、血浆同型半胱氨酸浓度均密切相关。如果MTHFR与MTRR酶的活性降低或浓度降低,则人体内的同型半胱氨酸水平增高,可引起神经管缺陷、唇腭裂、唐氏综合征、先天性心脏病等各种出生缺陷。其中神经管缺陷是发生率最高的一类多基因遗传疾病[8]。MTHFR C677T位点的TT基因型是神经管畸形发生的遗传高风险因素,TT基因型个体的MTHFR活性会比正常个体下降60%~70%,增加出生缺陷的风险[9-10]。MTHFR A1298C的CC基因型与MTRR A66G的GG基因型[13-14]也是出生缺陷的遗传风险因素[11-14]。此外,出生缺陷的病因学研究还表明,出生缺陷的发生除了与遗传因素相关,也受环境因素(营养因素)影响,它是遗传因素与环境因素共同作用的结果。即对由于MTHFR和MTRR风险基因造成其自身叶酸代谢障碍的女性人群,如果和正常人群一样补充同剂量的叶酸,则其体内的血清和红细胞叶酸浓度就会低于正常人群,分娩出生缺陷婴儿的风险就会增高;但如果对这类女性增加叶酸的补服剂量,就可以维持她们体内正常的血清叶酸水平,降低出生缺陷的发生[15]。
本研究首次收集无锡地区500多名妇女的遗传样本,对MTHFR和MTRR基因相关位点进行遗传检测。结果显示,无锡市妇女叶酸代谢相关基因多态性具有地区差异。其MTHFR基因C677T位点的TT型风险基因的分布频率为18.9%,高于广东省、海南省的TT基因型的分布频率(10%左右),而无锡市2011年围生儿出生缺陷监测结果显示,无锡市2011年出生缺陷率为4.98‰ ,远低于同期广东省和海南省9.89‰的出生缺陷率[16-19]。无锡市妇女MTHFR A1298C与MTRR A66G基因多态性的分布情况与山东省、河南省相似,无锡市的出生缺陷率也低于山东省12.46‰与河南省(2007年)9.17‰的出生缺陷率[20-21]。这与无锡市积极推广妇女孕前及孕后叶酸普服项目和拥有相对较高的产前筛查和诊断水平密切相关。因此,积极开展的出生缺陷高危因素的筛查,并提前实施相对应的有效干预措施(如补服叶酸),可降低出生缺陷的发生率。
[1] 见明智, 王金桃, 孙海魁. 叶酸对神经管畸形干预效果的Meta分析. 卫生研究,2009,38:682-684.
[2] 王丽静. 妊娠早期增补叶酸预防神经管畸形发生效果的研究. 中国妇幼保健,2006,19:2661.
[3] 唐银科, 张业龙, 简玉洛, 等. 5,10-亚甲基四氢叶酸还原酶基因多态性及补充叶酸与非综合征性唇腭裂的相关性. 中国组织工程研究与临床康复,2011,15:2829-2832.
[4] 宋萃. 叶酸代谢及吸收关键酶基因多态性与唐氏综合征相关性可能机制研究进展综述. 科学咨询:决策管理, 2010,1:98-99.
[5] 裴丽君, 任爱国, 郝玲, 等. 还原叶酸载体基因多态性与先天性心脏病和唇腭裂关联的研究. 中华流行病学杂志,2004,25:61-65.
[6] 贺宪民, 张群, 杨琦, 等. 亚甲基四氢叶酸还原酶和甲硫氨酸合成酶还原酶基因多态性研究. 中国计划生育学杂志,2010,172:13-18.
[7] 尹爱华,鲁衍强,芮欣忆,等. 广东省女性MTHFR和MTRR基因多态性分布研究. 中国公共卫生,2012,28: S3.
[8] 朱军,王和. 增补小剂量叶酸预防神经管缺陷. 成都:时代出版社. 2008:4.
[9] Ou CY, Stevenson RE, Brown VK, et al. 5,10 Methylenetetrahydrofolate reductase genetic polymorphism as a risk factor for neural tube defects. Am J Medical Genet,1996,63:610-614.
[10] 孙延芝, 郑冬梅, 林新梅, 等. 同型半胱氨酸代谢与神经管畸形的关系. 黑龙江医学,1999,180:13-14.
[11] Meguid NA, Dardir AA, Khass M, et al. MTHFR genetic polymorphism as a risk factor in Egyptian mothers with Down syndrome children. Dis markers, 2008, 24:19-26.
[12] 郑梅玲, 毕星宇. 神经管畸形与MTHFRC677T、MTHFRA1298C、MSA2756G基因多态性的相关性研究. 中国优生与遗传杂志,2005,13:26-28.
[13] O'Leary VB, Parle-McDermott A, Molloy AM, et al. MTRR and MTHFR polymorphism: link to Down syndrome? Am J Med Genet, 2002,107:151-155.
[14] Zhu H, Wicker NJ, Shaw GM, et al. Homocysteine remethylation enzyme polymorphisms and increased risks for neural tube defects. Mol Genet Metab, 2003,78:216-221.
[15] Nishio K, Goto Y, Kondo T, et al. Serum folate and methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism adjusted for folate intake. J Epidemiol, 2008,18:125-131.
[16] 眭茜, 韦玮. 无锡市61425例围产儿出生缺陷监测结果分析. 实用预防医学, 2012, 19:718-719.
[17] 梁海丽,陈源鸿,王丽平,等. 围生儿出生缺陷的监测与分析. 热带医学杂志,2012,12:50-53.
[18] 刘泽林. 海南多个“防火墙”堵截出生缺陷. 健康报,2012-03-21.
[19] 周凤荣,张蓬,范媛媛. 山东省2007-2010年人群出生缺陷监测结果分析. 中国预防医学杂志,2011,12:4.
[20] 孙利环, 胡孟彩, 吴惠琰. 河南地区1996~2007年出生缺陷监测结果分析. 中国优生与遗传杂志,2010,:93-94.
