Eu(Ⅲ)在红壤及其实性成分上的吸附动力学及热力学
2014-08-15于涛夏天殷志成尚小琦
于涛,夏天,殷志成,尚小琦
(东华理工大学 核工程与地球物理学院,江西 南昌 330013)
在对放射性废物的处理与处置相关研究中,土壤及其实性成分的吸附作用和放射性核素的迁移行为越来越被研究人员所关注[1-2].Eu(Ⅲ)是镧系稀土元素,因其离子物化性质与Am(Ⅲ)接近,常常被用来模拟三价锕系元素,因此Eu(Ⅲ)在土壤、黏土矿物上的吸附行为特性也被广泛研究[3,4].
红壤广泛分布于中国南方,而影响其吸附性能的自身因素主要有金属氧化物和有机质.Dong等[5]研究了Eu(Ⅲ)在红壤的吸附特性,发现吸附作用随着pH值和腐殖酸的变化而变化,红壤中的氧化铁对吸附有抑制作用,腐殖质和高pH值有助于固定红壤上吸附的Eu(Ⅲ).Tao等[6]研究了Am(Ⅲ)在3种红壤上的吸附,结果显示,pH、离子浓度和腐殖酸对Am(Ⅲ)吸附作用有很大的影响,对于天然红壤样本,有机物有积极作用,而金属氧化物对Am(Ⅲ)的吸附有抑制作用.对于吸附反应的研究十分广泛,除针对不同吸附质的研究,人们将更多的注意力集中在对吸附剂的研究上,如选择高效吸附剂用于重金属污染等[7].
本文将采集和制备3种红壤样品,并对其进行表征,同时还将研究接触时间、pH值、离子强度和腐殖酸(HA)等对Eu(Ⅲ)在3种红壤上吸附的影响,研究吸附动力学和热力学,并讨论Eu(Ⅲ)在红壤上的吸附机理.
1 实验部分
1.1 主要仪器与试剂
X线衍射仪(D/max-400),日本日立公司;扫描电子显微镜(X-650),日本日立公司;水浴恒温振荡器(SHA-C型),江苏金坛市金城国胜实验仪器厂;离心机(80-2型),上海手术器械厂;酸度计(pH-3B),上海雷磁创益仪器仪表有限公司;可见分光光度计(721E型),上海光谱仪器有限公司;氧化铕,赣州市德施普新材料有限公司;红壤,采集自江西省抚州市郊;偶氮胂Ⅲ,成都格雷西亚化学技术有限公司;腐殖酸,成都格雷西亚化学技术有限公司.
Eu(Ⅲ)标准溶液:称取0.193 6 g Eu2O3,用少量浓盐酸溶解后,加热蒸干,除去盐酸,再用一定量0.1 mol/L HNO3溶解后,以蒸馏水定容至250 mL容量瓶,其浓度为4.4×10-3mol/L.
腐殖酸溶液:称取0.2 g 腐殖酸(HA),以碱液溶解后,调节pH为7~8,定容于1 000 mL 容量瓶中,即可得质量浓度为200 mg/L的腐殖酸溶液.
1.2 红壤样品的制备
1.2.1 天然红壤(NRE)
天然红壤的样品采自江西省抚州市,取样位置为地表(0~10 cm),去除土壤杂质,烘干后研磨至0.01 mm颗粒,备用.
1.2.2 去氧化铁成分红壤(IORRE)
称取天然红壤样品,加入0.3 mol/L 柠檬酸钠(Na3C6H5O7,1 mol/L NaHCO3缓冲)溶液500 mL,在85 ℃水浴条件下,加入5 g Na2S2O4,并不断搅拌.当土样颜色变为灰色后,加入50 mL 饱和NaCl溶液使土壤颗粒凝聚,离心分离30 min后用蒸馏水洗涤3 次,烘干备用.
1.2.3 去有机质红壤(OMRRE)
称取天然红壤样品,加入200 mL H2O2,置于90 ℃水浴中处理45 min,离心分离30 min后,用蒸馏水洗涤3次,烘干备用.
以原子吸收光谱法等分析方法对3种红壤样品的主要组成成分进行分析,结果见表1.

表1 红壤样品的部分性质
由表1可见,天然红壤呈弱酸性,其有机质质量分数为1.12%,氧化铁成分质量分数8.47%.经过1.2.2和1.2.3处理,去氧化铁成分红壤的氧化铁成分质量分数降至1.52%,而去有机质红壤中的有机质含量降至0.29%.由分析结果可见,去氧化铁成分、去有机质的操作成功,达到了预期效果.
1.3 实验流程
Eu(Ⅲ)在红壤(天然红壤、去氧化铁成分红壤、去有机质红壤)上的吸附分别在30,45,60 ℃下进行.一定量的红壤悬浮液、电解质溶液(NaCl溶液)、腐殖质溶液(HA溶液)、Eu(Ⅲ)溶液、0.5%抗坏血酸溶液依次加入聚乙烯试管中,加入适量去离子水达到实验所需试剂浓度.以微量HCl,NaOH溶液调节混合液pH值至所需值.将混合液在一定温度下于振荡器上振荡至吸附-解吸平衡后,以离心机在3 000 r/min转速下离心30 min.取一定体积的上清液,用分光光度法测定上清液中Eu(Ⅲ)的浓度,以吸附平衡前后体系中核素浓度的差别来计算核素的吸附量.
吸附率(%)和分配系数(Kd)分别由下式计算:
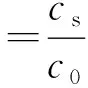
(1)
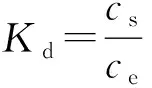
(2)
其中,c0为Eu (Ⅲ)在液相中的初始浓度(mol/L),cs为平衡后固相中Eu(Ⅲ)的浓度(mol/g),ce为平衡后液相中Eu(Ⅲ)的浓度 (mol/L).
2 结果与讨论
2.1 红壤的表征

图1 天然红壤吸附Eu(Ⅲ)前(a)后(b)的扫描电子显微镜图像Fig.1 SEM micrographs of NRE(a) and Eu-NRE(b)
图1为天然红壤吸附Eu(Ⅲ)前后的扫描电子显微镜(SEM)图像.由图1可见,吸附前(图1a),天然红壤表面以层片状结构为主,存在大量的孔隙结构,增加了比表面积,其层片状结构直径在0.1~2 μm.吸附Eu(Ⅲ)后(图1b),红壤表面层片状结构相较吸附前不明显,孔隙结构也有所减少,说明吸附点位在减少,其层片状结构的直径也在0.1~2 μm.对比吸附前后的图像,可以看到吸附前的孔隙机构更发达,更有利于吸附反应的进行.
图2为天然红壤、去氧化铁成分红壤和去有机质红壤XRD分析图.由图2可见,3种红壤样品的矿物组成基本一致,主要成分均为高岭土和石英,同时也含有一定量的三水铝石、蒙脱石、钛铁矿等.这表明采用化学方法对红壤进行的去氧化铁、去有机质处理没有影响红壤的基本矿物组成.
2.2 吸附剂浓度对吸附的影响
图3 是以吸附剂浓度为条件的Eu(Ⅲ)在天然红壤、去氧化铁成分红壤、去有机质红壤上的吸附情况.由图可知,随着固液比的增加,更多的吸附位点参与吸附作用过程,Eu(Ⅲ)的吸附量也相应增加,但增幅逐渐减小.天然红壤与去有机质红壤受固液比影响的情况相似,而在相同固液比下,去氧化铁成分红壤的吸附百分数最大,说明氧化铁在吸附过程中起抑制吸附的作用.原因是占据吸附位点的氧化铁成分减少,导致吸附位点增加,红壤的吸附百分数相应增大.

图2 天然红壤a、去氧化铁成分红壤b、去有机质红壤c的X射线衍射分析Fig.2 XRD patterns of NRE、IORRE、OMRRE

T=(298.15±1)K, pH=6.50±0.05,c(Eu(Ⅲ)initial)=4.40×10-4mol/L图3 吸附剂浓度对Eu(Ⅲ)在天然红壤、去氧化铁成分红壤以及去有机红壤上的吸附影响Fig.3 Sorption of Eu(Ⅲ) on NRE,IORRE and OMRRE as a function of solid content
由lnKd的走势可见,NRE系统中,Kd与吸附百分数走势呈现相反的趋势,即随着吸附剂质量浓度的增加,吸附质在固相上的分布比例减小;而IORRE和OMRRE系统中,Kd与吸附百分数走势呈现相同的趋势,即随着吸附剂质量浓度的增加,吸附质在固相上的分布比例增加.综上说明NRE系统中存在阻碍吸附的因素(氧化铁)存在,而这一影响因素在IORRE系统中得到一定程度的消除,却并未在OMRRE中得到消除.
2.3 接触时间对吸附的影响
接触时间对3种红壤吸附Eu(Ⅲ)的影响见图4.由图4a可见,Eu(Ⅲ)在NRE和OMRRE上的吸附约12 h可达到吸附平衡,12 h之后,吸附百分数基本保持不变;在IORRE上的吸附较快,约4 h即可达到吸附平衡,4 h之后,吸附百分数基本保持不变.
与NRE吸附Eu(Ⅲ)的情况相比,在相同接触时间条件下,Eu(Ⅲ) 在IORRE上的吸附百分比普遍更高,并且震荡幅度较小,而OMRRE对Eu(Ⅲ)的吸附百分比略有升高,但比较接近.结果说明,在IORRE上吸附受干扰较天然红壤为小,从侧面证明土壤中的氧化铁成分是干扰吸附的主要因素;OMRRE吸附受到的干扰与天然红壤较为接近,证明土壤中的有机质并不是干扰吸附的主要因素.
以准二级动力学方程对Eu(Ⅲ)在3种红壤上吸附动力学方程进行模拟[8]:
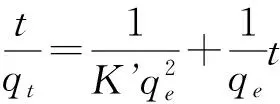
(3)
此处,K’(g/mg/h)是吸附反应的速率常数,qt(mg/g)是在时间t(h)时,Eu(Ⅲ)的吸附量,qe(mg/g)是平衡吸附量.
以t/qt对t作图,通过对直线斜率和截距的计算,求得K’及qe,见图4b.
NRE:K’=1.169 g/(mg·h),qe=5.079 mg/g,R2=0.999 0,
OMRRE:K’=1.814 g/(mg·h),qe=5.142 mg/g,R2=0.999 4,
IORRE:K’=6.882 g/(mg·h),qe=5.312 mg/g,R2=0.999 8.
与NRE相比,IORRE吸附Eu(Ⅲ)的速率常数大得多,大约为前者6倍,而平衡吸附量qe也较前者有所增加;而OMRRE吸附Eu(Ⅲ)的速率常数、平衡吸附量与NRE相差不多.结果说明,3种红壤中反应速率常数、吸附量最大的均为IORRE.
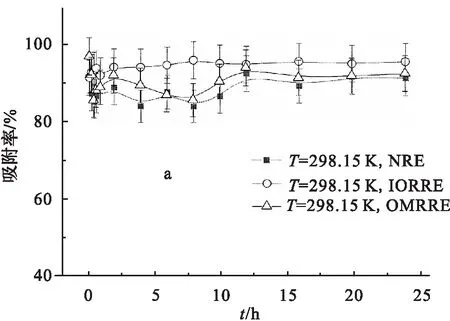
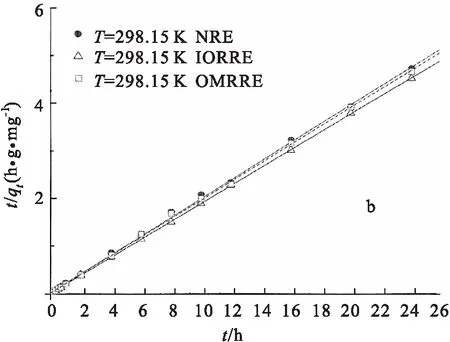
pH=6.50 ±0.05, ρ(吸附剂)=1.0 g/L.
2.4 pH及离子强度对吸附的影响
pH及离子强度对Eu(Ⅲ)在3种红壤上吸附的影响见图5.由图5可以看出,在NRE系统中,Eu(Ⅲ)的吸附开始于低pH值,在pH3.0~7.0内吸附百分数快速从10%增长到90%.当pH>7.0时,随着pH的增长,Eu(Ⅲ)的吸附百分数保持相对稳定.这表明Eu(Ⅲ)对天然红壤的吸附作用与pH密切相关.不同离子强度对吸附有较大影响.
在IORRE系统和OMRRE系统中,在pH≈7时,不同离子强度溶液中,Eu(Ⅲ)的吸附曲线都会出现拐点,即在pH<7时,吸附百分数随pH升高而不断增大,在pH>7时,吸附百分数维持在较高水平并基本保持不变.与NRE的实验结果相比,pH对IORRE和IMRRE影响是一致的.
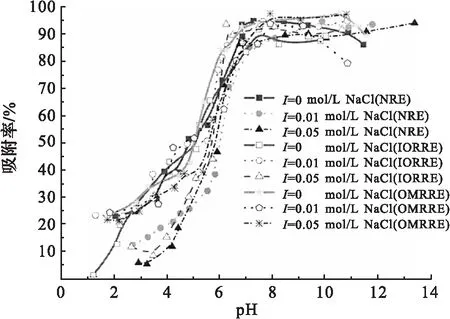
T=(298.15±1)K, ρ(吸附剂)=1.0 g/L. c(Eu(Ⅲ)initial)=4.40×10-4mol/L.图5 pH及离子强度对Eu(Ⅲ)在红壤上吸附的影响Fig.5 Sorption of Eu(Ⅲ) on red earth as a function of pH and ionic strength
不同离子对Eu(Ⅲ)在天然红壤、去氧化铁成分红壤和去有机质红壤系统上的吸附影响见图6.
由图6可见,不同阴阳离子对Eu(Ⅲ)在3种红壤上的吸附影响十分相似.K+对吸附的影响较Na+大,说明阳离子极性越强,对离子交换的影响越大.同时,阴离子实验的结果表明,一价阴离子对吸附的影响基本相同.
2.5 腐殖酸(HA)对吸附的影响
图7为不同浓度的腐殖酸(HA)对3种红壤吸附Eu(Ⅲ)的影响,由图7可以看出,不同浓度的HA存在的情况下,吸附反应在pH<7时较无HA存在时增强,在pH>7后较为接近.在pH<7时,HA的存在使红壤的吸附能力增强,是因为红壤表面吸附腐殖酸,表面正电荷减少,使Eu(Ⅲ)的吸附有了更有利的静电环境,也强化了Eu-HA-天然红壤的三元络合物的形成.
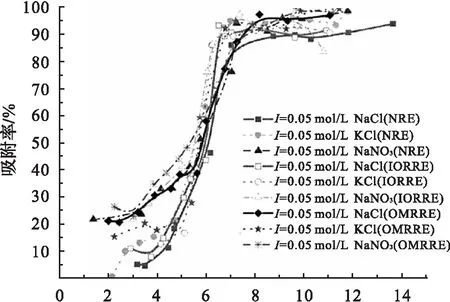
c(Eu(Ⅲ)initial)=4.40×10-4mol/L, T=(298.15±1)K, ρ(吸附剂)=1.0 g/L.图6 不同离子对Eu(Ⅲ)在红壤上吸附的影响Fig.6 Effect of different ions on the sorption of Eu(Ⅲ) on NRE, IORRE and OMRRE
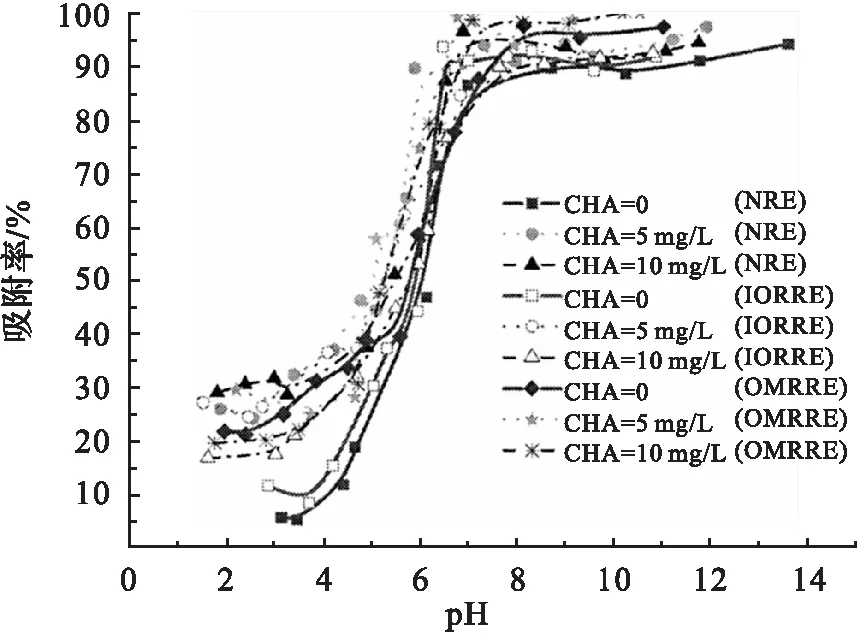
T=(298.15±1)K, ρ(吸附剂)=1.0 g/L,I=0.05 mol/L NaCl.图7 腐殖酸对吸附的影响Fig.7 Effect of HA on the sorption of Eu(Ⅲ) to red earth as a function of pH values
2.6 吸附等温线
采用Freundlich模型对吸附过程进行描述,并绘制Eu(Ⅲ)在3种红壤上303.15, 318.15, 333.15 K的吸附等温线,见图8.
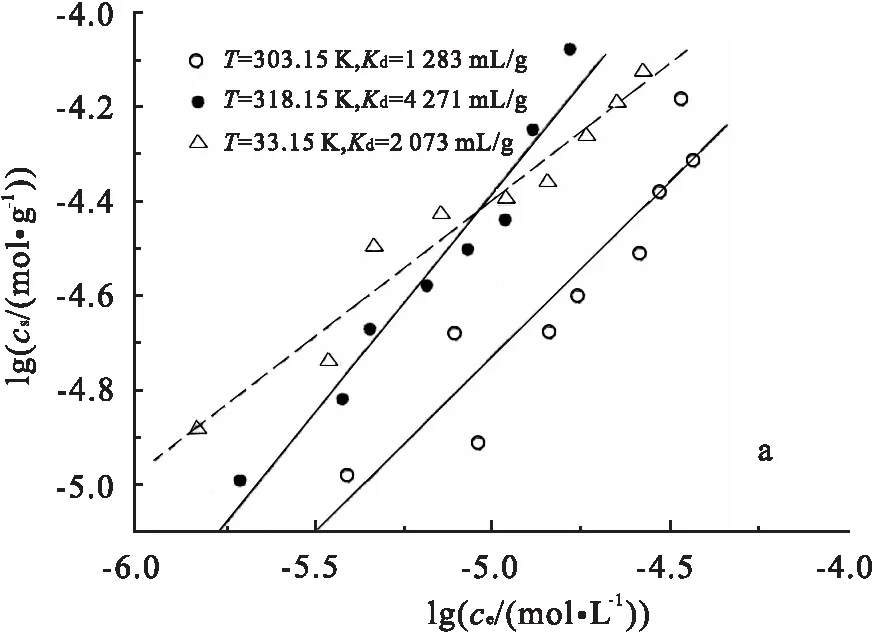

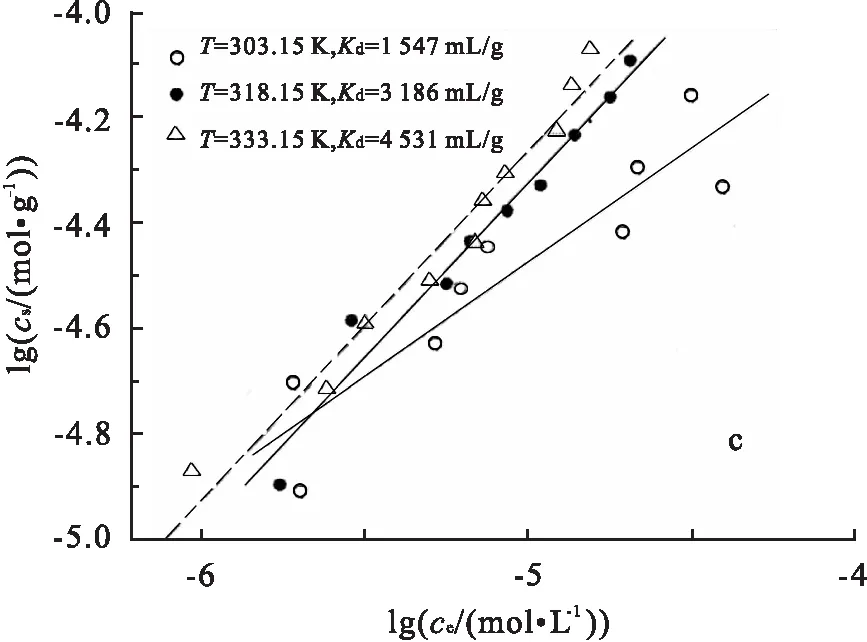
pH=6.50±0.05, ρ(吸附剂)=1.0g/L,I=0.05 mol/L NaCl.
由Frundlich吸附模型[9]
lgcs=lga+nlgce,
(4)
其中,cs为Eu(Ⅲ)在固相上的浓度(mol/g),ce为Eu(Ⅲ)在液相中的浓度(mol/L),a(mol1-ng-1Ln)为吸附质离子的平衡浓度为1时的吸附容量,n表示吸附对于平衡浓度的依赖程度.通过cs对ce作直线,其斜率即为Kd值.计算得到3条吸附等温线下的Kd值,见图8.由Kd值可见,在303.15~333.15 K区间,Kd值总体上随温度升高而增大,说明Eu(Ⅲ) 更多的由溶液向吸附剂迁移,证明了高温有利于吸附反应进行.而在318.15~333.15 K,NRE和IORRE体系Kd则是由大变小,说明这2个体系在高温区间下,升温反而不利于吸附进行.这是因为NRE和IORRE体系中存在一定量的有机质,而有机质在高温分解,降低了对吸附的促进作用;并且形成的三元络合物(如Eu-HA-NRE)分解,有机质与吸附质的复合物(如Eu-HA)进入溶液,从而降低了Eu(Ⅲ)的吸附.因为去有机质红壤中的有机质含量大大降低,因此这一现象在OMRRE体系中得到消除.
由表2可见,3种红壤的Freundlich吸附等温线的线性相关系数总体接近于1,表明Freundlich吸附模型能较好的描述Eu(Ⅲ)在红壤上的吸附行为.
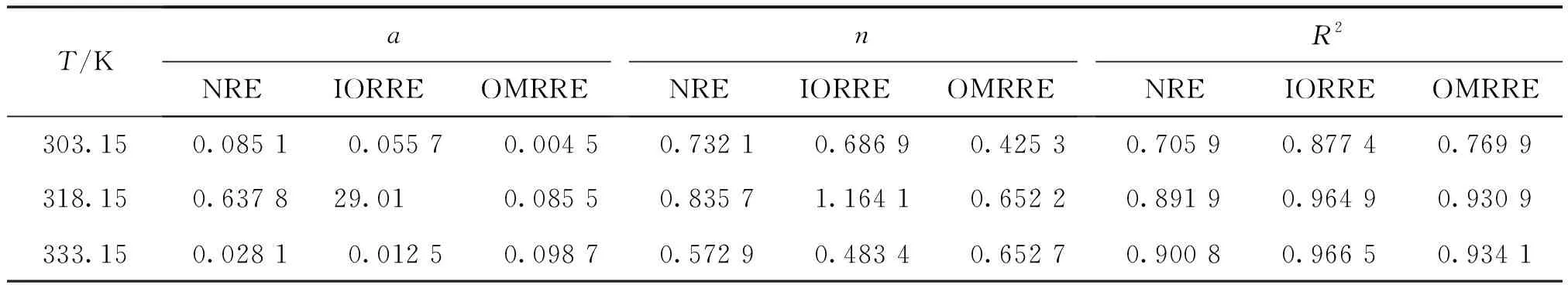
表2 Freundlich吸附等温线参数
通过实验,Eu(Ⅲ)在红壤上吸附的热力学函数由下式计算[10]:
ΔG0=-RTlnKd,
(5)
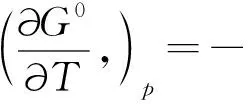
(6)
ΔH0=ΔG0+TΔS0,
(7)
式中,R(8.3145 J/(mol·K))为理想气体常数,T(K)为开氏温标温度.上述热力学函数经计算后列于表3.
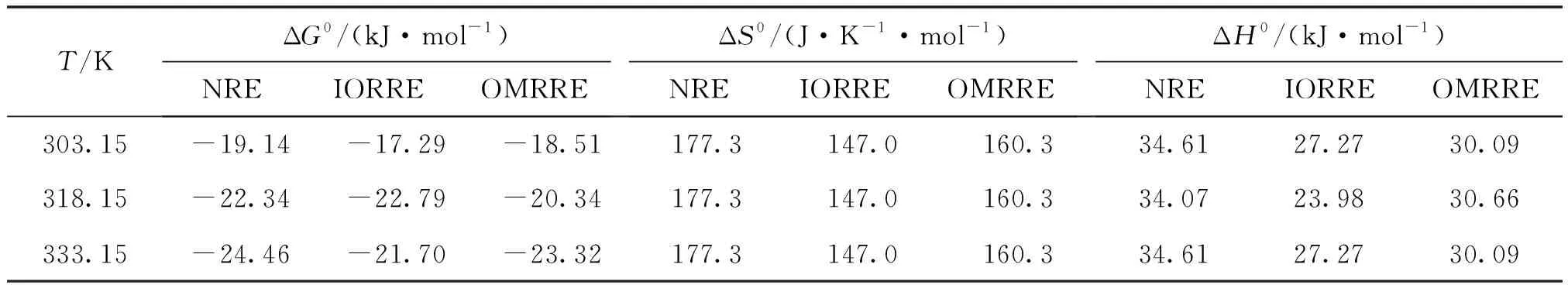
表3 Eu(Ⅲ)在红壤及其实性成分上的吸附热力学函数
由计算结果可知,在实验条件下,吸附是一个自发过程,因为反应的吉布斯自由能变(ΔG0)是负值.同一样品下,随着温度升高,ΔG0的绝对值总体逐渐变大,说明温度可以促进吸附反应进行.而在IORRE体系,318.15 K,ΔG0出现一个绝对值最大值,说明吸附过程中可能存在某个趋势上的拐点.结合吸附等温线及计算的各温度Kd值,表明温度已经由促进吸附反应的因素逐步变成阻碍吸附的因素,即成为有利于解吸的因素.3个温度下的标准焓变(ΔH0)都为正值,说明吸附过程为吸热过程.吸附过程的熵都为正值,反映出在溶液中存在红壤对Eu(Ⅲ)吸引力,同时也进一步说明吸附反应是一个自发过程.
3 结论
综上,由Eu(Ⅲ)在不同条件下在天然红壤、去氧化铁成分红壤及在去有机质红壤上吸附实验的结果,可以得出以下结论:
1)Eu(Ⅲ)在3种红壤上吸附行为特征基本一致.相同条件下,Eu(Ⅲ)在去氧化铁成分红壤上的吸附百分率更高,其反应速率常数约为天然红壤的6倍.Eu(Ⅲ)的吸附受pH和离子强度影响较大,这主要与Eu(Ⅲ)在水溶液中的存在形态有关.在pH<7时,离子交换或外层表面络合是吸附的主要机理,而在pH>7后,内层表面络合可能是吸附的主要机制.
2)相同实验条件下,去氧化铁成分红壤的吸附平衡时间最短.3种红壤吸附反应动力学均可被准二级动力学方程所描述.
3)在较低pH值时,HA的存在能够促进红壤对Eu(Ⅲ)的吸附,而在高pH值下,HA的促进作用则不明显.由热力学函数计算结果,可见Eu(Ⅲ)在3种红壤上的吸附均是自发过程.对天然红壤和去氧化铁成分红壤,在较低温度(303.15~318.15 K)升温有利于吸附反应进行,而在较高温(318.15~333.15 K)升温则不利于吸附进行,这一现象在去有机质成分红壤中并未出现.说明红壤中的有机质在低温下能够促进吸附进行,而在高温下分解,并与红壤产生竞争吸附,抑制吸附的进行.Eu(Ⅲ)在3种红壤上的吸附热力学均能够被Freundlich吸附模型所描述.
参 考 文 献:
[1] CHEN Lei, YU Xianjin, ZHAO Zengdian. Effect of humic acid, pH and ionic strength on the sorption of Eu(Ⅲ) on red earth and its solid component[J]. Journal of Radioanalytical and Nuclear Chemistry, 2007, 274 (1):187-193.
[2] 李程峰, 刘云国, 曾光明, 等. pH值影响Cd在红壤中吸附行为的实验研究[J].农业环境科学学报,2005, 24(1): 84-88.
LI Chengfeng,LIU Yunguo,ZENG Guangming,et al.A effect of pH on Cadmium adsorption behavior in red soils[J].Journal of Agro-Environment Science,2005,24(1):84-88.
[3] 张茂林, 杨子谦, 吴王锁. Eu(Ⅲ)和Am(Ⅲ)在凹凸棒石上的吸附行为[J].核化学与放射化学, 2008, 30(2): 120-124.
ZHANG Maolin,YANG Ziqian,WU Wangsuo.Sorption of Eu(Ⅲ) and Am(Ⅲ) on attapulgite[J].Journal of Nuclear and Radiochemistry,2008,30(2):120-124.
[4] DONG Wenming, WANG Xiangke, DU Jinzhou, et al. Sorption and desorption characteristics of Eu(Ⅲ) on red earth[J]. Journal of Radioanalytical and Nuclear Chemistry, 1999, 242(3): 793-797.
[5] TAO Zuyi, LI Weijuan, ZHANG Fuming, et al. Adsorption of Am(Ⅲ) on red earth and natural hematite[J]. Journal of Radioanalytical and Nuclear Chemistry, 2006, 268 (3):563-568.
[6] FAN Qiaohui, SHAO Dadong, LU Yi, et al. Effect of pH, ionic strength, temperature and humic substances on the sorption of Ni (II) to Na-attapulgite[J]. Chemical Engineering Journal, 2009, 150 (1): 188-195.
[7] 马志广, 刘盼, 刘素文, 等. 壳聚糖-铝氧化物复合材料对Cd2+的吸附动力学及热力学[J]. 河北大学学报:自然科学版, 2011, 31(4):380-384.
MA Zhiguang,LIU Pan,LIU Suwen,et al.Kinetics and thermodynamic studies on the adsorption of Cd2+onto chitosan-aluminium oxide composite material[J].Journal of Hebei University:Natural Science Edition,2011,31(4):380-384.
[8] VADIVELAN V, VASANTH KUMAR K. Equilibrium, kinetics, mechanism, and process design for the sorption of methylene blue onto rice husk[J]. Journal of Colloid and Interface Science, 2005, 286:90-100.
[9] ZHU Maoxu, DING Kuiying, JIANG Xin, et al. Investigation on co-sorption and desorption of fluoride and phosphate in a red soil of China[J]. Water Air and Soil Pollution, 2007, 183: 455-465.
[10] YANG Shitong, LI Jiaxing, LU Yi, et al. Sorption of Ni (II) on GMZ bentonite: effects of pH, ionic strength, foreign ions, humic acid and temperature[J]. Applied Radiation and Isotopes, 2009, 67:1600-1608.
