苦参碱对人前列腺癌PC-3M细胞周期与凋亡的影响
2014-08-14王桂秋
王桂秋
0 引言
前列腺癌是一种男性前列腺组织中的恶性肿瘤,其发病是前列腺腺泡细胞基因突变导致增殖不受控制的结果[1]。随着病情的恶化,前列腺癌还会扩散到邻近器官,甚至转移到远端部位,尤其是淋巴结和骨髓[2]。临床上,该病的治疗包括手术疗法、化学疗法、放射疗法、激素疗法单一治疗或是几种疗法联合应用[3]。而中药治疗癌症具有其独特的好处,包括低毒、多靶点、药性温和等[4]。苦参碱提取自豆科植物苦参(Sophora flavescens Ait)的根,具有利尿、抗病原体、抗肝炎、抗炎等作用,以及提高免疫力的药理活性[5-6]。因此,在当前的实验中,我们建立体外稳定的前列腺癌PC-3M细胞模型,以细胞凋亡为研究目标,进一步探讨苦参碱的抗肿瘤作用与凋亡相关通路的内在联系,为证明其对PC-3M促凋亡的作用机制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人前列腺癌PC-3M细胞,购自上海肿瘤研究所。
1.1.2 药物与试剂 苦参碱(纯度>98%):Spectrum公司。DMEM培养基:Invitrogen公司。小牛血清:Amersco公司。胰蛋白酶:Amersco公司。0.25%胰酶:Gibco公司。甲基偶氮唑盐(MTT):Sigma公司。二甲基亚砜(DMSO):南京建成生物工程研究所。PI染色试剂盒:Roche公司。Cyclin D1蛋白抗体:南京建成生物工程研究所。DAB显色试剂盒:北京中杉金桥生物技术有限公司。p-ERK1/2抗体:Invitrogen公司。蛋白裂解液:南京建成生物工程研究所。磷酸甘油醛脱氢酶(GAPDH):Invitrogen公司。
1.1.3 仪器 Model 311 CO2培养箱(美国Thermo Forma公司)。IX71-A21PH倒置显微镜(日本Olympus公司)。SZX型超净工作台(上海浦东跃欣科学仪器厂)。GelDoc XR+凝胶成像系统(美国Bio-rad公司)。JC303A-T电热恒温培养箱(成都一恒科技有限公司)。
1.2 方法
1.2.1 细胞培养 无菌环境下,培养基RPMI-1640中加入新配置15% FBS、200 μg/mL青霉素、l50 μg/mL链霉素(4 ℃保存)。PC-3M细胞复苏后,接种在培养瓶安置CO2培养箱中孵化(37 ℃,5% CO2)。D-Hank′s液冲洗3次,加入5 mL 0.25%的胰蛋白酶液,置37 ℃约10 min。终止消化后,细胞悬液移入无菌刻度离心管中,低速离心10 min后消化3次,进行细胞计数步骤。
1.2.2 分组及给药 精密称取苦参碱100 μg,用含10%小牛血清的RPMI 1640培养基稀释成不同浓度的MR终浓度(0、30、60、120 μM),每孔100 μL,同时设5个平行孔/组,重复实验5次,获取平均值数据。应用Graphpad Prism软件计算IC50(半数抑制率),即MR治疗PC-3M细胞24、48、72 h后的IC50值。同时增设对照组。细胞增殖抑制率=(OD对照-OD治疗)/(OD对照-OD空白)×100%
1.3 指标检测 MTT法检测MR对PC-3M抑制率,PI染色检测细胞形态学的变化,免疫组织化学法检测细胞周期蛋白D1(Cyclin D1)表达,Western blot法检测细胞外调节蛋白激酶1/2(ERK1/2)磷酸化蛋白水平。
2 结果
2.1 MR给药后对PC-3M细胞抑制作用 MTT法结果显示,不同浓度MR抑制PC-3M的作用逐渐增强,与空白组比较差异有统计学意义(P<0.01)。此外,随着时间的增加,MR的抑制作用不断增强,提示MR治疗有一定的时间-剂量依赖性。见图1。
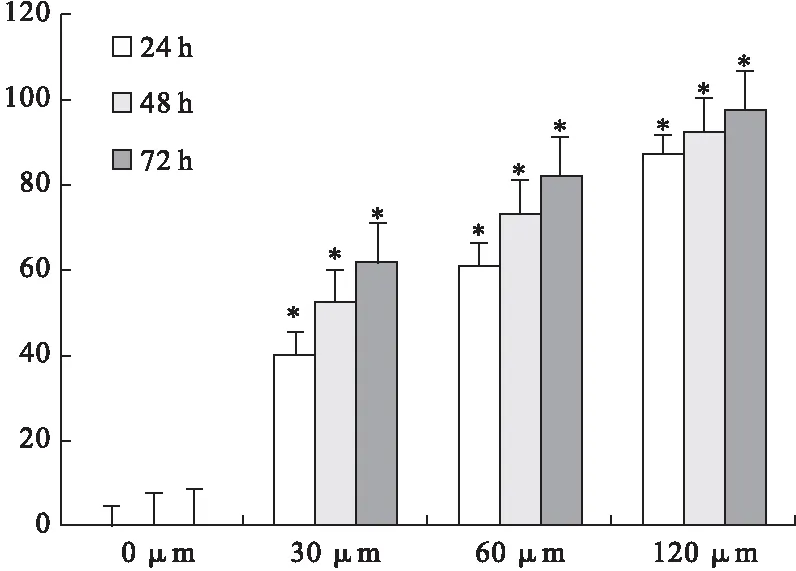
图1 MR给药对PC-3M细胞增殖的抑制作用
2.2 MR给药后对PC-3M细胞组织形态学变化的作用 PI染色结果表明,空白组中PC-3M的细胞形态规则,轮廓清晰,核仁透亮,核浆比例正常。30 μM浓度MR给药72 h后,PC-3M细胞体积缩小,细胞质空泡增多,核收聚,出现细胞凋亡。而经过60、120 μM浓度MR给药,PC-3M细胞皱缩、脱落、密度降低,同时凋亡细胞计数增多。见图2。
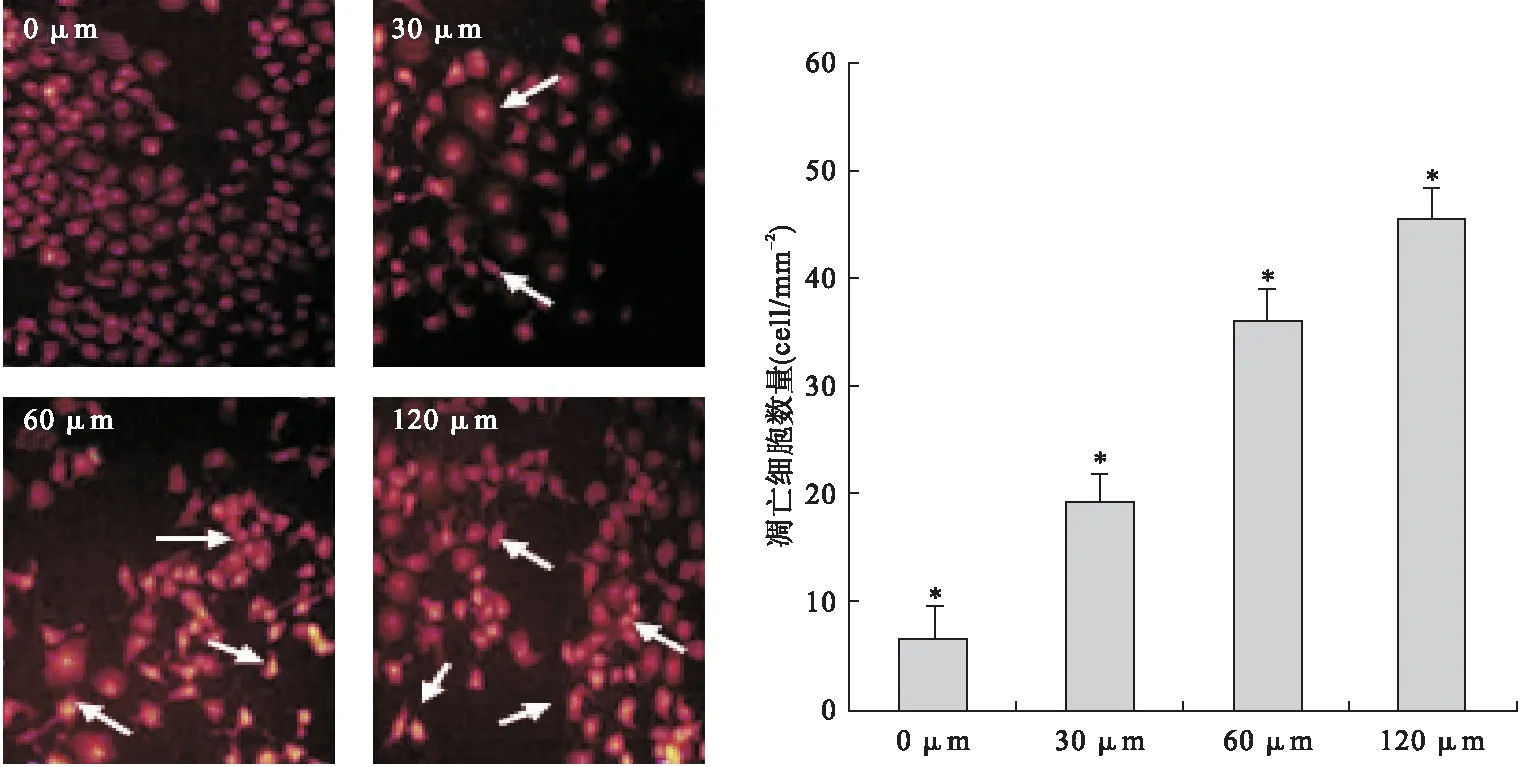
图2 MR给药后对PC-3M细胞形态的影响(PI染色,×100)
2.3 MR给药后对PC-3M细胞Cyclin D1表达的影响 免疫组化结果显示,空白组中PC-3M细胞Cyclin D1阳性细胞数量较多,处于激活状态。经MR给药后,PC-3M细胞Cyclin D1阳性细胞表达明显减少,与空白组比较差异有统计学意义(P<0.01)。此外,结果显示一定的时间-剂量依赖关系。见图3。
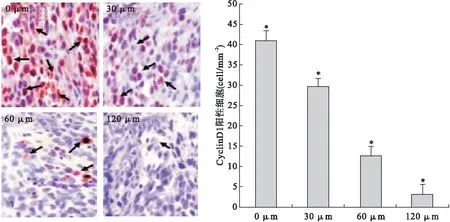
图3 MR给药抑制PC-3M细胞Cyclin D1的表达(免疫组织化学染色,×100)
2.4 MR给药后对PC-3M细胞Cyclin D1表达的影响 Western blotting结果显示,空白组内源性p-ERK1/2水平上调,处于过表达状态。经MR给药后,PC-3M细胞增加的p-ERK1/2表达有效地下调,与空白组比较差异有统计学意义(P<0.01)。同时,实验结果提示一定的时间-剂量依赖性。见图4。
3 讨论
前列腺癌是严重危害男性生命的恶性癌症之一,当前主要采用放疗、化疗、手术、药物治疗等措施进行防治,但都普遍存在预后差和复发性[7]。而传统中药在前列腺癌的防治工作方面获得了有效的进步[8]。在本实验中,MTT结果表明,在生理状态下PC-3M细胞增殖速度快,提示调控肿瘤细胞的过度增殖可以作为治疗的方向。MR给药后,能显著抑制PC-3M增殖与分化,提示MR具有抑制肿瘤细胞增殖作用。此外,PI染色结果也说明,MR给药能诱导PC-3M细胞发生形态变化,发生细胞凋亡现象。

图4 MR给药抑制PC-3M细胞p-ERK1/2的活性
Cyclin D1是细胞周期调节因子之一,不受控制的表达是原发性前列腺癌的特征,对临床预后诊断具有重要意义[9]。肿瘤细胞中,Cyclin D1加速癌细胞周期素过度表达,同时造成CKIs细胞分裂的蛋白失活,从而加速肿瘤细胞的增殖、分化和生长[10]。免疫组化结果显示,PC-3M细胞内源性Cyclin D1过度表达,说明Cyclin D1的异常表达促进了PC-3M细胞不断增殖和分化。MR给药后,能有效抑制PC-3M细胞Cyclin D1的表达,提示MR通过抑制PC-3M细胞Cyclin D1的活性而发挥抗肿瘤作用,结果与MTT实验数据一致。
研究发现,细胞外调节蛋白激酶ERK1/2的生物学效应与细胞的增殖和分化密切相关,作用机制与其通过磷酸化反应可调节某些转录因子的活性,从而引起靶蛋白的活性变化,最终调节细胞代谢功能[11]。此外,ERK1/2的抗凋亡作用与激活磷酸化抗凋亡分子(如bac-2,Bad等)以及激活转录因子(如Cyclin D1等)有关[12]。因此,药物干预作用在肿瘤细胞的ERKl/2靶点有助于抑制其发生发展。本实验研究表明,PC-3M细胞内源性p-ERKl/2明显上调。经MR给药后,PC-3M细胞p-ERKl/2的表达被有效地下调,提示MR作用与PC-3M细胞ERKl/2靶点,抑制其生理活性,进而调节蛋白组件Cyclin D1的表达,进而诱导癌细胞发生细胞凋亡,故推测MR抗肿瘤作用与其抑制癌细胞内源性ERK1/2/Cyclin D1通路有关。
参考文献:
[1] Yang B,Bhusari S,Kueck J,et al.Methylation profiling defines an extensive field defect in histologically normal prostate tissues associated with prostate cancer[J].Neoplasia,2013,15(4):399.
[2] Ryan CJ,Smith MR,de Bono JS,et al.Investigators.Abiraterone in metastatic prostate cancer without previous chemotherapy[J].N Engl J Med,2013,368(2):138.
[3] Tosoian JJ,Loeb S.Radical retropubic prostatectomy:comparison of the open and robotic approaches for treatment of prostate cancer[J].Rev Urol,2012,14(1-2):2.
[4] 何坚,胡建新,孙兆林,等.参芪结合雄激素阻断治疗前列腺癌[J].中国实验方剂学杂志,2011,17(1):189.
[5] 刘丽敏,刘华钢,毛俐,等.苦参碱和氧化苦参碱体外对肿瘤细胞增殖的影响[J].中国实验方剂学杂志,2008,14(11):35.
[6] 熊永爱,韩丽,王淼,等.氧化苦参碱干预IκB-α蛋白对溃疡性结肠炎的治疗作用机制研究[J].中国实验方剂学杂志,2012,18(8):152.
[7] Darwish OM,Raj GV.Management of biochemical recurrence after primary localized therapy for prostate cancer[J].Front Oncol,2012,2(5):48.
[8] Parekh HS,Liu G,Wei MQ.A new dawn for the use of traditional Chinese medicine in cancer therapy[J].Mol Cancer,2009,8:21.
[9] Fu M,Wang C,Li Z,et al.Minireview:Cyclin D1:normal and abnormal functions[J].Endocrinology,2004,145(12):5439.
[10]Jirawatnotai S,Hu Y,Michowski W,et al.A function for cyclin D1 in DNA repair uncovered by protein interactome analyses in human cancers[J].Nature,2011,474(7350):230.
[11]Roskoski R Jr.ERK1/2 MAP kinases:structure,function,and regulation[J].Pharmacol Res,2012,66(2):105.
[12]Li DY,Tao L,Liu H,et al.Role of ERK1/2 in the anti-apoptotic and cardioprotective effects of nitric oxide after myocardial ischemia and reperfusion[J].Apoptosis,2006,11(6):923.
