控制刺激性饮食联合熊去氧胆酸治疗对妊娠期肝内胆汁淤积症妊娠结局的临床分析
2014-08-14尹学琼杨雪梅
尹学琼,倪 瑶,吕 艳,杨雪梅,谢 辉
(四川省崇州市妇幼保健院产科 611230)
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)是妊娠期特有的并发症,以瘙痒伴或不伴黄疸及血中胆汁酸、肝酶水平升高为其临床特点。对孕妇和胎婴儿均有严重的影响,ICP可发生无任何征兆胎心消失,是目前公认对胎儿极有威胁的高危妊娠[1-2]。ICP的发病率在不同国家及地区其差异很大,中国的长江流域包括四川地区为ICP的高发区,ICP的发病率为1%~4%,作者工作的科室为四川西部的市级妇幼保健院,2011~2013年住院分娩ICP发病率为6%~8%,ICP发生的死胎约占死胎发生率的20%。四川为盆地气候,空气较为湿润,饮食习惯以麻辣等刺激性食物为主[3-4]。研究显示,麻辣等刺激性食物对体内多个系统有影响,促使皮肤症状的加重即为辣椒素的重要不良影响之一[5-6]。而大多数ICP患者因为皮肤瘙痒而就诊。作者在临床工作中观察到很多ICP患者有进食刺激性食物的饮食习惯,为探讨麻辣饮食等特殊饮食习惯是否影响ICP患者妊娠结局,本院开展了“饮食控制联合药物治疗对ICP患者妊娠结局的影响”的相关课题,对产科病房有麻辣饮食习惯的ICP住院患者进行饮食控制联合熊去氧胆酸治疗并进行分析,为有针对性的指导孕妇合理营养饮食,促进母婴健康提供资料,也为四川及周边地区ICP患者调整饮食结构作为参考,现报道如下。
1 资料与方法
1.1 一般资料 2011年7月至2012年8月在本院住院分娩确诊的ICP孕妇120例。患者纳入标准,纳入患者为有进食麻辣等刺激性饮食习惯患者,主要来自农村经济欠发达地区,入院前被诊断为ICP(ICP诊断标准参考文献[7]等诊断标准),入院后经护士观察仍有麻辣饮食进食情况,患者入院前未进行其他干预措施。
1.2 方法
1.2.1 患者分组情况 入选患者随机分为A组(饮食控制联合药物治疗,60例);B组(单纯药物治疗,60例),入院前未经任何干预。年龄23~34岁,开始治疗孕周28~36周。
1.2.2 患者干预情况 B组:口服熊去氧胆酸(宜昌人福药业有限公司,批号:H42022097)15mg·kg-1·d-1;同时辅以维生素C及能量合剂。A组:在B组基础上,由专门培训后的护士每日提醒患者,发给带有详细说明的膳食资料(低脂清淡饮食),控制麻辣等刺激饮食的摄入,同时对患者饮食控制情况进行监督并记录。每周复查肝功,自数胎动、定期做胎监、定期复查B超及脐血流。
1.3 临床观察指标 两组产妇在年龄、孕周、治疗前后的瘙痒评分、生化指标值[血清胆汁酸(TBA)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)],以及妊娠结局等方面比较。瘙痒评分原则:每例患者治疗前后由经项目组专门培训后的医师观察瘙痒症状,并进行评分。评分标准采用 Ribaha(1991年)[8-9]制订的标准:0分为无瘙痒;1分为偶发瘙痒;2分为间断性瘙痒,无症状波动;3分为间断性瘙痒,有症状波动;4分为持续性瘙痒,日夜无变化。记录孕妇分娩孕周、分娩方式、羊水粪染率、术中出血、Apgar评分及胎儿出生体质量。
1.4 统计学处理 采用SPSS17.0统计软件处理,计量资料以表示,组间比较采用t检验;计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 各组孕妇年龄、治疗开始孕周对比结果见表1。两组各指标差异无统计学意义(P>0.05),两组基线数据一致。
表1 两组待产孕妇一般数据比较()

表1 两组待产孕妇一般数据比较()
组别 年龄(岁) 治疗孕周(周)24.20±3.323 35.064±1.494 B组A组24.02±4.288 35.443±1.132
2.2 干预前后瘙痒评分及生化指标值比较 (1)治疗前两组瘙痒评分、TBA、ALT、AST、ALP比较,差异无统计学意义(P>0.05)。(2)经治疗后两组瘙痒评分、TBA、ALT、AST等指标均有所降低(P<0.05)。A组AST及ALP在治疗后降低(P<0.05),而B组AST及ALP治疗前后差异无统计学意义(P>0.05)。(3)治疗后 A组在瘙痒评分、TBA、ALT、AST、ALP均低于B组(P<0.05),见表2。
2.3 两组妊娠结局及不良反应情况比较 结果表明,两组剖宫产率差异无统计学意义(P<0.05)。A组终止妊娠周数长于B组(P<0.05);A产后出血量低于B组(P<0.05);A组羊水总体污染发生率及羊水重度污染率均低于B组(P<0.05);B组发生死胎1例,A组无死胎发生。新生儿方面,A组新生儿体质量及 Apgar评分高于B组(P<0.05),见表3~4。
表2 两组待产孕妇治疗前后瘙痒评分及生化指标比较()

表2 两组待产孕妇治疗前后瘙痒评分及生化指标比较()
a:P<0.05,与B组同时间段比较;b:P<0.05,与治疗前比较。
组别 时间 瘙 μ/L)5.78±94.267 261.30±103.450治疗后 0.920±0.462ba 15.73±8.073ba 135.68±92.675ba 108.60±69.896ba 155.80±85.402ba B组 治疗前 2.433±0.621 36.74±26.173 207.00±93.734 179.80±80.175 242.22±80.784治疗后 1.583±0.497b 27.83±18.078b 175.13±73.295b A组 治疗前 2.600±0.643 35.31±23.972 242.98±119.334 19158.20±73.570 218.77±71.743
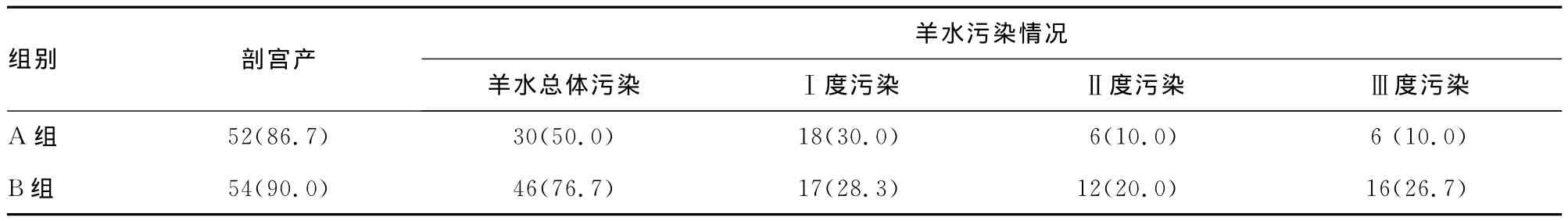
表3 两组待产孕妇剖宫产率及羊水污染情况比较[n(%)]
表4 两组待产孕妇妊娠结局其他指标比较()

表4 两组待产孕妇妊娠结局其他指标比较()
a:P<0.05,与B组比较。
组别 终止妊娠周数(周) 产后出血量(mL) 新生儿体质量(kg) Apgar评分(分)A组 37.660±1.139a 309.75±46.573a 3052.500±357.300a 9.633±0.637a B组 36.781±0.938 333.33±61.497 2788.983±347.909 9.237±1.104
3 讨 论
ICP是妊娠中、晚期常见并发症之一,对孕妇和胎儿都有不良的影响。特别是突发胎死宫内常常是产科医生和孕妇最大的困惑。ICP的确切病因目前尚不明确,发病机制较为复杂。但ICP在疾病早期都存在不同程度的皮肤瘙痒[10]。虽然目前还未见ICP孕妇皮肤瘙痒程度与围产儿结局的相关性研究,但是皮肤瘙痒是ICP首发症状,是绝大多数ICP就诊的直接原因,也是早期发现ICP最重要的线索。有学者报道其原因是胆盐储留于皮肤深层,刺激皮肤感觉神经末梢所致。针对出现的皮肤症状,部分患者特别是经济比较落后的偏远农村孕妇,因其缺乏相关知识而过度搔抓,甚至引起皮肤破溃等症状,对孕妇困扰较大,影响其日常生活;同时,营养知识的缺乏也导致患者未能在膳食习惯上进行改进,本院住院产妇中大多在入院以前仍有经常进食麻辣等刺激性食物的历史。金哲虎等[6]研究发现,食用麻辣食物会明显增强皮肤尤其是破损皮肤的刺激,且食用麻辣刺激食物越多,对皮肤刺激性的加重效果越明显,因此,刺激性饮食可能加重ICP患者皮肤瘙痒。当前已有系统研究熊去氧胆酸治疗ICP的疗效观察及总结,而针对特殊饮食习惯对ICP的治疗效果的影响研究尚不多见[11]。本文研究发现,A组患者与B组患者在治疗后瘙痒评分、TBA及肝酶指标均有下降,但A组治疗后瘙痒评分下降趋势更明显,表明在刺激饮食控制联合治疗的情况下,对皮肤瘙痒的症状缓解更为有效。本研究还发现,仅用熊去氧胆酸治疗而未进行刺激饮食控制的B组ALT、AST、ALP在治疗后下降程度较A组ALT、AST、ALP下降程度低。因此,以熊去氧胆酸等药物为主的常规治疗方案在对ICP的治疗过程中,进行饮食习惯的干预是有益的。
研究显示,ICP发生死胎高于一般人群,ICP增加早产的发生率(自然早产和医源性早产)、增加胎儿窘迫、羊水粪染等不良结局,其主要原因是胎盘缺血缺氧,无氧酵解增加而导致酸性代谢产物增多,进而引起胎盘功能紊乱所致,而胆汁酸可刺激胎儿结肠运动,导致胎便排出增加而使羊水粪染,增加围产儿预后不良[12]。本研究发现,与单纯药物治疗方案相比,两组在分娩方式上未见明显差别,但A组终止妊娠孕周明显延长,减少了早产的发生率;胎儿体质量较B组增加,减少了低体质量儿的发生率;同时可以减轻羊水污染(尤其是重度羊水污染),新生儿胎粪吸入性肺炎发生率减少,亦无死胎等严重不良事件发生;且产后出血量更少。说明刺激饮食控制后孕妇及胎儿安全性将得到更好的保障。
本研究发现在常规药物治疗同时要求患者低脂清淡饮食可更好的缓解ICP的皮肤瘙痒症状,加快孕妇生化指标好转甚至恢复正常,使ICP临床症状得到更好的控制,也可以有效地减少胎儿的不良预后。根据四川及周边地区的麻辣饮食习惯制订相关的饮食控制措施,对四川及周边地区的ICP是有益的。由于本研究患者大多来自西部农村欠发达地区,其经济水平低,患者文化知识有限,对于孕期如何进行合理膳食安排等知识并不尽知晓。本文建议应加强孕期营养知识的宣传和指导,合理膳食。营养咨询与营养干预,应与ICP早期诊断、及早的药物干预同时进行,对保证母婴健康都非常重要。对四川及周边地区有麻辣饮食习惯的孕妇早期进行营养膳食指导,刺激饮食干预可望减少四川地区及周边ICP的发生率。同时由于本研究样本量有限,更大样本量的研究是有必要的。
[1]FartákováZ,Simják P,Vítek L,et al.Intrahepatic cholestasis of pregnancy[J].Neoreviews,2013,78(3):276-280.
[2]Turunen K,Helander K.Health history after intrahepatic cholestasis of pregnancy[J].Acta Obstet Gynecol Scand,2012,91(6):679-685.
[3]蓝勇.中国饮食辛辣口味的地理分布及其成因研究[J].人文地理,2001,20(5):84-88.
[4]杜莉.论花椒、辣椒在川菜的运用及其影响[J].中国调味品,2011,36(12):16-19.
[5]骆媛,王永安.新型控暴剂辣椒素的致伤效应研究进展[J].国际药学研究杂志,2011,38(6):432-437.
[6]金哲虎,刘楠.辛辣食物影响咪唑烷基脲刺激皮肤的动物实验[J].中国皮肤性病学杂志,2012,26(3):209-212.
[7]曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1999:501-507.
[8]Ribalta J,Reyes H,Gonzalez MC,et al.S-adenosyl-L-methionine in the treatment of patients with intrahepatic cholestasis of pregnancy:a randomized,double-blind,placebo-controlled study with negative results[J].Hepatology,1991,13(6):1084-1089.
[9]Geenes V,Williamson C.Intrahepatic cholestasis of pregnancy[J].World J Gastroenterol,2009,15(17):2049-2066.
[10]Chao TT,Sheffield JS.Primary dermatologic findings with early-onset intrahepatic cholestasis of pregnancy[J].Obstet Gynecol,2011,117(2Pt 2):456-458.
[11]Azzaroli F,Turco L,Lisotti A,et al.The pharmacological management of intrahepatic cholestasis of pregnancy[J].Curr Clin Pharmacol,2011,6(1):12-17.
[12]Lee RH,Incerpi MH,Miller DA,et al.Sudden fetal death in intrahepatic cholestasis of pregnancy[J].Obstet Gynecol,2009,113(2Pt 2):528-531.
