化学合成小干扰RNA对大鼠脑内AQP4蛋白沉默效果验证与筛选
2014-08-14宋振全刘恩智柳云恩张海松单提坤
宋振全,赵 旭,,刘恩智,柳云恩,张 兴,张海松,单提坤,赵 航
1.沈阳军区总医院神经外科,辽宁 沈阳 110016;2.辽宁医学院研究生学院,辽宁 锦州 121001;3.沈阳军区重症(战)创伤实验室,辽宁 沈阳 110016
脑水肿是创伤性脑损伤(traumatic brain injury,TBI)后的基本病理过程之一,也是致残、致死的重要因素之一[1]。研究发现,水孔通道蛋白4(aquaporin4,AQP4)与脑水肿的发生发展有着紧密的联系[2,3]。将序列特异性双链RNA (dsRNA)导入机体,使细胞内同源mRNA降解,产生特异的基因沉默,这种现象被称为RNA干扰(RNA interference,RNAi)。有研究利用RNA干扰技术,设计合成靶向AQP4的RNA片段,通过有效的细胞转染,对AQP4进行基因表达沉默,可以有效地抑制脑水肿的发生发展[4]。临床研究认为,创伤性脑水肿的早期治疗最为关键,但损伤早期的机制十分复杂,有必要找出一种快速有效地抑制AQP4蛋白的方法,以便于研究脑水肿初期损伤的机制和指导临床用药。
1 材料与方法
1.1 实验材料
1.1.1 动物分组 健康成年雄性Wistar大鼠18只,体重250~300 g。由沈阳军区总医院动物实验中心提供[实验中心许可证号SYXK(军)2002-019][动物许可证号SCXK(军)2002-0174],大鼠自由获得食物及水,在14 h/10 h的照明/熄灯周期条件下喂养。实验动物按随机数字表法分为注射阴性对照液组、注射725链组和注射1006链组。
1.1.2 主要试剂及仪器 根据分析软件设计并筛选出2条大鼠AQP4siRNA链,分别为:大鼠小干扰RNA(Aqp4-rat-725:5′GCAGUUAUCAUGGGAAACUTT 3′,5′AGUUUCCCAUGAUAACUGCTT 3′);(Aqp4-rat-1006:5′CUCGUCUGGAGAGGUAUUATT 3′,5′UAAUACCUCUCCAGACGAGTT 3′)(上海吉玛公司设计并制备)。AQP4siRNA浓度为10 μmol/L,是将0.25 OD siRNA溶于20 μL 焦磷酸二乙酯(DEPC)水中配得。兔抗鼠AQP4抗体(BA1560, 武汉博士德公司);辣根过氧化物酶标记的山羊抗兔IgG (St.Louis,MO,北京中杉公司);AQP4原位杂交检测试剂盒(武汉博士德公司)。
主要仪器有:Olympus荧光显微镜IX71(日本东京);SR-6R大鼠脑立体定向仪(日本东京三菱公司)。
1.2 实验方法
1.2.1 立体定向脑室内给药 采用水合氯醛350 mg/kg腹腔内注射麻醉,俯卧位固定,头部备皮、消毒。于前囟后约1.0 mm,以中线旁开1.5 mm为中心,以磨钻磨一骨窗,直径约2 mm,显露硬脑膜。以微量注射器自骨窗中心脑表面垂直进针3.5 mm,向脑室内缓慢注射(约5 min)AQP4siRNA或阴性对照液20 μL,等待3~5 min后缓慢退针(约2 min)。
1.2.2 各实验组处理 3月龄雄性Wistar大鼠,按照随机数字表法将其分为:注射阴性对照液组、注射725链组和注射1006链组。各组分别经过脑室注射阴性对照液、725链siRNA或1006链siRNA。
1.2.3 一般情况观察 大鼠苏醒后观察精神、饮食、运动及肢体运动改变情况。
1.2.4 灌注、取材及包埋 大鼠麻醉后,显露心脏,左心室插管后剪开右心耳,快速灌注4%多聚甲醛200 mL,直至流出液体清亮;灌注完毕后取全脑,冠状切取损伤中心脑组织, 置于4%多聚甲醛中浸泡固定4 h;经梯度酒精脱水,二甲苯透明,进行石蜡包埋。
1.2.5 AQP4蛋白免疫组织化学观察 石蜡切片预处理后滴加1∶200免抗鼠AQP4多克隆抗体,阴性对照组标本加入等量抗体稀释液,37 ℃孵育2 h;滴加1∶100/磷酸盐缓冲液(PBS)生物素化抗体,37 ℃孵育30 min;滴加1∶100/PBS 链霉亲和素-生物素复合物(SABC),37 ℃孵育30 min。通过图像分析软件计算全脑单位面积的AQP4免疫阳性强度。
1.2.6 原位杂交方法检测AQP4 mRNA的表达 石蜡切片经预处理后,通过AQP4原位杂交试剂盒鉴定AQP4mRNA的表达,二氨基联苯胺(DAB)显色,显微镜下观察,并通过图像分析软件计算全脑单位面积AQP4mRNA平均阳性强度。

2 结 果
2.1 免疫组织化学结果 注射725链组和注射1006链组AQP4蛋白含量较注射阴性对照液组明显减少,两条siRNA链均能有效减少AQP4蛋白的含量( 图1,表1)。与注射1006链组比较发现,注射725链组对AQP4蛋白含量的抑制效果更加显著。AQP4阳性染色位于星形胶质细胞、室管膜细胞和血管间隙,神经元为阴性。注射725链组和注射1006链组在全脑单位面积的AQP4免疫阳性强度显著低于注射阴性对照液组。其中,注射725链组单位面积AQP4免疫阳性强度显著低于注射1006链组。

表1 各组大鼠脑内AQP4蛋白平均阳性细胞面积
注:与注射阴性对照液组比较,aP<0.05,与注射725链组比较,bP<0.05。
2.2 原位杂交结果 注射725链组和注射1006链组AQP4mRNA含量较注射阴性对照液组明显减少,两条siRNA链均能有效减少脑组织中AQP4mRNA的含量(图2,表2)。与注射1006链组比较发现,注射725链组对AQP4mRNA含量的抑制效果更加显著。AQP4mRNA原位杂交阳性细胞为棕褐色染色,阳性染色位于神经元和星形胶质细胞胞浆。注射725链组和注射1006链组在全脑单位面积的AQP4mRNA阳性强度显著低于注射阴性对照液组。其中,注射725链组AQP4mRNA平均阳性强度显著低于注射1006链组。
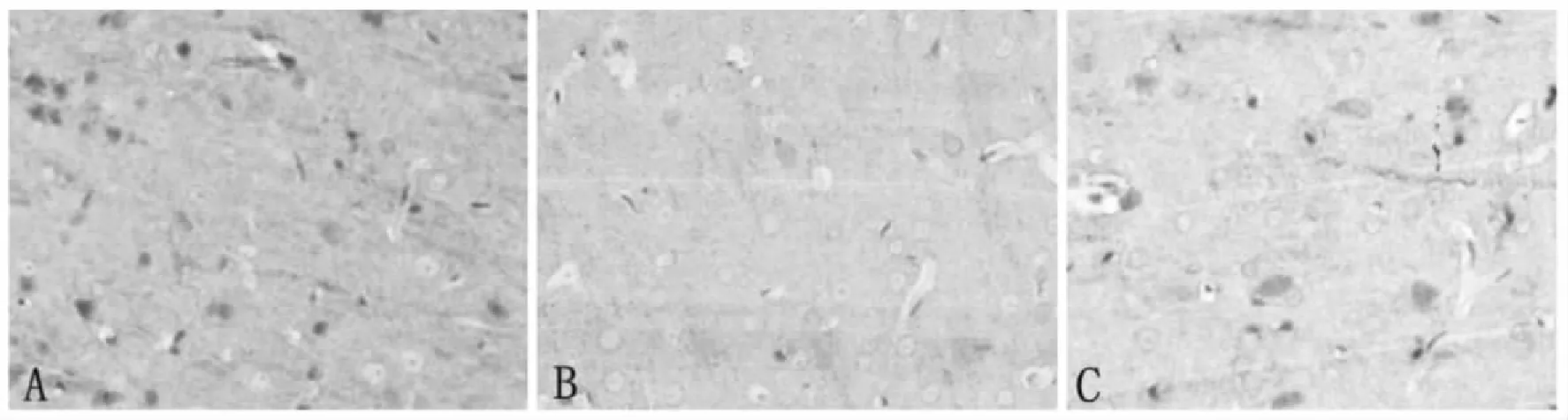
注: A:注射阴性对照液组;B:注射725链组;C:注射1006链组。图2 各组大鼠脑内的AQP4mRNA原位杂交染色

表2 各组大鼠脑内AQP4mRNA平均阳性细胞面积
注:与注射阴性对照液组比较,aP<0.05;与注射725链组比较,bP<0.05。
3 讨 论
AQP4蛋白主要存在于中枢神经系统的室管膜上皮细胞、蛛网膜下腔的软脑膜细胞和血管周围的星形细胞等[5,6],是胶质细胞、脑脊液以及血管之间相互调节和运输水分的重要结构基础[7]。研究证实,AQP4可以易化大脑中细胞内外水分的快速交换,在病理条件下可以导致水分的积累[8,9]。
目前,按照干扰RNA合成方法的不同分为5种,即化学合成法、体外转录法、“鸡尾酒”法、质粒或病毒载体介导的siRNA体内表达和siRNA表达框介导的siRNA体内表达。本实验证实,化学合成法合成的siRNA具有合成方便、起效快和沉默时间较短的特点。而使用病毒或质粒介导的siRNA体内表达无法在数小时内有效沉默目的蛋白。创伤性脑水肿早期损伤的机制十分复杂,治疗很关键,而化学合成法合成的725链siRNA对于AQP4蛋白沉默具有起效快、效率高、时间短的特点,便于研究脑损伤早期治疗时机的选择。
综上所述,脑室给予化学合成的siRNA725链,可以在短期(6 h)内显著降低脑组织中AQP4的mRNA和蛋白质水平,这将更适于脑损伤早期机制的研究,从而进一步指导临床用药。
[1] Cahill J,Zhang JH.Subarachnoid hemorrhage: is it time for a new direction?[J].Stroke,2009,40: 86-87.
[2] Papadopoulos MC,Verkman AS.Aquaporin-4 and brain edema[J].Pediatr Nephrol,2007,22(6): 778-862.
[3] King LS,Nielsen S,Agre P.Respiratory aquaporins in lung inflammation:the night is young[J].Am J Respire Cell Molboil,2000,22(1):8-10.
[4] 柴慈婧,姜忠敏,王骏飞,等.siRNA沉默水通道蛋白4治疗创伤性脑水肿的实验研究[J].武警医学院学报,2009,18(6):473-476.
[5] Venero JL,Vizuete ML,Machado A,et a1.Aquaporins in the central nervous system[J].Prog Neurobiol,2001,63:321-336.
[6] Amiry-Moghaddam M,Otsuka T,Hurn PD,et a1.An alpha syntrophin dependent pool of AQP4 in astroglial endfeet confers bidirectional water flow between blood and brain[J].Proc Natl Acad Sci,2003,100(4):2106-2111.
[7] Badaut J,Lasbenns F,Magistretti PJ,et a1.Aquaporins in brain:distribution,physiologt,and pathophysiology[J].J Cereb Blood Flow Metab,2002,22(4):367-378.
[8] Ke C,Poon WS,Ng HK,et al.Heterogeneous responses of aquaporin-4 in edema formation in a replicated severe traumatic brain injury model in rats[J].Neurosci Lett,2001,301(1):21-24.
[9] Manley GT,Fujimura M,Ma T,et al.Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J].Nat Med,2000,6 (2): 159-163.
