雌激素对小鼠心室肌细胞ATP敏感性钾离子通道活性的影响
2014-08-14朴伶华姜圣男柳贤德
朴伶华,姜圣男,柳贤德
(1. 海南大学农学院,海口,海南 570228;2. 海南医学院基础医学部,海口,海南 571199;3. 海南省海口市人民医院,海口,海南 570109)
随着生活水平的提高,心脏疾病的发生率也显著增高。心脏疾病无论是发生率还是预后,绝经前女性要比同年龄男性低。女性在绝经后由于体内雌激素水平的下降,其发生率较前有明显上升趋势。雌激素可通过心肌细胞上的雌激素受体产生抑制心肌重塑、心肌肥大及减轻心肌缺血再灌注损伤等,起到对心脏的保护作用[1]。
心肌细胞膜含有一种内向整流式钾通道,可以通过调节胞内ATP浓度水平而影响其活性的离子通道称之为ATP敏感性钾离子通道(ATP-sensitive potassium channel,KATP通道)[2-4]。在心肌缺血发生后,心肌细胞膜可通过增强KATP通道活性,使得心肌动作电位时程缩短,从而可发生严重的折返性心律失常[5]。然而现今雌激素对KATP离子通道活性的影响还不是很清楚。因此本研究拟通过膜片钳技术观察雌激素对小鼠心肌细胞KATP通道活性的影响,进一步分析雌激素在心肌缺血中的保护作用。
1 材料和方法
1.1 小鼠单一心室肌细胞制备
ICR 小鼠(25~40)g,雄性,腹腔注射肝素1 000 U/Kg,15 min后颈椎脱臼,快速开胸取出心脏并置于4℃无钙台式液中洗掉部分血液,随后迅速将心脏悬挂于Langendorff装置上进行主动脉逆流灌流。先用无钙台式液灌流(5~10)min,之后换上0.5 g/L胶原酶II酶溶液灌流20 min,待组织变软后换上KB溶液7 min,之后取下心室部分组织,置于KB溶液用吸管吹打,使细胞自然沉降,置于溶液中待用。灌流全程95% O2+ 5% CO2通氧。实验在室温(20~30)℃下进行。
1.2 实验溶液与试剂
无钙台式液(mmoL): NaCl 137 g;KCl 5.4 g;MgCl21.0 g;HEPES 10 g;Glucose 10 g,用NaOH调节至pH 7.4。KB溶液:KCl 25 g;taurin 20 g;L-glutamic acid 70 g;MgCl23 g;HEPES 10 g;glucose 10 g;KH2PO410 g, EGTA 0.5 g,用KOH调节至pH 7.40。单离子通道记录溶液(mmol):KCl 140 g;MgCl22 g;EGTA 5 g;HEPES 10 g, 用HCl调节至pH 7.2。全细胞记录溶液(mmol):KCl 140 g;MgCl22 g; CaCl21 g;EGTA 11 g;HEPES 10 g,用KOH调节至pH 7.2。膜内向外记录模式中,电极内溶液及浴液成分(mmol):KCl 140 g,MgCl22 g, EGTA 5 及HEPES 10 g,用HCl调节至pH 7.2。
全细胞记录模式中,浴液使用加入1 mol/L Ca2+的台式液,电极内液体成分(mmol/L):KCl 140 g,MgCl22 g, CaCl21 g, EGTA 11 g, 及HEPES 10 g,用KOH调节至pH 7.2。 Pinacidil 和2,4-dinitrophenol(DNP)作为KATP通道激动剂, glibenclamide作为通道活性抑制剂,使用PDBu(phorbol 12,13-dibutyrate)作为protein kinase C(PKC)激动剂,雌激素使用的是17α-ethynylestradiol 和 17β-estradiol。以上药品均来自Sigma Chemical Co。
1.3 玻璃微电极制备
本实验使用borosilicate玻璃管(Clark Electromedical Instruments Co., PG150T-7.5)在两步拉制仪(Flaming/Brown Micropipette Puller, Sutter Instrument Co.,P-97)下制备电极电阻为4-5 MΩ的微电极。制备的微电极在光学显微镜(Stereozoom microscope, Nikon, SMZ-2B)下涂抹Sylgard(Coring Co.)直至电极末梢部位,并进行干燥处理。涂抹后的电极重新在光学显微镜(Microforge, Narishige,MF-83)下观察(500倍),并进行抛光处理后直至微电极电阻为2-7MΩ。
1.4 膜片钳记录与分析
选取横纹及润盘清楚的心肌细胞进行膜内向外及全细胞吸附膜片钳方式记录。用台式液作为细胞外液进行灌注。将分离的心肌细胞置于倒置显微镜上的浴槽中,用膜片电极进行千兆封接。膜内向外及全细胞吸附形态形成后,信号由Ag/AgCl电极引导,经膜片钳放大器为(Axopatch 200A, Axon Instruments Inc.)放大、数模转换系统接收脉冲、采集数据,由pClamp7.0 (Axon Instruments Inc.)软件程序记录并分析信号。上述个实验在37℃恒温下进行。通道开放率(Po)
在30 s内,tj表示通道开放时间. N 活跃期开放通道数目。Td记录时间,n通道数目。用如下公式测量药物对通道活跃性影响
1.5 统计学方法
所有数据均已均数标准误差表示,以SPSS 10.0统计软件包进行统计学分析,采用配对t检验,P<0.05为统计学差异。
2 结果
2.1 分离小鼠心肌细胞的形态学特点
用急性酶解法分离的小鼠心肌细胞,在400倍光学显微镜下可观察到有35%~45%的细胞是呈条柱状,边界清晰,横纹排列清楚(图1)。在本实验中采用具有这些特征的细胞进行心肌细胞膜离子通道研究,发现封接成功率可达75%。

图1 急性分离的心肌细胞形态

图2 ATP敏感性钾离子通道的确认
2.2 ATP敏感性钾离子通道电流确认
当把无ATP实验溶液灌流到单一心肌细胞外液中,利用膜片钳制成膜内向外模式,当钳制电压-60 mV时,可出现激活的内向型电流通道。此时,当细胞外浴液中添加1 mmol/L ATP时,观察到激活的通道活性逐渐减弱,1 min后无激活的通道。当把浴液换成无ATP的溶液时,通道活性增强,这时候在溶液中添加KATP抑制剂glibenclamide 50 μmol/L,通道活性再次减弱,1 min后通道活性将消失(图2)。电流-电压相关关系曲线显示为内向定流性(inward rectification),slope conductance为(62 ± 1.5)pS。维持-60 mV时,单位通道电流平均值为(3.7 ± 0.25)pA,单开一个通道的dwell time和通道活性成反比。从以上通道的特性来看,本研究的单一活性通道可确认为ATP-敏感性通道(KATP)。除了上述提到的特别情况,本研究的patch clamp实验维持-60 mV电位时出现的内向电流为对象。
2.3 不同浓度雌激素对心肌细胞膜KATP通道影响
雌激素在人体内正常生理浓度男性为(40~115)ng/L,女性(61~350)ng/L。本实验在钳制电压-60 mV细胞膜内向外记录模式下,依据Boyan等[6]的报道,本实验分别向浴液中加入低浓度(0.1 μmol/L)、中浓度(1 μmol/L)及高浓度(10 μmol/L)三种不同浓度雌激素观对KATP通道的影响。观察到两种雌激素(17α-ethynylestradiol、 17β-estradiol) 均对KATP通道有抑制作用,且呈浓度依赖性,通道活性抑制率经pClamp7.0系统数据处理,其通道活性抑制的半数有效浓度分别为0.3 μmol/L 及 0.1 nmol/L(图3)。

图3 不同浓度雌激素对KATP离子通道的影响,半数有效浓度为0.3 μmol/L and 0.1 nmol/L
2.4 活化KATP通道早期雌激素对心肌KATP通道的影响
Pinacidil或2,4-dinitrophenol(DNP)均为细胞膜KATP离子通道开放剂的代表药物,能使膜KATP通道活化,通过加强K+离子外流,降低心肌兴奋性。在钳制电压-60 mV细胞吸附记录模式下,向浴液中加入pinacidil或2,4-dinitrophenol (DNP)活化KATP通道后,观察3 min,通道活性未见明显影响(图4)。

图4 雌激素对活化后KATP离子通道早期的影响
2.5 PDBu预处理后,雌激素对心肌细胞膜KATP通道的影响
Phorbol 12,13-dibutyrate(PDBu)是蛋白激酶C(protein kinase C, PKC)激动剂的代表药物之一,可使细胞内蛋白激酶C发生活化。在钳制电压-60 mV细胞膜内向外记录模式下,向浴液中加入PDBu 0.001 nmol/L进行预处理后,观察到雌激素(10-8,10-3和1 μmol/L)对KATP离子通道活性的抑制作用发生明显减弱(图5,图6)。
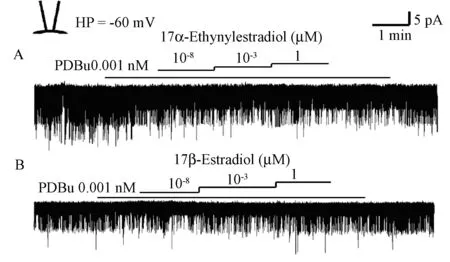
图5 雌激素对PDBu预处理后KATP离子通道的影响

图6 不同浓度雌激素对不同浓度PDBu抑制下KATP通道的影响
3 讨论
KATP离子通道广泛分布于心肌细胞、血管与非血管平滑肌细胞和神经细胞等多种细胞中。心肌细胞中KATP属于一种内向整流型钾通道。其开放状态主要受细胞内ATP浓度的影响,在一般正常生理情况下KATP通道处于关闭状态,但在某些病理情况下该通道被激活,开放的 KATP通道通过影响细胞的兴奋性使动作电位时程缩短,减少钙内流,减轻心肌缺血时的钙超载,保存细胞内ATP,从而发挥心肌保护作用[7-8]。相反在心肌缺血缺氧的情况下,KATP离子通道的持续性开放反而会导致细胞外钾离子积聚,减慢心脏的兴奋性传导,从而诱发严重的室性心律失常,严重者能够引发室颤。
雌激素是一类G18类固醇激素,主要成分为雌二醇,有α和β两种类型。目前研究多数认为雌激素主要可以通过两种途径发挥作用:一是通过激活细胞核受体使转录因子调控相关基因的表达,如抗凋亡基因BCL-2等[9]。一种是通过激活膜受体激活相关的酶和离子通道,调节下游信号通路中的蛋白质转录后的修饰从而产生效应[10]。有研究报道早期雌激素可增加大鼠KATP通道的蛋白表达减轻缺血再灌注损伤[11-12],还可以通过抑制细胞内超氧化物歧化酶活性,提高抗氧自由基能力、抑制炎症因子、减小心肌梗死面积、减少心肌细胞凋亡,减轻大鼠在体心脏缺血再灌注损伤[13]。本试验采用膜片钳技术观察雌激素对KATP离子通道的影响,发现雌激素在膜内向外膜片钳模式中可抑制KATP离子通道活性呈浓度依赖性。结果表明,雌激素也可通过降低KATP通道的活性,使细胞外钾离子积聚减弱,延长动作电位时程,减弱心肌细胞不应期离散度,降低诱发室性心律失常的机率,从而发挥保护心脏的作用。
当机体发生缺血后,机体首先可以通过各种体液调节及自身调节方式来改善心肌细胞的缺血产生的损伤。现今研究认为KATP通道及蛋白激酶C(protein kinase C, PKC)也都通过改善缺血引起的心肌损伤,从而起到保护心肌的作用[14-15]。实验结果表明,当给与心肌细胞PKC激活剂(PDBu)预处理后,雌激素对心肌KATP通道活性的抑制作用明显发生减弱。当细胞内有第二信使存在时(如Ca2+,cAMP等),PKC可以作为一种与膜结合的酶,活化Na+-K+交换系统,提高细胞内K+浓度。因此可推测当心肌细胞发生缺血后,可能由于细胞内PKC活化增强,使得雌激素对心肌细胞的保护作用发生了明显的减弱,从而增强了诱发室性心律失常的机率。
综上所述,本研究通过运用膜片钳技术观察雌激素对心肌细胞KATP离子通道的影响,及与PKC的关系作了初步探讨,揭示了雌激素可通过影响心肌细胞KATP通道活性防止心律失常的产生,但雌激素与PKC蛋白调控抑制的关系还有待进一步研究。
参考文献:
[1] Rias Loza PA, Muehlfelder M, Peizer R. Estrogen and estrogen receptors in cardiovascular oxidative stress [J]. Pflugers Arch, 2013, 465(5):739-746.
[2] Noma A. ATP-regulated K+channels in cardiac muscle [J]. Nature, 1983, 305(5930):147-148.
[3] Noma A. Gating properties of ATP-sensitive K+channels in the heart [J]. Cardiovasc Drugs Ther, 1993, 7 (Suppl 3):515-520.
[4] Findlay I. The ATP sensitive potassium channel of cardiac muscle and action potential shortening during metabolic stress [J]. Cardiovasc Res, 1994, 28(6):760-761.
[5] Parrett JR, Kane KA. KATPchannels in ischaemic preconditioning [J]. Cardiovasc Res, 1994, 28(6):783-787.
[6] Boyan BD, Sylvia VL, Frambach T, et al. Estrogen-dependent rapid activation of protein kinase C in estrogen receptor-positive MCF-7 breast cancer cell and estrogen receptor-negative HCC38 cells is membrane-mediated and inhibited by tamoxifen [J]. Endocrinology, 144(5):1812-1824.
[7] Ashford ML, Sturgess NC, Trout NJ, et al. Adenosine-5‘-triphosphate-sensitive ion channels in neonatal rat cultured central neurones [J]. Pflugers Arch, 1998, 412(3):297-304.
[8] Nichols CG, Ripoll C, Lederer WJ. ATP-sensitive potassium channel modulation of the guinea pig ventricular action potential and contraction [J]. Circ Res, 1991, 68(1):280-287.
[9] Patten RD, Pourati I, Aronovitz MJ, et al. 17beta-estradiol reduces cardiomyocytes apoptosis in vivo and in vitro via activation of phosphor-inositide-3 kinase/Akt signaling [J]. Circ Res, 2004, 95(7):692-699.
[10] Ueda K, Karas RH,. Emerging evidence of the importance of rapid, non-nuclear estrogen receptor signaling in the cardiovascular system [J]. Steroids, 2012, 78(6):589-596.
[11] 霍洪亮, 安尚玉, 钟世刚, 等. 17β-雌二醇对心肌缺氧/复氧NF-κB及ICAM-1和VCAM-1表达的影响 [J]. 高等学校化学学报, 2010, 31(04):746-750.
[12] 张登文, 杨仕杰, 徐琳, 等. 雌激素对大鼠心肌细胞ATP敏感性钾离子通道表达的影响[J]. 医学分子生物学杂志, 2013, 10(4):198-202.
[13] 唐成和,吴芹,李向荣, 等. 雌二醇对大鼠心肌缺血-再灌注损伤的影响[J]. 江苏医药,2010, 36(24):2935-2938.
[14] Sun HY, Wang NP, Kerendi F, et al. Hypoxic postconditioning reduces cardiomyocytes loss by inhibiting ROS generation and intracellular Ca2+overload [J]. Am J Physiol Heart Circ Physiol, 2005, 288(4):1900-1980.
[15] Vinten-Johansen J. Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury [J]. Cardiovase Res, 2004, 61(3):481-497.
