己烯雌酚诱导的氧化应激对青春期大鼠睾丸类固醇合成的影响
2014-08-14李军延乔佩环张林媛
李军延,乔佩环,张林媛,刘 帅,于 淼,常 兵
(中国疾病预防控制中心职业卫生与中毒控制所,北京 100050)
己烯雌酚 (diethylstilbestrol,DES)是1938年合成的非甾体类雌激素,据报道其药效约为17β-雌二醇的10倍[1],曾作为预防流产或早产的药物而被临床广泛使用[2],也作为动物促生长剂应用于畜禽生产中[3],虽然在全球多个国家和地区已被禁止,但是养殖业等非法使用依然存在[4,5],其危害依然不可忽视。
DES具有生殖毒性在人类以及实验动物中已经广泛证实[6,7],外源性雌激素可直接通过影响睾丸基因表达或间接通过下丘脑-垂体-睾丸轴反馈作用,抑制睾酮合成,打破雌/雄激素平衡,干扰信号转导,影响支持细胞增殖、分化及与生殖细胞的相互作用,最终导致雄性生殖器官发育雄性化缺失,支持细胞数量减少、功能受损,以及精子发生异常[8,9]。DES对雄性生殖系统危害包括氧化应激损伤[10,11]和类固醇合成异常导致的睾丸睾酮减少[12-14],但是两者间的关系尚不清楚,我们研究DES对睾丸氧化应激损伤与抑制类固醇合成的关系,并探讨DES对雄性生殖系统损伤的可能的新机制。
1 材料和方法
1.1 实验动物及饲养条件
健康SPF级Wistar大鼠,21日龄,雄性24只,由北京维通利华实验动物技术有限公司提供,生产许可证号SCXK(京)2007-0001。动物饲养于中国疾病预防控制中心动物室,使用许可证号SYXK(京)2009-0032。全价营养颗粒饲料和经反渗透过滤的纯净水由动物自由摄取。
1.2 材料与试剂
己烯雌酚(diethylstilbestrol,DES)Sigma公司生产,黄体生成素(LH)和睾酮(T)检测试剂由北京北方生物技术研究所提供;SOD、CAT、GPx、MDA、ROS、3β-HSD1和17β-HSD3试剂购自南京建成生物工程研究所。Trizol试剂购自Invitrogen公司;逆转录试剂盒购自TaKaRa公司;Real-time PCR试剂盒购自KAPA Biosystem公司;723型分光光度计(天津普瑞斯公司);荧光定量PCR仪Roche LightCycler480(美国罗氏)。
1.3 动物分组及染毒方法
动物经适应性饲养7 d,确认正常后,大鼠按体重随机分为高10.0 μg/kg(6只)、中1.0 μg/kg(6只)、低0.1 μg/kg ( 6只)组和对照(6只)共4组。DES用无水乙醇溶解后震荡混悬于玉米油中,根据大鼠体重确定实际染毒量,对照组仅为玉米油,每日1次连续8周皮下注射染毒。
1.4 体重与脏器重量(系数)检测
实验结束后,称取动物体重,然后麻醉处死动物,全身及内脏观察,取睾丸、附睾、前列腺称重,计算脏器系数:脏器系数=脏器湿重/动物体质量 × 100%。
1.5 血清及睾丸内激素水平测定
股动脉取血5 mL,经过低温离心得到血清;取0.5 g睾丸,加生理盐水制成质量浓度为10%的组织匀浆,离心后得到睾丸匀浆;激素测定使用放射免疫方法,分别测定血清黄体生成素(LH)、睾酮(T)和睾丸匀浆中睾酮(T),按说明书操作。
1.6 睾丸组织抗氧化酶及类固醇合成酶活性测定
睾丸匀浆用于测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、丙二醛(MDA)、活性氧自由基(ROS)、3β羟类固醇脱氢酶1(3β-HSD1)和17β羟类固醇脱氢酶3(17β-HSD3),按说明书操作。
1.7 RT-qPCR检测睾丸组织中类固醇合成酶mRNA表达水平
试验方法参照丁思进等进行[15],引物设计参照Genbank中固醇激素急性调节蛋白(StAR)、P450胆固醇侧链裂解酶(P450scc)、3β羟类固醇脱氢酶1(3β-HSD1)、17β羟类固醇脱氢酶3(17β-HSD3)的mRNA序列,见表1。
1.8 统计学方法
2 结果
2.1 DES暴露后体重、睾丸、附睾、前列腺重量及系数
低剂量组1只动物意外死亡。低剂量组体重与对照组比较未见改变,中和高剂量组体重显著减少(P<0.01),中剂量组体重与对照组比较减少15.0%、高剂量组减少17.0%;中和高剂量组单侧睾丸和前列腺重量显著减少,睾丸重量最大减少40.6%,前列腺最大减少24.9%,低剂量组未见变化;单侧附睾的重量与脏器系数未见变化;见表2。
2.2 DES暴露后 SOD、CAT、GPx活性和MDA,ROS的水平
高剂量组抗氧化酶SOD、CAT和GPx活性显著降低、其中SOD和GPx的活性在中剂量组也显著降低、SOD、CAT和GPx活性降低最大分别为36.5%、28.3%、29.2%,同时SOD和GPx活性呈现剂量效应关系,其他组未见变化;高和中剂量组MDA和ROS水平显著升高,MDA和ROS水平升高最大分别为23.5%和31.0%,其中ROS水平的变化呈现剂量效应关系,其他组未见变化;见表3。
2.3 DES暴露后类固醇合成酶及循环和睾丸内激素水平
高剂量组3β-HSD1活性显著降低(P<0.01),最大下降44.1%,17β-HSD3活性同样显著下降(P<0.05),最大下降27.3%;促黄体生成素(LH)随染毒剂量的增加而降低,中高剂量组显著降低,最大下降30.2%,并且各组间变化呈现剂量效应关系;循环以及睾丸内睾酮随剂量的增加呈现减少,高剂量组循环睾酮显著减少(P<0.01),中和高剂量组睾丸睾酮显著减少(P<0.01);循环睾酮最大减少16.5%,睾丸睾酮最大减少48.6%,DES对睾丸内睾酮减少的作用更明显;低剂量组上述指标均未见变化;见表4。

表1引物序列
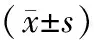
表2 DES暴露后雄性生殖系统的参数
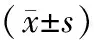
表3 DES暴露后 SOD、CAT、GPx活性和MDA,ROS的水平
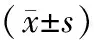
表4 DES暴露后类固醇合成酶及循环和睾丸内激素水平
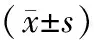
表5 DES暴露后睾丸内StAR, P450scc, 3β-HSD1和17β-HSD3 mRNA的表达水平
2.4 DES暴露后睾丸内StAR, P450scc、3β-HSD1和17β-HSD3 mRNA的相对表达水平
StAR、P450scc、3β-HSD1和17β-HSD3 mRNA水平分别降低,StAR在高剂量组与对照组比较显著减少(P<0.05),最大减少了25.8%,P450scc在中和高剂量组中分别显著性减少(P<0.01、P<0.05),最大减少56.1%。3β-HSD1在中和高剂量组中分别显著减少(P<0.01),最大减少了46.6%。17β-HSD3在高剂量组未出现有统计学意义的改变,仅中剂量组显著减少(P<0.05),最大减少29.5%;见表5。
3 讨论
通过对28日龄大鼠进行8周(包括青春前期,青春期直到性成熟期)不同剂量DES皮下注射染毒,结果显示中和高剂量组体重、睾丸重量、睾丸脏器系数、前列腺脏器系数均减少;除附睾之外,包括睾丸和前列腺的性腺受到影响,出现重量减轻的现象。促性腺激素中促黄体生成素(LH)随染毒剂量的增加而降低,中高剂量组显著降低,并且各组间变化呈现剂量效应关系;循环以及睾丸内睾酮随剂量的增加呈现减少,其中高剂量组循环睾酮显著减少,中和高剂量组睾丸睾酮显著减少;DES可以对睾丸中性腺以及附属性腺直接产生作用,同时对下丘脑-垂体-睾丸轴激素调控产生影响,符合既往DES对雄性生殖毒性的作用特征[12-14]。
研究显示一些化学物质可以扰乱睾丸内部环境,并通过破坏睾丸细胞的氧化/抗氧化平衡机制损伤睾丸功能[16,17]。睾酮的生物合成在睾丸间质细胞,产生睾酮的类固醇合成级联反应本身会产生活性氧ROS[18]。由于过度的ROS水平可以造成睾丸功能的损伤,所以睾丸具备一个有效的抗氧化剂体系,对ROS的损伤进行保护[19]。但是过度的环境毒物暴露已经显示出干扰睾丸的氧化与抗氧化作用的平衡,损伤睾丸功能的作用[16]。DES对雄性生殖系统具有抑制抗氧化酶活性,提高活性氧水平,导致氧化/抗氧化失衡毒性的作用。成熟仓鼠皮下注射1.0 mg/kg 连续染毒1周,发现睾丸SOD、GPx和T-AOC显著降低,MDA水平明显增加[10]。成年雄性大鼠经口染毒2周,睾丸形态出现毒性改变,具有中和ROS作用的硫氧还原蛋白-1受到抑制,导致细胞的氧化还原失常,造成睾丸的毒性损伤[11]。我们的结果显示,染毒8周后高剂量组抗氧化酶SOD、CAT和GPx活性显著降低、其中SOD和GPx的活性在中剂量组也显著降低、同时SOD和GPx活性呈现剂量效应关系;高和中剂量组MDA和ROS水平显著升高,其中ROS水平的变化呈现剂量效应关系。提示DES的生殖毒性与ROS密切相关,DES通过降低抗氧化酶水平,增加ROS含量,干扰间质细胞正常功能,导致睾酮生成减少。
间质细胞合成睾酮通过StAR蛋白把胆固醇转运至线粒体内, P450scc将胆固醇侧链裂解转化为孕烯醇酮,3β-HSD催化孕烯醇酮转化生成孕酮,17β-HSD3使得雄烯二酮最终催化形成具有生物活性的睾酮(T)[20]。在睾丸雄激素生物合成的过程中StAR、P450scc为限速酶,3β-HSD和l7β-HSD3是参与固醇类激素生成以及激素活性和非活性之间互相转化的关键酶,对于维持哺乳动物体内激素之间的平衡、调节激素生成和代谢发挥着重要的作用。我们的结果显示循环以及睾丸内睾酮随剂量的增加呈现减少,其中循环睾酮最大减少16.5%,睾丸睾酮最大减少48.6%。结果表明DES可以减少循环血液和睾丸内睾酮水平,同时对睾丸内睾酮减少的作用更明显。DES在胎儿期、新生儿期以及成熟期啮齿动物暴露中虽然睾酮减少作为毒性作用共同特征之一,但是对类固醇合成酶作用显示差异,导致睾酮减少的机制的不同。胎儿期小鼠暴露DES在妊娠18.5 d,类固醇合成酶系列中StAR的抑制最明显[21];在新生儿期出生4日大鼠DES染毒14天,3β-HSD等表达未发生变化,但是StAR表达显著减少[22]。成熟大鼠DES染毒2周,P450scc表达明显受到抑制,StAR表达未见改变,提示在成年大鼠类固醇合成途径中细胞色素P450scc是DES引起生殖毒性作用的首要靶基因[23]。我们的结果显示StAR、P450scc、3β-HSD1和17β-HSD3的mRNA表达均受到抑制,但是其中P450scc和3β-HSD1最敏感,受抑制程度高,最大降低分别为56 %和47%。类固醇合成酶中3β-HSD1的酶活性同样显示最敏感,最大减少约48.7 %,根据我们的结果可以推断,DES暴露在包括青春前期、青春期在内的整个性成熟前,主要通过抑制P450scc和3β-HSD1干扰类固醇激素合成。另外,有研究显示对4周龄大鼠暴露DES通过3β-HSD介导的类固醇合成抑制,导致睾酮减少[24],该研究结果支持我们现有性成熟前期DES暴露的数据。我们认为在生命周期中DES对类固醇合成途径的作用不同,可以分为胎儿和新生儿期,性成熟前期以及成熟期,当然主要原因与间质细胞分型有关(大鼠约在56 d前后未成熟型分化形成成熟型间质细胞),同时染毒剂量和方式在分期中的意义尚需考量。
我们的结果显示DES对睾丸具有干扰氧化应激/抗氧化平衡作用,同时影响间质细胞正常功能,导致睾酮生成减少。典型内分泌干扰物质显示出增加睾丸活性氧的生产水平并扰乱类固醇合成毒性作用特征。在类固醇激素生物合成途径中各种酶系统被认为是内分泌干扰物重要靶基因[25]。如多氯联苯(Aroclor 1254)在大鼠睾丸间质细胞体外培养中,显示抑制抗氧化酶(SOD、CAT、GPx等)的活性,增加LPO 和ROS水平,同时减少P450scc,3β-HSD和17β-HSDmRNA转录水平[26]。对杀虫剂-林丹(lindane)的体内研究显示,5 mg/kg的林丹染毒30 d,随着氧化应激反应的增强,睾丸类固醇合成酶 3β-HSD和17β-HSD活性降低[27]。林丹单次染毒后StAR蛋白,3β-HSD和17β-HSD活性均出现降低[28]。在15~30 d染毒,林丹可以显著抑制睾丸雄激素的合成,显著减少外周血液中FSH、LH、睾酮的水平和睾丸内睾酮的水平,同时抑制3β- HSD和17β- HSD活性[29]。上述研究结果(从体外培养细胞到整体动物实验)与我们的研究结果同样可以推论内分泌干扰物质(雌激素活性物质)可以通过对睾丸氧化应激的直接作用,干扰睾丸氧化/抗氧化平衡,损伤睾丸间质细胞功能,抑制类固醇合成关键酶系,导致睾酮水平降低。我们的研究首次证实DES对睾丸氧化/抗氧化平衡的作用和睾酮减少为主要特征的雄性生殖毒性两者的联系。
参考文献:
[1] Daston GP, Gooch JW, Breslin WJ, et al. Environmental estrogens and reproductive health: a discussion of the human and environmental data [J]. Reprod Toxicol, 1997, 11(4):465-481.
[2] Newbold RR, McLachlan JA. Transplacental hormonal carcinogenesis: diethylstilbestrol as an example [J]. Prog Clin Biol Res, 1996, 394:131-147.
[3] Lange IG, Daxenberger A, Schiffer B, et al. Sex hormones originating from different livestock production systems: fate and potential disrupting activity in the environment [J]. Analyt Chim Acta, 2002, 473(1):27-37.
[4] 袁超, 李杰, 耿微, 等. 哈尔滨市售动物性食品中兽药残留量检测 [J].中国公共卫生, 2009, 25(6):747-748.
[5] 晓华, 李迎月, 何洁仪, 等. 广州市部分动物源性食品激素及抗生素残留状况分析 [J]. 中国热带医学, 2009, 9(10):2081-2082.
[6] Klip H, Verloop J, van Gool JD, et al. OMEGA Project Group. Hypospadias in sons of women exposed to diethylstilbestrol in utero: a cohort study [J]. Lancet, 2002, 359(9312):1102-1107.
[7] Newbold RR. Prenatal exposure to diethylstilbestrol (DES) [J]. Fertil Steril, 2008,(2 Suppl):e55-e56.
[8] Rivas A, Fisher JS, McKinnell C, et al. Induction of reproductive tract developmental abnormalities in the male rat by lowering androgen production or action in combination with a low dose of diethylstilbestrol: evidence for importance of the androgen-estrogen balance [J]. Endocrinology, 2002, 143(12):4797-4808.
[9] Fielden MR, Halgren RG, Fong CJ,etal. Gestational and lactational exposure of male mice to diethylstilbestrol causes long-term effects on the testis, sperm fertilizing ability in vitro, and testicular gene expression [J]. Endocrinology, 2002, 143(8):3044-3059.
[10] Ma A, Yang X, Wang Z, et al. Adult exposure to diethylstilbestrol induces spermatogenic cell apoptosis in vivo through increased oxidative stress in male hamster [J]. Reprod Toxicol, 2008, 25(3):367-373.
[11] Li Y, Okumura K, Nomura S, et al. Oxidatively damaged proteins in the early stage of testicular toxicities in male rats by orally administered with a synthetic oestrogen, diethylstilbestrol [J]. Reprod Toxicol, 2011, 31(1):26-34.
[12] Haavisto T, Nurmela K, Pohjanvirta R, et al. Prenatal testosterone and luteinizing hormone levels in male rats exposed during pregnancy to 2,3,7,8-tetrachlorodibenzo-p-dioxin and diethylstilbestrol [J]. Mol Cell Endocrinol, 2001, 178(1-2):169-179.
[13] Sharpe RM. The ‘oestrogen hypothesis′- where do we stand now? [J]. Int J Androl, 2003, 26(1):2-15.
[14] van den Driesche S, Walker M, McKinnell C, et al. Proposed role for COUP-TFII in regulating fetal Leydig cell steroidogenesis, perturbation of which leads to masculinization disorders in rodents [J]. PLoS One, 2012, 7(5):e37064.
[15] 丁思进, 乔佩环, 张林媛, 等. 17β-雌二醇通过HPGA和ERα干扰睾酮合成调控精子发生 [J]. 卫生研究, 2013, 42(3):410-414.
[16] Saradha B, Mathur PP. Effect of environmental contaminants on male reproduction [J]. Environ Toxicol Pharmacol, 2006, 21:34-41.
[17] Mathur PP, Saradha B, Vaithinathan S. Impact of environmental toxicants on testicular function [J]. Immun Endoc Metab Agents Med Chem, 2008, 8:79-90.
[18] Hanukoglu I. Antioxidant protective mechanisms against reactive oxygen species (ROS) generated by mitochondrial P450 systems in steroidogenic cells [J]. Drug Metab Rev, 2006, 38:171-196.
[19] Aitken RJ, Roman SD. Antioxidant systems and oxidative stress in the testes [J]. Oxid Med Cell Longev, 2008, 1:15-24.
[20] Payne AH, Hales DB. Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones [J]. Endocr Rev, 2004, 25(6):947-970.
[21] Guyot R, Odet F, Leduque P, et al. Diethylstilbestrol inhibits the expression of the steroidogenic acute regulatory protein in mouse fetal testis [J]. Mol Cell Endocrinol, 2004, 220(1-2):67-75.
[22] Mikkilä TF, Toppari J, Paranko J. Effects of neonatal exposure to 4-tert-octylphenol, diethylstilbestrol, and flutamide on steroidogenesis in infantile rat testis [J]. Toxicol Sci, 2006, 91(2):456-466.
[23] Maeda N, Okumura K, Tanaka E,et al. Downregulation of cytochrome P450scc as an initial adverse effect of adult exposure to diethylstilbestrol on testicular steroidogenesis [J]. Environ Toxicol, 2013,6:20.
[24] Kim HH, Kwak DH, Yon JM, et al. Differential expression of 3beta-hydroxysteroid dehydrogenase mRNA in rat testes exposed to endocrine disruptors [J]. J Reprod Dev, 2007, 53(3):465-471.
[25] Mathur PP, D'Cruz SC. The effect of environmental contaminants on testicular function [J]. Asian J Androl, 2011, 13(4):585-591.
[26] Murugesan P, Muthusamy T, Balasubramanian K, et al. Polychlorinated biphenyl (Aroclor 1254) inhibits testosterone biosynthesis and antioxidant enzymes in cultured rat Leydig cells [J]. Reprod Toxicol, 2008, 25:447-454.
[27] Sujatha R, Chitra KC, Latchoumycandane C, et al. Effect of lindane on testicular antioxidant system and steroidogenic enzymes in adult rats [J]. Asian J Androl, 2001, 3:135-138.
[28] Saradha B, Vaithinathan S, Mathur PP. Single exposure to low dose of lindane causes transient decrease in testicular steroidogenesis in adult male Wistar rats [J]. Toxicology, 2008, 244:190-197.
[29] Singh SK, Pandey RS. Effect of sub-chronic endosulfan exposures on plasma gonadotrophins, testosterone, testicular testosterone and enzymes of androgen biosynthesis in rat [J]. Indian J Exp Biol, 1990, 28:953-956.
