乙酸联合束缚应激对大鼠内脏敏感性及肠道肥大细胞状态的影响
2014-08-14庄肇朦王霄腾
庄肇朦,王霄腾, 吕 宾
(浙江中医药大学附属第一医院消化科,杭州 310000)
肠易激综合征(irritable bowel syndrome,IBS)是一种以肠道局部症状为突出表现的全身性疾病,其发病率正在逐年上升[1]。前期实验研究表明:IBS患者及模型大鼠肠道均存在肥大细胞数量增多,细胞脱颗粒增强的现象。近年来有研究发现[2]:大鼠乙酸灌肠后第7 天肠黏膜组织学和髓过氧化物酶活性恢复正常, 但大鼠对直肠扩张刺激的敏感性持续增高。 同时早有相关研究发现[3]:慢性束缚应激可以引起大鼠排便的明显增多, 内脏敏感性增高。这些表现均与IBS的特征吻合。目前建立IBS动物模型的刺激方法主要有三种类型:躯体应激、心理应激和综合应激。躯体应激的方法包括醋酸刺激法、冰水灌胃法等;心理应激的方法包括束缚应激法、母婴分离法等。鉴于IBS病因、病机的复杂性及多重性,建立多成分综合性动物模型更符合IBS的实际情况[4]。因而本实验分别模拟心理因素和躯体因素两种病因,以乙酸联合束缚应激这种方法,通过与单纯的束缚应激比较,试图建立综合因素所致的IBS模型。
1 材料和方法
1.1 实验动物及实验环境
成年雄性SD大鼠30只,体质量(200±5)g,上海西普尔-必凯实验动物有限公司生产,许可证号:SCXK(沪)2013-0016;实验动物使用许可证号:SYXK(浙)2013-0184。
1.2 仪器与试剂
8F导尿管(直径2 mm, 球囊最大容量3 mL, 最大直径2 cm),用作结直肠内球囊扩张导管(浙江康康医疗器械有限公司生产);冰乙酸。
1.3 动物实验
1.3.1 分组: 整个实验操作过程均饲养于标准的Ⅱ级动物房。适应性饲养1 周后随机分为3组:IBS组:模型组1:乙酸灌肠+束缚应激组,模型组2:束缚应激+生理盐水灌肠组;正常对照组。
1.3.2 大鼠模型制备: IBS组:实验前24 h禁食不禁水,乙醚麻醉后经肛门插入连接注射器的硅胶管(距肛门8 cm),结肠内灌入40 mL/L的乙酸1 mL, 缓慢拔出硅胶管, 用手压迫肛门并将大鼠尾巴抬高30 s,后用0.01 mol/L PBS 1 mL冲洗结肠,放回笼中自由活动进食水[2];模型组2则用生理盐水代替乙酸进行灌肠处理。于第7天行束缚应激,按照Williams方法略作修改[5]将大鼠置于一限制起肢体但不影响其呼吸的特制透明圆柱形筒内, 3 h后将大鼠放入饲养笼中,连续束缚3 d。正常对照组:不做处理。
1.3.3 大鼠粪便颗粒及形态实验:实验第7天,将每只大鼠分别放在大鼠固定器内,限制其活动(不限制呼吸)约2 h,期间大鼠的粪便分为硬便、软便、不成形便,分别计数。
1.3.4 大鼠结直肠扩张:实验第 10天禁食24 h,禁水12 h。两组大鼠分别于清醒状态下放入自制的固定器,使大鼠只能上下运动,无法前后活动及转身,将 8F 导尿管经肛门缓慢插入,气囊末端距肛门约2 cm并固定。30 min后大鼠适应,经外口气囊内先后注入气体,按腹壁撤回反射(abdominal withdrawal reflex, AWR)试验标准评分,分别记录评分达到伤害阈值2分时(大鼠腹背部肌肉轻微收缩但腹部未抬离地面)和4分(大鼠腹部肌肉强烈收缩,背部呈弓形并把腹部、会阴部抬离地面)时球囊所注入的气体量,每4 min一次,每次约30 s,每只重复3次,取平均值。
1.3.5 结肠标本的采集及HE 染色、回盲部肠道标本盐酸甲苯胺蓝染色:实验第2天,随机取各组大鼠各3只,3%巴比妥钠(40 mg/kg)麻醉后取大鼠结肠(距肛门约 6 cm)1 cm 肠段。实验第10天,取所有大鼠结肠(距肛门约 6 cm)1 cm肠段,行HE染色;取回盲部肠段1 cm,盐酸甲苯胺蓝染色。
1.3.6 统计方法及分析:以SPSS 19.0统计软件进行统计分析。各组间 AWR 评分比较,排便计数的比较以及肠道粘膜肥大细胞数量比较均采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 粪便结果
如表1 所示结果分析:于造模第7天行束缚应激刺激后,可见模型组大鼠在排便数量上大于对照组,有统计学意义(P<0.05)。且模型组1软便及稀便数量明显较模型组2和对照组增多。此项结果显示,模型组在乙酸灌肠联合束缚应激后排便次数明显增多,排便性状改变,符合 IBS 特征。
2.2 结直肠球囊扩张(colorectal distension, CRD) 结果——腹部回撤反应
腹壁撤回反射(abdominal withdrawal reflex, AWR)评分结果如表2所示:第10天时,直肠扩张达到伤害感受阈值AWR=2分时,模型组1直肠扩张容量平均为1.2 mL,模型组2平均为1.37 mL,而对照组平均为1.49 mL,两两之间有统计学意义(P<0.05);当直肠扩张达到AWR=4分时,模型组1直肠扩张容量平均为1.49 mL,模型组2平均为1,74Ml,而对照组平均为1.77 mL,模型组1与后两者之间有统计学意义(P<0.05),说明模型组大鼠内脏敏感性较对照组增高。
2.3 结肠外观变化及 HE 结果
乙酸灌肠后第1天,肉眼观察,模型组大鼠结肠外观管壁增厚,伴充血及出血,光学显微镜下观察,与对照组(图3 A)相比,模型组乙酸刺激后(图 3B)可见粘膜层、粘膜下层水肿明显,出现片状出血点。
而待到实验第10天,完成CRD测评后,取材后肉眼观察发现,两组肠粘膜外观无充血、水肿、出血;光学显微镜下观察发现,对照组(图 3C)、模型组1(图 3 C)两组大鼠结肠粘膜结构均较为完整,隐窝、上皮及各层组织均较为完整,未见溃疡等组织病理学改变,因此可排除炎症性肠病等疾病可能(图3见封三)。
2.4 甲苯胺蓝染色结果
光学显微镜下示肥大细胞(MC)细胞质呈紫红色,胞核呈蓝色,散在于粘膜下层和粘膜固有层中。电镜下可见其中未脱颗粒者胞膜完整,胞质均匀(图 4C),脱颗粒者胞膜破裂,有颗粒涌出,细胞不规则(图 4 D、4E、4F)。经SPSS软件统计后(表3)模型组1大鼠结肠 MC数目较模型组2及对照组明显增多(P<0.05)。(图4见封三)。

表1 两组大鼠排便情况差异
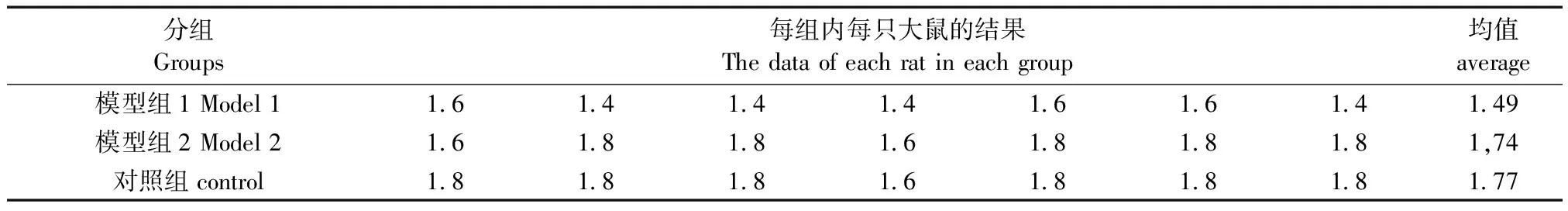
表2 当AWR=4分时两组结直肠球囊扩张容量差异(单位mL)

表3 两组大鼠结肠MC数目比较差异
3 讨论
肠易激综合征(irritable bowel syndrome,IBS)是世界范围内的多发病。其中欧美国家人发病率达10%~20%[6],亚洲国家的发病率达6.5%~10.1%,且近年发病率有逐渐升高的趋势[1]。由于其病因和发病机制不明确,临床上缺乏有效的诊治手段,导致IBS患者的症状长期存在,严重影响其工作和生活,因此,IBS不仅是一个临床问题,更是值得关注的社会问题。因而对IBS病因及发病机制的研究日渐得到各方研究者的关注,而其中关于IBS动物模型的建立,由于IBS病因及发病机制的复杂性,患者症状的多样化,导致动物模型研制的困难。因而,作为进行深入研究的对象和基础,IBS动物模型的建立方法以及模型有效性的评估仍是诸多研究者所关注的。
近年来已出现了可模拟IBS某些病理生理学特征的动物模型,并获得部分成功。目前较多的都是根据体外单因素建立的符合IBS某一方面的病理生理机制的动物模型,如通过刺激肠道建立的内脏痛觉过敏模型,通过化学物质刺激或病原体感染肠道造成的内脏痛模型,通过应激刺激造成的动物胃肠动力紊乱等,以及涉及转基因或基因沉默、基因敲除而制得的动物模型。
现有的IBS动物模型主要分为两大类,一类是以中枢为靶点的刺激;二是以外周为靶点的刺激造成的IBs动物模型[7]。
以中枢为靶点刺激造成的IBS动物模型:主要模拟了精神心理因素在IBS中的作用。流行病学相关研究发现[8],急慢性应激是诱发和加重IBS患者症状的重要因素之一,其作用机制是应激可以通过促进促肾上腺皮质激素释放因子CRF释放,以及肥大细胞的聚集活化等进而导致胃肠功能紊乱[9]。多项研究表明:束缚应激可导致大鼠对直肠球囊扩张的敏感性增加,应激后大鼠排便量增加,其所导致的胃肠道动力及内脏感觉的改变与IBS的特征相符[10-11]。虽然这类动物模型模拟了人类的IBS的重要病因之一即精神心理因素,与人类IBS有一定的相似性[12],但临床上精神创伤并不是导致IBS的单一以及直接原因,只是诱发或加重IBS症状的重要因素之一,因而仅可将其作为IBS动物模造模的单一因素。
以外周为靶点刺激造成的IBS动物模型: 其特征是黏膜炎症反应消失后异常的肠道感觉及运动功能仍持续存在。研究较多的是病原体感染和化学刺激物诱导制成的IBS动物模型[13]。其中病原体感染所致模型与临床上感染后IBS较为符合,急性胃肠炎患者在早期症状缓解后出现类似IBS 的肠功能紊乱症状,现有研究表明早期胃肠道感染持续时间和严重程度、致病微生物因素、精神因素、基因多态性等均会影响 PI-IBS 的发病[14],然而大多数PI-IBS的临床病例为细菌、病毒等感染而非仅仅由寄生虫感染后诱发,故而此模型与PI-IBS的病因学特征不完全相符。化学刺激所造成的IBS模型则可直观地模拟临床上因食物刺激以及病原体急性感染后所致的急性肠黏膜炎症反应。新近研究发现[1]:大鼠乙酸灌肠后第7 d肠黏膜组织学和髓过氧化物酶活性恢复正常, 但大鼠对直肠扩张刺激的敏感性持续增高。
Arebi等[15]发现IBS发病为多种因素相互作用所致。鉴于IBS病因的复杂性、病机的多重性,因此,建立多成分综合性动物模型更符合IBS的实际情况。
相关研究已证实肥大细胞(MC)与IBS发病直接相关[16-17],结肠MC浸润和介质释放是IBS患者产生症状的原因,亦与IBS患者内脏高敏感密切相关[18]。MC活化后释放组胺、5-羟色胺、纤维蛋白溶酶等介质,激活包括胃肠道在内的感觉神经元,导致痛觉增敏或异常疼痛。因而肠道粘膜肥大细胞数量的增多、活化脱颗粒是IBS的特征之一。
本实验通过乙酸联合慢性束缚应激对SD大鼠进行造模刺激,与单纯的束缚应激进行比较,通过观察粪便情况、内脏敏感性的观察,来评估此综合造模方法的有效性;并且通过对肥大细胞的数量及脱颗粒情况的观察,发现该综合造模方法可对IBS模型动物肠道免疫应答起到激活作用。
4 结论
乙酸联合束缚应激可增加大鼠内脏敏感性,并且使大鼠肠道肥大细胞数量增多,细胞脱颗粒现象增强。该综合造模方法能够较好的模拟人类IBS的发病形式,为我们进一步研究IBS的发生发展机制提供了理想的动物模型基础。
参考文献:
[1] Chang FY, Lu CL, Chen TS. The current prevalence of irritable bowel syndrome in Asia [J]. Neurogastroenterol Motil, 2010, 16(4): 389-400.
[2] La JH, Kim TW, Sung TS, et al. Visceral hypersensitivity and altered colonic motility after subsidence of inflammation in a rat model of colitis [J]. World J Gastroenterol 2003, 9(19): 2791-2795.
[3] 孙艳, 柳锋霖,侯晓华, 等.急性和慢性束缚应激对大鼠内脏敏感性和神经内分泌的影响 [J].中华消化杂志, 2006, 26(1): 38-41.
[4] 安钰, 白殿卿, 付健, 等. 乙酸灌肠加束缚应激致大鼠肠易激综合征模型的建立及其评价 [J]. 世界华人消化杂志, 2009, 17(15): 1548-1551.
[5] Williams CL, Villar RG, Peterson JM, et al. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome [J]. Gastroenterology, 1988, 94: 611-621.
[6] Krogsgaard LR, Engsbro AL, Bytzer P. The epidemiology of irritable bowel syndrome in Denmark. A population-based survey in adults≤50 years of age [J]. Scand J Gastroenterol, 2013, 48(5): 523-529.
[7] Thomas GM, Huganir RL. MAPK cascade signaling and synaptic plasticity [J]. Nat Rev Neurosci, 2004, 5: 173-183.
[8] Kerckhoffs APM, ter Linde JJM, Akkermans LMA, et al. Trypsinogen IV, serotonin transporter transcript levels and serotonin content are increased in small intestine of irritable bowel syndrome patients [J]. Neurogastroenterol Motil, 2008;20:900-907.
[9] Reber SO, Peters S, Slattery DA, et al. Mucosal immunosuppression and epithelial barrier defects are key events in murine psychosocial stress-induced colitis[J]. Brain Behav Immun, 2011, 25: 1153-1161.
[10] Bradesi S, Eutamene H, Garcia-Villar R, et al. Acute and chronic stress differently affect visceral sensitivity to rectal distension in female rats [J]. Neurogastroenterol Motil, 2002, 14, 75-82.
[11] 吕红, 王伟岸, 钱家鸣. 传统束缚应激动物模型内脏感觉的新评价 [J].胃肠病学和肝病学杂志, 2005, 14:111-113.
[12] Lackner JM, Brasel AM, Quigley BM, et al. The ties that bind: perceived social support, stress, and IBS in severely affected patients [J]. Neurogastroenterol Motil, 2010, 22: 893-900.
[13] Collins SM, McHugh K, Jacobson K, et al. Previous inflammation alters the response of the rat colon to stress [J]. Gastroenterology, 1996, 111: 1509-1515.
[14] Bashashati M, Rezaei N, Bashashati H, et al. Cytokine gene polymorphisms are associated with irritable bowel syndrome: a systematic review and meta-analysis [J]. Neurogastroenterol Motil, 2012, 24(12): 1102-e566.
[15] Arebi N, Gurmany S, Bullas D, et al. Review article: the psychoneuroimmunology of irritable bowel syndrome—an exploration of interactions between psychological, neurological and immunological observations [J]. Aliment Pharmacol Ther, 2008, 28: 830-840.
[16] Ohman L, Simrén M. Pathogenesis of IBS: role of inflammation, immunity and neuroimmune interactions [J]. Nat Rev Gastroenterol Hepatol, 2010, 7(3):163-173.
[17] Vivinus-Nébot M, Dainese R, Anty R, et al. Combination of allergic factors can worsen diarrheic irritable bowel syndrome: role of barrier defects and mast cells [J]. Am J Gastroenterol, 2012, 107:75-81.
[18] Levy D, Kainz V, Burstein R, et al. Mast cell degranulation distinctly activates trigeminocervical and lumbosacral pain pathways and elicits widespread tactile pain hypersensitivity [J]. Brain Behav Immun, 2012, 26: 311-317.
