雌性小鼠骨髓移植给雄性小鼠后内源性骨髓细胞残存状态的研究*
2014-08-13王梦雨刘国庆
张 玲, 王梦雨, 黄 薇, 刘国庆
(北京大学医学部心血管研究所,北京 100191)
冠心病(coronary heart disease, CHD)是严重危胁人类生命和健康的重要疾病。流行病学研究显示男性较女性的冠心病发病率高,发生时间早。女性在绝经前发病率较低,绝经后迅速增加,几乎达到绝经前的4倍[1]。随着对冠心病的不断研究,人们发现随着年龄增长女性患者的数量逐年增加,尤其女性绝经后其患病率及病死率与同年龄的男性患者接近一致[2]。而有实验研究也表明,在动脉硬化、高血压、脑出血等心脑血管系统疾病等动物模型中,雄性较雌性的发生率更高[3]。但由于雄性动物较雌性对辐射更为敏感,对照射剂量的耐受比较差[2],所以一直以来骨髓移植的方法中大多用雄性作为供体雌性作为受体,以雌性受体外周血中是否检测到Y染色体来作为骨髓移植是否成功的判断标准[4]。然而,雌性作为受体不仅要受到性周期的影响,而且内源性巨噬细胞的残存情况不清楚[5],无法显示自身残存的巨噬细胞与外源性转入的巨噬细胞的比例,从而无法准确判断机体相应指标变化是否源于被转入的外源性巨噬细胞[6]。将雌性小鼠骨髓成功转移到雄性小鼠体内可以有效解决上述难题,可以准确地反映对巨噬细胞来源的生物活性物质对机体脂代谢的影响,并将其量化。这对心血管系统疾病在易感和高发人群中的研究奠定了良好的基础,提供了新的研究平台。
材 料 和 方 法
1 动物
C57BL/6小鼠,6~8周龄的SPF级雄性及雌性小鼠作为骨髓移植受体。同种系同年龄不同性别的小鼠作为骨髓移植供体,以上动物均由北京大学医学部动物实验中心提供。
2 方法
2.1分组及骨髓移植 (1)实验分组:根据照射强度分为900rad 、 950 rad及1 000 rad 3组,每个照射强度均分为实验组(放射性照射后进行骨髓移植组)和对照组(仅放射性照射不进行骨髓移植),其中实验组又分为雄性小鼠转雌性小鼠组及雌性小鼠转雄性小鼠组。(2)实验准备:移植实验前7 d至移植实验后7 d,受体小鼠均饮用加有新霉素(100 mg/L)和多黏菌素B(10 mg/L)的灭菌蒸馏水(pH 5.2)[7-8]。断颈处死供体小鼠,无菌条件下采集供体小鼠股骨及小腿骨。将股骨两端软骨剪去,露出红色的骨髓腔。用1 mL无菌注射器吸取含2%小牛血清及肝素的RPMI-1640液,轻轻插入骨髓腔,反复冲出骨髓腔内的骨髓,用ACK缓冲液溶解红细胞,用含2%胎牛血清的RPMⅠ-1640洗涤2次,计数并用不含血清的RPMI-1640调整细胞浓度为3×1010/L备用[9]。将雄性或雌性受体小鼠采用[137Cs]全身照射,[137Cs]放射源(Gama Cell 1000)由北京大学医学部免疫学系提供。照射后6 h将同性别小鼠分为2组,骨髓移植实验组经C57BL/6小鼠尾静脉每只注射1×107供体小鼠骨髓细胞,对照组不给予骨髓移植(n=9)。骨髓移植实验组根据骨髓移植后14 d 的存活率及体内 Y 染色体基因水平的下降评估骨髓移植实验的成功率,根据外周血白细胞数量变化评估骨髓移植的骨髓重建情况,根据受体小鼠雄性Y染色体的残余量作为移植质控指标。对照组14 d 内全部死亡说明骨髓移植照射成功[10]。
2.2外周血白细胞数量测定 从骨髓移植实验第7天起,每天眼眶取血10 μL,进行实验组及正常阳性对照组小鼠外周血镜下白细胞计数[10]。
2.3Y染色体含量检测 取小鼠血浆,按照血液DNA提取试剂盒说明操作提取血液中的基因组DNA,测DNA浓度后,-20 ℃保存备用。利用实时定量PCR检测Y染色体含量,小鼠Y染色体基因序列设计,上游引物5′- TCGGAGGGCTAAAGTGTC-3′,下游引物5′-CCAGTCTTGCCTGTATGTGAT-3′。在0.5 mL的EP管中加入双蒸水、引物、25 mmol/L MgCl2、2 mmol/L dNTP、10×buffer、DNA和Taq酶/SYBR,总体积为20 μL[11-12]。PCR条件:94 ℃ 5 min,94 ℃ 40 min,56 ℃ 45 min,72 ℃ 1 min,32个循环。血液DNA提取试剂盒由安徽优晶生物工程有限公司提供,Taq酶和dNTP以及marker购自GeneStar,SYBR购自Transgene。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0软件分析,死亡率两组间比较采用2检验,其它用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 骨髓移植后受体小鼠存活率
图1显示,1 000 rad照射后未进行骨髓移植的对照组14 d内全部死亡,表明照射剂量达到致死量,符合实验要求。经骨髓移植后雄性转雌性组30 d存活率为100%,雌性转雄性组30 d存活率仅为48%,明显低于雄性转雌性组,说明1 000 rad照射剂量仅适用于雄转雌的骨髓移植实验,并不适用于雌转雄的骨髓移植实验。

Figure 1. Survival rates of recipient mice treated with 1 000 rad irradiation and bone marrow transplantation (BMT) from male to female mice or from female to male mice. n=9.
图2显示,雌性小鼠做供体骨髓移植到雄性小鼠体内,在不同剂量照射下存活情况有所不同。950 rad和900 rad照射剂量后生存率都优于1 000 rad照射剂量,其中900 rad剂量组骨髓移植后存活率最提高可达到100%,为最佳雌转雄照射剂量,与图1显示的在1 000 rad剂量下雄性骨髓移植给雌性的生存率相当。

Figure 2. Survival rates of recipient mice treated with different doses of radiation and bone marrow transplantation (BMT) from female mice to male mice or from female to male mice. n=9.
2 骨髓移植后受体雄性小鼠Y染色体基因水平检测
骨髓移植后,随时间进展,Y染色体基因表达逐渐减少,说明受体雄性小鼠的骨髓逐渐被破坏,根据不同照射剂量其骨髓细胞被替代的程度和时间都不尽相同。在950 rad照射剂量下雌性骨髓移植给雄性小鼠后,雄性小鼠血液中的Y染色体含量逐渐下降,至4周时完全被替代,见图3A。900 rad剂量照射下雌性骨髓移植给雄性小鼠后,雄性小鼠血液中的Y染色体含量逐渐下降,至5周时完全被替代,见图4A。实时定量PCR结果显示不同剂量照射下骨髓移植后受体小鼠骨髓被替代的具体百分比表明,950 rad剂量照射下受体原有骨髓细胞2周内下降到25%,4周内被供体骨髓完全替代,见图3B。900 rad照射剂量下受体原有骨髓细胞2周内下降到60%,4周时尚有12.5%的残留,5周时可被供体骨髓完全替代,见图4B。900 rad条件下受体小鼠骨髓被完全替代的时间比950 rad剂量照射的结果延迟1周。
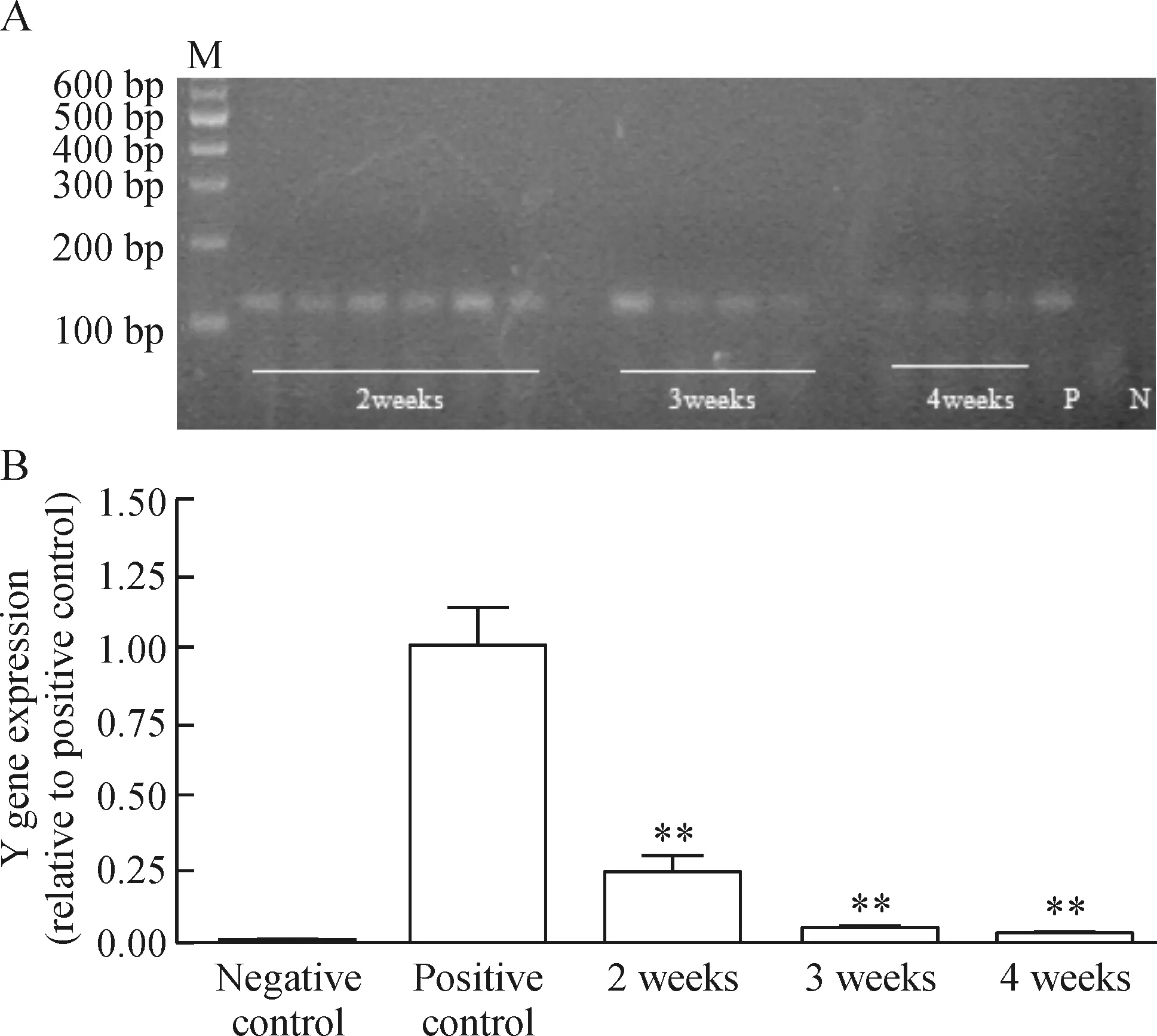
Figure 3. Y gene level of mice at different time points detected by PCR (A) and real-time PCR (B) after treatment with 950 rad irradiation and bone marrow transplantation. M: marker; P: positive control; N: negative control. Mean±SD. n=9. **P<0.01 vs positive control.
3 雌性骨髓移植后雄性小鼠外周血白细胞计数的变化
与正常对照组小鼠比,移植后1周,骨髓移植组外周血白细胞数明显下降,仅6.0×107/L,第10天开始增加,第13天恢复到正常水平的80%,2周后稳定在正常小鼠水平(5.0×109/L),表明骨髓移植后2周雄性小鼠骨髓造血系统和免疫系统恢复正常,见图5。
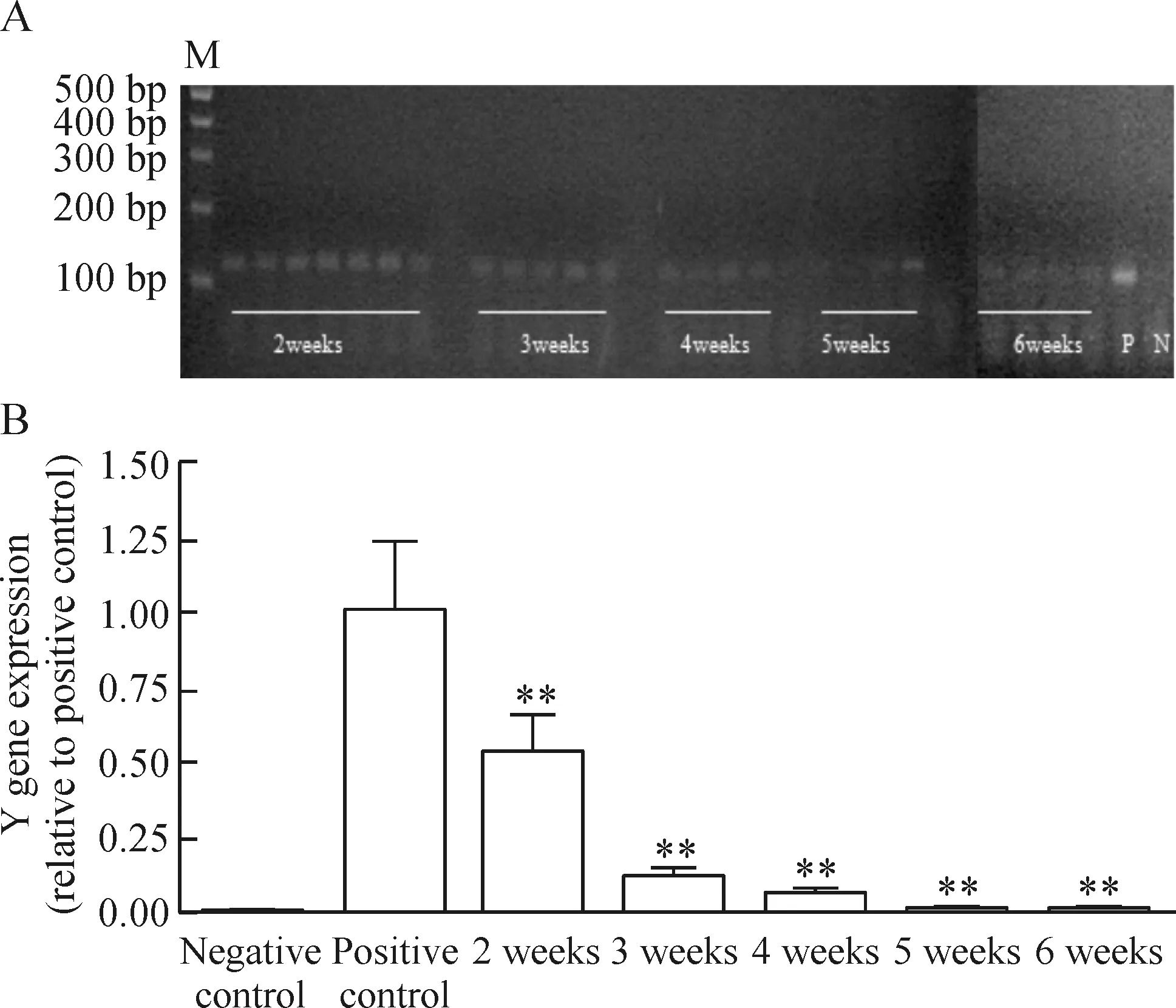
Figure 4. Y gene level of mice at different time points detected by PCR (A) and real-time PCR (B) after treatment with 900 rad irradiation and bone marrow transplantation. M: marker; P:positive control; N: negative control.Mean±SD.n=9. *P<0.05,**P<0.01 vs positive control.
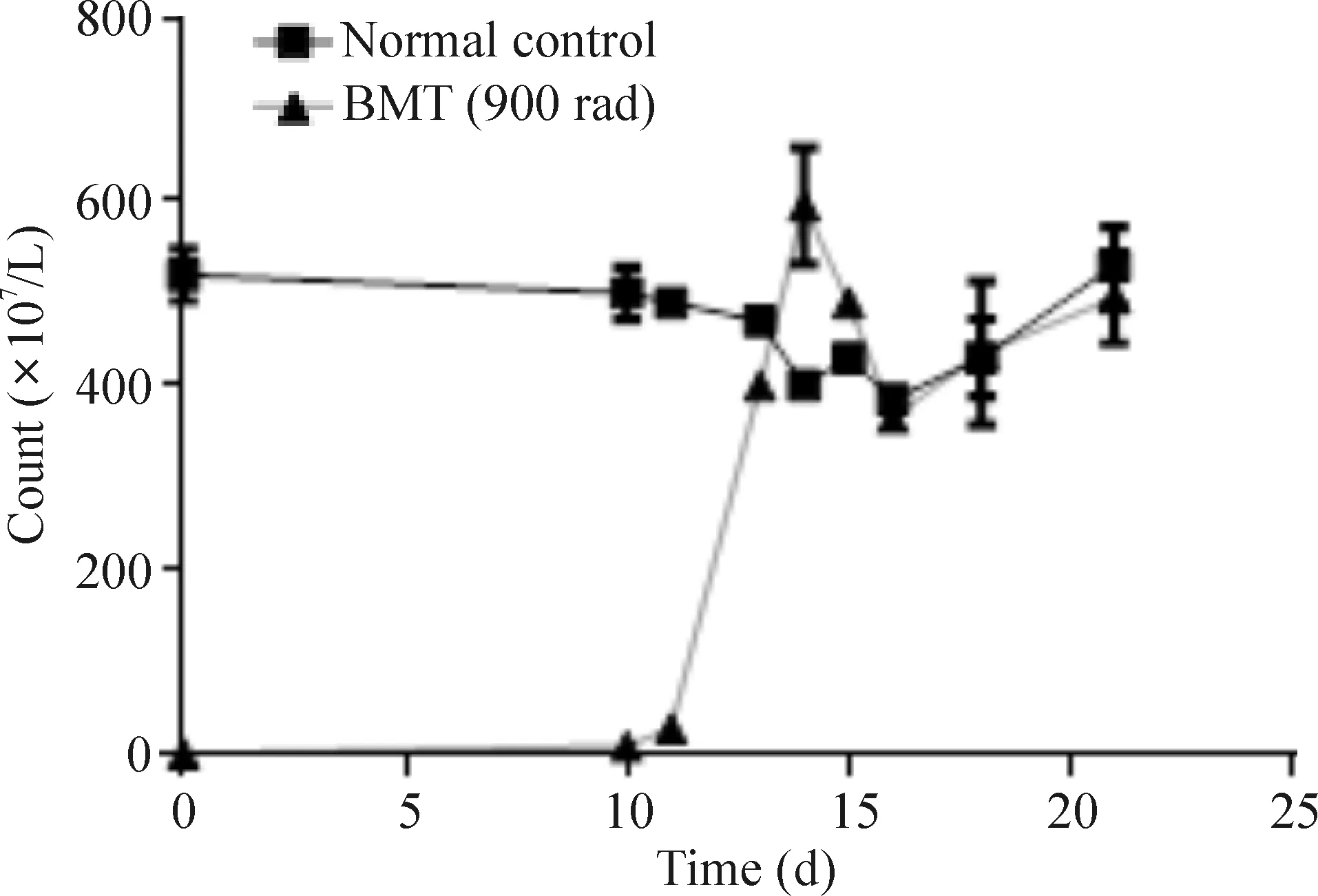
Figure 5. The peripheral blood leukocyte count at different time points after bone marrow transplantation (BMT) from female to male mice. Mean±SD. n=9.
讨 论
按照本文所述实验条件,在[137Cs]照射剂量为900 rad时,能成功地将雌性小鼠骨髓转至雄性小鼠体内,受体骨髓能完全被外源性骨髓代替,同时受体存活率为100%[13]。因此,900 rad剂量照射后,既可以保证受体小鼠的生存率又可以在一定时间内有效地将原有内源性基因完全替代达到实验效果,可以作为雌转雄骨髓移植的最佳条件。不同剂量照射下经骨髓移植的小鼠体内内源性基因在2~3周时明显被外源性基因所代替,4~5周时被完全替代并发挥造血功能。因此用950 rad剂量照射后进行的骨髓移植实验其相关功能指标的测定应在第5周开始,而用900 rad剂量照射后则在骨髓移植后第4周尚有较多的残留,相关指标的测定需要推迟到第6~8周再进行检测[14-15]。这就为我们进行不同周期的实验提供了可靠的数据。实验结果提示骨髓移植后需要高脂饮食8周采集数据的实验适用于900 rad照射剂量,而需要采集骨髓移植后4周数据的实验则适用于950 rad照射剂量,不能用存活率高的900 rad照射剂量,否则会由于原受体骨髓细胞的残留而影响数据的准确性和对结果的分析[16-17]。
骨髓移植后,小鼠迅速恢复了造血功能,10 d后外周血白细胞计数开始逐步增加,13 d后外周血白细胞计数基本恢复正常。相应免疫指标的测定可根据此数据在合适的时点进行。
综上所述,本研究创建了小鼠雌转雄骨髓移植的实验方法,可在不受雌性激素水平的影响下研究从巨噬细胞来源的目的基因在心血管疾病中的作用,并为此类研究提供了一个很好的动物模型。为研究巨噬细胞特异性基因对心血管疾病的影响奠定了实验基础。
[参 考 文 献]
[1] 吴艳梅. 冠心病传统心血管病危险因素的评价[J].宁夏医学杂志, 2012,34(5): 443-446.
[2] 谢 漪,党秉荣,邴 涛,等. 不同剂量率X射线辐照对小鼠免疫系统的影响[J].航天医学与医学工程, 2006, 19(5): 333-336.
[3] 杨 红. 女性雄激素与绝经后女性冠状动脉粥样硬化性心脏病相关研究进展[J]. 心血管学进展, 2012,33(1):63-65.
[4] Linton MF, Atkinson JB, Fazio S. Prevention of atherosclerosis in apolipoprotein E-deficient mice by bone marrow transplantation [J]. Science, 1995, 267(5200): 1034-1037.
[5] Linton MF, Fazio S. Macrophages, lipoprotein metabolism, and atherosclerosis: insights from murine bone marrow transplantation studies [J].Curr Opin Lipidol, 1999, 10(2): 97-105.
[6] Babaev VR, Fazio S, Gleaves LA, et al. Macrophage lipoprotein lipase promotes foam cell formation and atherosclerosisinvivo[J]. J Clin Invest, 1999,103(12):1697-1705.
[7] Babaev VR, Patel MB, Semenkovich CF, et al. Macrophage lipoprotein lipase promotes foam cell formation and atherosclerosis in low density lipoprotein receptor-deficient mice[J]. J Biol Chem,2000,275(34):26293-26299.
[8] Ding Y, Zhang L, Wang Y, et al. Amelioration of hypertriglyceridemia with hypo-alpha-cholesterolemia in LPL deficient mice by hematopoietic cell-derived LPL[J]. PLoS One, 2011,6(9):e25620.
[9] 张爱宏,刘国庆.放射性同位素标记法检测脂蛋白脂肪酶活性及其应用[J].中国动脉硬化杂志,2003,11(6):573-576.
[10] 张 玲, 冼勋德, 丁银元,等. 应用骨髓移植研究巨噬细胞脂蛋白脂酶对严重高甘油三酯血症小鼠脂代谢的作用[J]. 中国动脉硬化杂志,2009,17(11):917-920.
[11] Hussain MM, Innerarity TL, Brecht WJ, et al. Chylomicron metabolism in normal, cholesterol-fed, and Watanabe heritable hyperlipidemic rabbits. Saturation of the sequestration step of the remnant clearance pathway [J]. J Biol Chem,1995,270(15):8578-8587.
[12] 王亚楠, 洗勋德, 张晓红,等.遗传性混合型高脂血症小鼠的自发性动脉硬化研究[J].中国动脉硬化杂志, 2006,14(9):775-777.
[13] Otsuka K,Sakai K. Effects of low dose-rate long-term gamma-ray irradiation on DNA damage in mouse spleen [J]. Int Cong Series, 2005, 1276: 258-259.
[14] Kovalchuk O, Burke P, Besplug J, et al. Methylation changes in muscle and liver tissues of male and female mice exposed to acute and chronic low-dose X-ray-irradiation [J]. Mutat Res, 2004,548(1-2):75-84.
[15] Tran H, Marlowe K, McKenney K, et al. Functional integrity of intravenous immunoglobulin following irradiation with a virucidal dose of gamma radiation[J]. Biologicals, 2004, 32(2):94-104.
[16] 雷俊霞,郭振宇,赵东长,等.大鼠骨髓间质干细胞对同种骨髓移植后造血重建和免疫重建的作用[J].中国病理生理杂志, 2006,22(6):1129-1132.
[17] 胡贞贞, 邓宇斌, 王 晔, 等.静脉移植骨髓基质干细胞对脑缺血大鼠神经功能及神经细胞凋亡的影响[J].中国病理生理杂志, 2008,24(6): 1084-1089.
