EGCG通过mTOR通路拮抗低氧诱导的PC12细胞的凋亡与自噬*
2014-08-13曹锦霞王红卫
曹锦霞, 王 浩, 王红卫, 游 咏
(南华大学附属第一医院,湖南 衡阳 421000)
表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)是茶多酚的活性成分,越来越多的研究表明,EGCG在神经细胞的修复[1]、对抗氧化应激[2]、抗炎[3]及抑制脂质聚集[4]等多种生物学功能方面具有重要的调节作用。
雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一个结构和功能高度保守的丝氨酸/苏氨酸激酶,不仅具有调节蛋白质合成的功能[5],还在细胞增殖分化、凋亡等诸多方面发挥作用[6]。研究已经报道缺氧可导致神经细胞的凋亡并引起细胞自噬[7]。由于mTOR通路发挥多种蛋白表达与功能的调节作用,我们设想mTOR通路可能介导了EGCG对神经细胞的保护作用。
目前,EGCG对低氧诱导的凋亡与自噬方面的研究并未深入展开。EGCG是否能拮抗低氧诱导的神经损伤,以及mTOR通路是否参与其中尚未明了。本研究通过实验发现mTOR的确介导了CoCl2诱导的低氧所致细胞凋亡与自噬。这些方面的研究结果对于相关药物走向临床应用有重要的提示作用。
材 料 和 方 法
1 细胞及培养
PC12细胞购自中国科学院细胞中心,使用含10%胎牛血清的DMEM培养基培养于37 ℃、5% CO2的培养箱中。取对数生长期的细胞种植于6、 24、 96孔板中进行观察及相关实验。
2 Cell Counting Kit-8(CCK-8)检测细胞活力
将对数期的细胞均匀种植于96孔板,每个样本设置3个及以上复孔,每孔加样100 μL,待细胞贴壁并密度达到75%时,药物处理24 h。然后每孔加入5 μL的CCK-8试剂。2~4 h后使用450 nm酶标仪检测各孔吸光度值(A)。
3 细胞形态观察
将对数期的细胞均匀种植于24孔板,每个样本设置3个及以上复孔,每孔加样500 μL,待细胞贴壁并密度达到75%时,药物处理24 h。然后使用光学显微镜观察细胞形态并拍照。
4 细胞免疫荧光检测细胞内LC-3的表达
细胞处理24 h后,PBS清洗细胞并用纯冰甲醇固定;室温下Ⅰ抗室温孵育1 h;然后PBST快速洗2遍,Ⅱ抗避光室温孵育1 h; PBST快速洗2遍后加入DAPI,室温孵育2 min后使用荧光显微镜观察,每孔取至少3个视野观察并拍照。
5 Western blotting检测beclin-1和mTOR的表达
细胞处理24 h后,提取细胞蛋白并定量。使用浓度为10%、8%的凝胶进行蛋白电泳,电泳完毕使用PVDF膜制作“三明治”采用半干转法转膜;转膜完成后常温5%脱脂奶粉TBST封闭液封闭1 h;用TBST稀释Ⅰ抗后摇床上孵育过夜;TBST洗膜3次,Ⅱ抗常温下摇床孵育2 h;TBST洗膜3次后成像仪显影。
6 ELISA检测caspase-3的表达
细胞处理24 h后,提取细胞中的蛋白并定量。按说明书配制好所有的试剂:酶标板每孔加入100 μL的蛋白样品,覆膜覆盖后室温在摇床上孵育3 h,3 h后去除板内液体并在每孔加入300 μL的1×洗涤液,重复2次,然后每孔加入200 μL的1×活性液,在酶标仪使用450 nm波长处读取A值。
7 统计学处理
所有数据使用均数±标准误(mean± SEM)表示,使用SPSS 18.0 软件进行统计分析,组间差异采用单因素方差分析中的最小显著差异检验(LSD),以P<0.05 为差异有统计学意义。
结 果
1 CoCl2诱导的低氧促进了细胞的凋亡及自噬
1.1CoCl2诱导的低氧促进了PC12细胞的凋亡 不同浓度的氯化钴(CoCl2)处理PC12细胞24 h后,显微镜观察细胞的形态, CCK-8检测细胞活力,并提取蛋白检测细胞中caspase-3的表达水平。结果如图2所示:50、150、250 μmol/L浓度的CoCl2处理后的PC12细胞状态(可以从细胞形态,贴壁能力及突触的长度等来评估)明显下降;细胞活力也随CoCl2浓度依赖性下降,见图1A (P<0.01);凋亡蛋白caspase-3的表达明显升高,见图1B(P<0.05)。
1.2CoCl2诱导的低氧促进了PC12细胞自噬的发生 PC12细胞经不同浓度的氯化钴(CoCl2)处理24 h后,用Western blotting的方法检测自噬蛋白Beclin-1的表达,并采用蛋白免疫荧光的手段观察胞核内LC-3的表达情况。由图1C可以观察到beclin-1蛋白随着CoCl2浓度的升高而表达增多,自噬标志蛋白LC-3的表达亦存在相同的趋势,见图4(LC-3的表达量通过细胞核内小蓝色亮点的数量进行评估),提示CoCl2诱导的低氧确实促进了PC12细胞自噬的发生。
2 EGCG拮抗低氧诱导的细胞凋亡及自噬
2.1EGCG拮抗低氧诱导的细胞凋亡 通过细胞形态观察我们可以发现,与对照组相比,150 μmol/L的CoCl2诱导的低氧对细胞状态有严重损伤,而加入不同浓度的EGCG后,细胞状态较损伤组有明显好转,见图2。单用EGCG则未发现细胞状态与正常PC12细胞有明显差异,见图4。
同时我们使用CCK8检测细胞活力和ELISA检测caspase-3表达水平从而对细胞的凋亡程度进行评估,结果显示与150 μmol/L的CoCl2处理组相比,同时加入不同浓度的EGCG处理后,细胞活力有一定程度的恢复,见图3A(P<0.01)。相比较于CoCl2处理组,不同浓度的EGCG处理后caspase-3的表达水平有一定程度的下降,见图3B(P<0.01)。
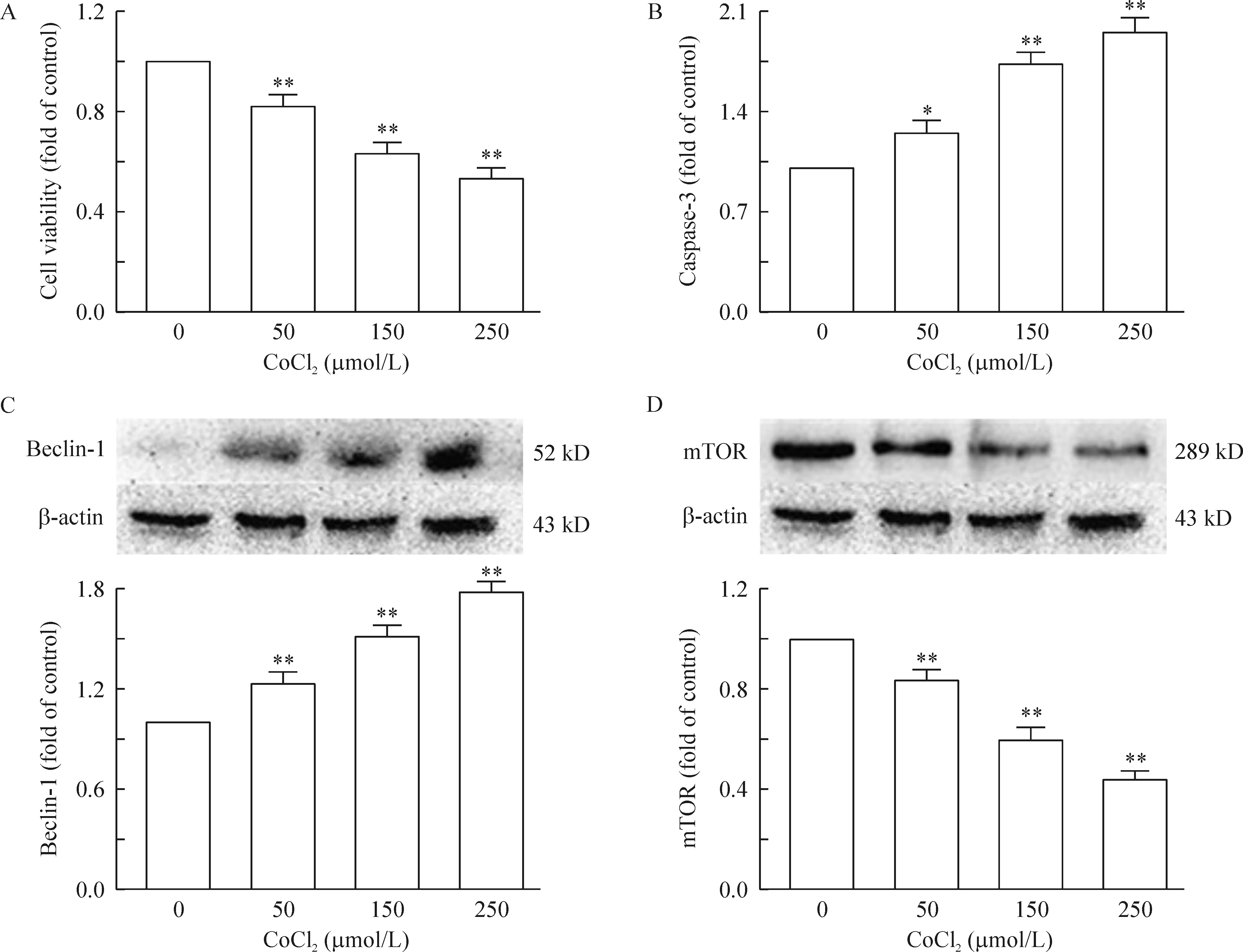
Figure 1. CoCl2 induced hypoxia promoted apoptosis and autophagy in PC12 at 24 h. A: cell viability was determined by CCK-8; B: caspase-3 was determined by ELISA; C: the expression of beclin-1 was detected by Western blotting using an anti-beclin-1 antibody; D: mTOR expression was detected by Western blotting. Mean±SEM. n=3. * P<0.05, **P<0.01 vs control group (0 μmoL/L).
2.2EGCG拮抗低氧诱导的细胞自噬 我们对150 μmol/L的CoCl2以及不同浓度的EGCG处理PC12细胞24 h后的自噬标志蛋白beclin-1和LC-3进行了检测,结果显示:CoCl2单独处理细胞后的beclin-1表达水平明显升高,而不同浓度EGCG的处理对beclin-1的表达水平有一定程度的抑制,见图3C(P<0.05)。从免疫荧光我们可以观察到与CoCl2单独处理组相比,加入150 μmol/L的EGCG对细胞核内LC-3的表达有一定程度的抑制,而单独使用150 μmol/L的EGCG处理的PC12细胞LC-3的表达与对照组无明显差异,见图4。
3 EGCG通过调控mTOR通路拮抗低氧诱导的细胞凋亡与自噬
3.1CoCl2诱导的低氧抑制mTOR通路的表达 为明确mTOR对EGCG抗CoCl2诱导的低氧所致的神经毒性的介导作用,我们用不同浓度的CoCl2处理PC12细胞24 h后,Western blotting检测mTOR的表达,从结果可以观察到mTOR的表达水平呈浓度依赖性下降,见图1D(P<0.05)。
3.2EGCG拮抗CoCl2对mTOR通路的抑制作用 PC12细胞同时经过不同浓度的EGCG处理24 h后,mTOR表达水平相较于CoCl2处理组出现浓度依赖性上升,见图3D(P<0.05),单独使用EGCG对mTOR的表达无明显影响。提示mTOR通路可能参与介导了EGCG抗CoCl2诱导的低氧所致的神经毒性。
3.3雷帕霉素(mTOR特异性阻滞剂)逆转了EGCG对CoCl2诱导的凋亡与自噬的拮抗作用 上述结果提示mTOR通路可能参与了EGCG抗CoCl2诱导的低氧所致的神经毒性的介导作用,为进一步了解EGCG是否通过mTOR通路发挥作用,我们使用mTOR特异性阻滞剂:雷帕霉素(RAPA)来阻断mTOR通路,从细胞状态的结果我们可以发现加入RAPA处理后,EGCG对细胞状态的改善作用被逆转;单独使用RAPA,细胞状态没有发生明显的改变,见图2。使用RAPA后,用CCK8检测细胞活力,我们发现加入RAPA处理,PC12细胞的活力较EGCG处理组明显下降;同时,凋亡蛋白caspase-3的表达水平升高,见图5(P<0.05)。
加入RAPA处理后,EGCG对细胞自噬的抑制效果也同样被逆转。自噬蛋白beclin-1的表达水平较EGCG处理组有一定程度的升高,见图5C(P<0.05)。同时,RAPA处理后的EGCG组LC-3在细胞核内的表达水平亦出现升高,见图4。而单用RAPA则对LC-3在细胞核的表达水平与对照组无明显差异。

Figure 2. Effect of EGCG on hypoxic apoptosis induced by CoCl2 in PC12 cells. PC12 cells were treated with CoCl2 and/or EGCG and/or RAPA for 24 h (×400). 1: control group; 2: CoCl2 50 μmol/L; 3: CoCl2 150 μmol/L; 4: CoCL2 250 μmol/L; 5:CoCl2 150 μmol/L+EGCG 10 μmol/L; 6: CoCl2 150 μmol/L+ EGCG 20 μmol/L;7: CoCl2 150 μmol/L+ EGCG 40 μmol/L; 8: EGCG 40 μmol/L; 9: CoCl2 150 μmol/L+EGCG 20 μmol/L+RAPA 100 nmol/L; 10: RAPA 100 nmol/L.
讨 论
中国人饮茶的习惯最早始于神农时代,时至当今仍然被传承与发扬。茶叶中主要成分茶多酚的作用越来越得到研究者们的重视,表没食子儿茶素没食子酸酯作为茶多酚生物活性的主要成分,更是当今研究的热点所在。据报道:EGCG一方面有积极的抗肿瘤作用,例如肺癌[8]、宫颈癌[9]、胃癌[10]及胰腺癌[11]等,另一方面,对正常细胞的抗凋亡等保护预防作用[1]也多有研究。同时,众所周知,神经细胞缺氧会引起一系列的生理、病理反应,像氧化应激、自噬和内质网应激[12]等,当超过细胞的清除能力时,会引起神经细胞的凋亡[13],最终导致严重的后果。因此,深入阐明缺氧对神经细胞毒性的机制对神经系统相关的疾病防治和人类的健康同样具有重大的意义。
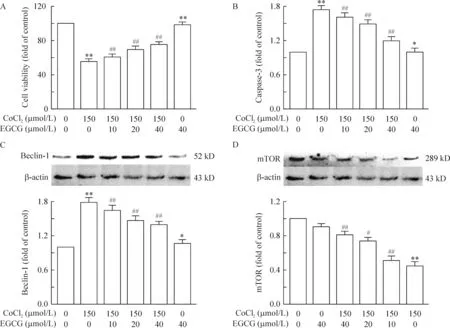
Figure 3. Effects of EGCG on hypoxic apoptosis and autophagy induced by CoCl2 in PC12 cells. PC12 cells were treated with CoCl2 and/or EGCG for 24 h. A: the cell viability was determined by CCK-8 assay; B: caspase-3 was determined by ELISA; C, D: the expression of beclin-1 and mTOR was detected by Western blotting. Mean±SEM.n=3.* P<0.05, ** P<0.01 vs control group (0 μmol/L); #P<0.05, ##P<0.01 vs CoCl2 150 μmol/L group .

Figure 4. Effects of EGCG on hypoxic autophagy induced by CoCl2 in PC12 cells.PC12 cells were treated with CoCl2 and/or EGCG and/or RAPA for 24 h. The expression of LC-3 was determined by immunofluorescence using an anti-LC-3 antibody. 1: control group; 2: CoCl2 150 μmol/L; 3: CoCl2 150 μmol/L + EGCG 20μmol/L; 4: CoCl2 150 μmol/L + EGCG 20 μmol/L +RAPA 100 nmol/L; 5: EGCG 20 μmol/L; 6: RAPA 100 nmol/L.
EGCG拮抗低氧诱导的细胞凋亡及自噬 PC12细胞来源于大鼠肾上腺嗜铬细胞瘤,其形态、结构和功能与多巴胺能神经元有一定相似性,广泛地用于神经细胞的研究。此外,一些研究表明,在许多细胞中CoCl2可以模拟诱导细胞的缺氧环境[14],如PC12、C6大鼠神经胶质瘤细胞和视网膜神经节细胞[15]。为了明确缺氧对神经细胞的毒性作用,我们采用PC12细胞作为神经细胞模型,不仅观察了缺氧环境下神经细胞的状态,还通过细胞活力的检测和caspase-3的表达水平客观评估了其凋亡程度,并检测了细胞中自噬标志性蛋白beclin-1和LC-3的表达,事实上,CoCl2诱导的缺氧确实增加了细胞的凋亡,并上调了细胞的自噬作用。其它相关研究也证实,CoCl2诱导的缺氧可以导致神经细胞的凋亡[5]、氧化应激及内质网应激[16]的发生。这些研究结果都与我们对缺氧环境对细胞凋亡和自噬增强的实验结果与预期一致。
EGCG通过调控mTOR通路拮抗低氧诱导的细胞凋亡与自噬,mTOR是一个结构和功能高度保守的丝氨酸/苏氨酸激酶,可以调节蛋白质的合成,并影响细胞的增殖、凋亡,同时在细胞的抗氧化应激、自噬等生物学功能中发挥作用[17]。我们通过检测mTOR在CoCl2诱导的缺氧环境以及EGCG处理后的表达发现:CoCl2诱导的缺氧抑制了mTOR的表达,而EGCG则恢复了其活性,说明mTOR介导了CoCl2诱导的缺氧对神经细胞毒性。
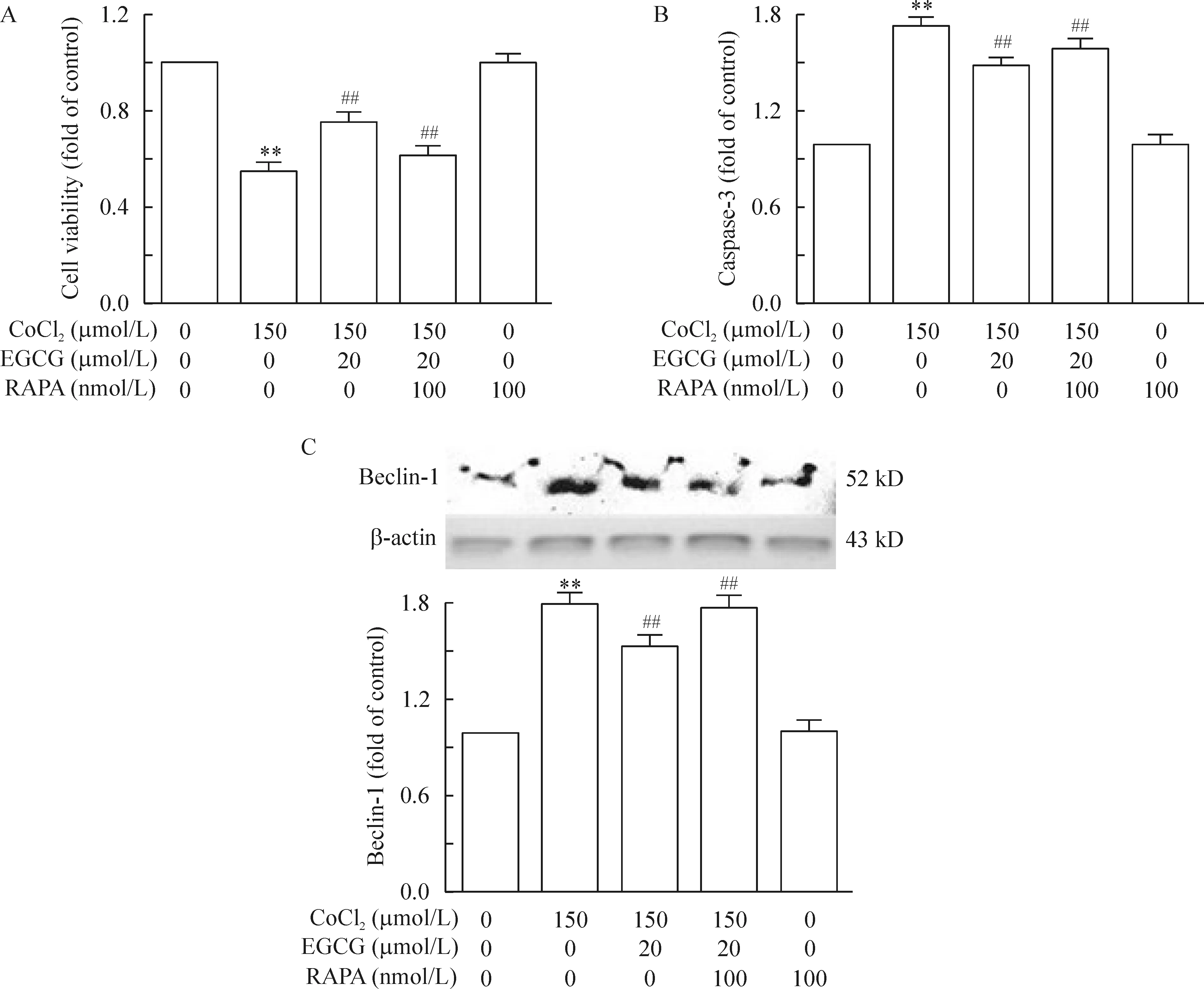
Figure 5. Effects of RAPA on EGCG-induced downregulation of apoptosis in PC12 cells. PC12 cells were treated with CoCl2 and/or EGCG and/or RAPA for 24 h.A: the cell viability was determined by CCK-8 assay; B:caspase-3 was determined by ELISA;C: the expression of beclin-1 was detected by Western blotting. Mean±SEM. n=3. **P<0.01 vs control group;# P<0.05, ## P<0.01 vs CoCl2 150 μmol/L group.
阻断mTOR通路后EGCG是否能拮抗CoCl2诱导的低氧所致的神经毒性?为了得到答案,我们采用mTOR特异性阻滞剂雷帕霉素功能处理细胞后,结果提示细胞凋亡增加,凋亡蛋白caspase-3表达增多;自噬水平升高,自噬标志蛋白beclin-1和LC-3表达均升高,说明mTOR通路阻断后,加重了CoCl2诱导的低氧所致的神经毒性,抵消了EGCG拮抗低氧所致的细胞损伤,EGCG通过调控mTOR通路发挥抑制凋亡、降低自噬的生物学作用,从而拮抗低氧所致的神经毒性。
值得注意的是,通过观察阻断mTOR通路表达的结果,我们发现加入RAPA阻断mTOR通路后相比于对照组并未完全抑制PC12细胞的活力,并且自噬水平下降的程度有限,这提示我们可能还存在其它的通路使得EGCG发挥其抗凋亡,抑制自噬的生物学作用。
通过研究,我们证实了EGCG通过mTOR通路拮抗CoCl2诱导的低氧引起的PC12细胞的凋亡与自噬。这为缺氧的神经毒性机制的研究提供了新的线索和思路,基于目前的研究,运用EGCG治疗神经细胞缺氧所致的损伤或许是新的途径与策略,同时,这对于神经系统相关疾病的研究与治疗也开辟了新的视角。
[参 考 文 献]
[1] Renno WM, Al-Khaledi G, Mousa A, et al. (-)-Epigallocatechin-3-gallate (EGCG) modulates neurological function when intravenously infused in acute and, chronically injured spinal cord of adult rats[J]. Neuropharmacology, 2014, 77:100-119.
[2] Niu Y, Na L, Feng R, et al. The phytochemical, EGCG, extends lifespan by reducing liver and kidney function damage and improving age-associated inflammation and oxidative stress in healthy rats[J]. Aging Cell, 2013, 12(6):1041-1049.
[3] Liu Q, Qian Y, Chen F, et al. EGCG attenuates pro-inflammatory cytokines and chemokines production in LPS-stimulated L02 hepatocyte[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46(1):31-39.
[4] Kim HS, Montana V, Jang HJ, et al. Epigallocatechin gallate (EGCG) stimulates autophagy in vascular endothelial cells: a potential role for reducing lipid accumulation[J]. J Biol Chem, 2013, 288(31):22693-22705.
[5] Hu J, Zhao TZ, Chu WH, et al. Protective effects of 20-hydroxyecdysone on CoCl(2)-induced cell injury in PC12 cells[J]. J Cell Biochem, 2010, 111(6):1512-1521.
[6] Tang Z, Bereczki E, Zhang H, et al. Mammalian target of rapamycin (mTor) mediates tau protein dyshomeostasis: implication for Alzheimer disease[J]. J Biol Chem, 2013, 288(22):15556-15570.
[7] Hwang SK, Kim HH. The functions of mTOR in ischemic diseases[J]. BMB Rep, 2011, 44(8):506-511.
[8] Liu LC, Tsao TC, Hsu SR, et al. EGCG inhibits transforming growth factor-beta-mediated epithelial-to-mesenchymal transition via the inhibition of Smad2 and Erk1/2 signaling pathways in nonsmall cell lung cancer cells[J]. J Agric Food Chem, 2012, 60(39):9863-9873.
[9] Muthusami S, Prabakaran DS, An Z, et al. EGCG suppresses Fused Toes Homolog protein through p53 in cervical cancer cells[J]. Mol Biol Rep, 2013, 40(10):5587-5596.
[10] Park JS, Khoi PN, Joo YE, et al. EGCG inhibits recepteur d’origine nantais expression by suppressing Egr-1 in gastric cancer cells[J]. Int J Oncol, 2013, 42(3):1120-1126.
[11] Shankar S, Marsh L, Srivastava RK. EGCG inhibits growth of human pancreatic tumors orthotopically implanted in Balb C nude mice through modulation of FKHRL1/FOXO3a and neuropilin[J]. Mol Cell Biochem, 2013, 372(1-2):83-94.
[12] Zhang H, Li H, Liu X, et al. Effect of caspase-9 inhibition on endoplasmic reticulum stress induced cortical neuronal injury in rats[J]. Int J Clin Exp Med, 2013, 6(7):546-551.
[13] Liu SY, Chen CL, Yang TT, et al. Albumin prevents reactive oxygen species-induced mitochondrial damage, autophagy, and apoptosis during serum starvation[J]. Apoptosis, 2012, 17(11):1156-1169.
[14] Lee M, Kang H, Jang SW. CoCl2induces PC12 cells apoptosis through p53 stability and regulating UNC5B[J]. Brain Res Bull, 2013, 96:19-27.
[15] Chhunchha B, Fatma N, Kubo E, et al. Curcumin abates hypoxia-induced oxidative stress based-ER stress-mediated cell death in mouse hippocampal cells (HT22) by controlling Prdx6 and NF-κB regulation[J]. Am J Physiol Cell Physiol, 2013, 304(7):C636-C655.
[16] Chen S, Ren Q, Zhang J, et al. N-acetyl-L-cysteine protects against cadmium-induced neuronal apoptosis by inhibiting ROS-dependent activation of Akt/mTOR pathway in mouse brain[J]. Neuropathol Appl Neurobiol, 2014,40(6):759-777.
[17] Wang Y, Hu Z, Liu Z, et al. mTOR inhibition attenuates DNA damage and apoptosis through autophagy-mediated suppression of CREB1[J]. Autophagy, 2013, 9(12):2069-2086.
