B超引导下125I粒子植入治疗胰腺癌的临床研究
2014-08-11李敏朋渊陆世锋潘孟范芳廖轲潘壮
许 斌 李敏朋 赫 军 俞 渊陆世锋潘孟范芳廖轲潘壮
(广西中医药大学第一附属医院外一科,南宁市 530023)
B超引导下125I粒子植入治疗胰腺癌的临床研究
许 斌 李敏朋*赫 军 俞 渊陆世锋潘孟范芳廖轲潘壮
(广西中医药大学第一附属医院外一科,南宁市 530023)
目的探讨125I粒子永久性植入组织间治疗不能切除的胰腺癌的临床疗效。方法62例患者经B超、CT、MRI等影像学检查及穿刺活检后临床确诊为胰腺癌,病灶直径为7.35(5.46~9.17)cm。其中腹痛较剧者51例,黄疸28例。采用计算机立体定位计划系统(treatment plan system,TPS)计算布源,术中超声实时监视,均匀布针并植入125I粒子。术后超声确认植入部位及有无漏植。结果20例患者疼痛完全缓解,19例部分缓解,23例无效,平均术后3~8 d疼痛缓解;9例死于局部进展,5例死于远处转移,全组中位生存时间11个月。2个月后CT复查,完全缓解(CR)3例,部分缓解(PR)27例,无变化(NC)20例,进展(PD)12例。总有效率(CR+PR)48.39%。结论B超引导下放射性粒子植入治疗胰腺癌创伤小,并发症发生率低,生活质量改善明显,近期效果好,可以较好地减轻疼痛症状,具有定位精确、实时监视的特点,是治疗中晚期胰腺癌简单、安全、有效的方法。
胰腺癌;组织间放疗;125I粒子;B超引导
胰腺癌是消化系统常见的恶性肿瘤,起病隐匿,且解剖非常复杂,周围大血管较多,手术难度极大,只有不到20%的患者获得手术机会,对于那些无法手术切除的患者,因其对化疗及普通放疗敏感性较低,中位生存期仅6个月[1,2],预后极差,其发病率仍处于上升阶段。组织间内照射是一种新兴的恶性肿瘤治疗手段,通过应用计算机立体定位计划系统(treatment plan system,TPS)设计方案,在现代影像设备引导下将放射性粒子根据肿瘤位置、大小及形态植入肿瘤内或受肿瘤浸润侵犯的组织中,放射性粒子通过发出持续、短距离的放射线,最大程度的杀伤肿瘤细胞,而正常组织不损伤或损伤极小,从而达到杀灭恶性肿瘤细胞的目的。我科自2005年9月至2012年5月用125I粒子治疗中晚期无法手术切除的胰腺癌患者,获得较好疗效,现报告如下。
1 资料与方法
1.1 一般资料 本组62例胰腺癌患者均为局部浸润无法行根治性手术,并经CT、MRI检查及病理穿刺活检后临床诊断为胰腺癌,病理类型为腺癌,腺癌中高分化13例,中分化38例,低分化11例。男38例,女24例, 年龄47~79岁,中位年龄为(62±15)岁。病灶平均直径为7.35(5.46~9.17)cm。其中腹痛较剧者55例,黄疸23例。病理分期(TNM,pTNM)Ⅱ期9例,Ⅲ期 43例,Ⅳ期10例。
1.2 放射性粒子 放射性粒子治疗计划系统(TPS)由珠海和佳医疗设备有限公司提供,125I粒子由浙江君安药业提供,外形为圆柱形钛合金封装体,长度为 4.5 mm,直径为0.8 mm,内有3.0 mm×0.5 mm的银柱,银柱表面吸附125I,粒子外壁是钛壳。125I粒子平均能量27.4~35.5 keV,半衰期59.6 d,铅半值层为0.025 mm。细胞组织半值层为2.0 cm。临床使用的125I粒子单个粒子的活性为10.4~37.0 MBq。
1.3 植入方法 通过三维治疗计划系统进行医学影像采集,完成治疗靶区及周围邻近重要组织器官三维图像重建,对周围重要组织器官的耐受剂量进行分析,避开大血管、胰管、胆道及肠道,制定靶区范围及处方剂量,完成放射治疗设计方案。按照治疗计划,在超声引导下自下而上、自右向左逐一将粒子植入针插入肿块内,针距为1 cm,深度为针尖距肿物深方边缘0.5 cm左右。操作过程中,每退针1 cm就植入一颗I粒子,直至针尖到达肿瘤前方边缘,并使粒子与大血管、主胰管、胆总管及十二指肠之间的距离>0.6 cm。
1.4 B超或CT复查 粒子植入结束后,B超或CT需再次检查粒子植入部位,以确认125I粒子植入位置是否达到预期的植入位置,125I粒子分布是否均匀,有无漏植。如部分125I粒子植入位置欠佳及有漏植,需要补植入部分粒子,从而达到预期植入位置。
1.5 疗效评价
1.5.1 治疗前疼痛评估 按WHO疼痛程度分级标准[3]:0级:无疼痛;Ⅰ级:疼痛轻微能够耐受,可以正常生活,可以正常入睡,睡眠无影响;Ⅱ级:疼痛不能忍受,无法正常入睡,需服用止痛药物;Ⅲ级:疼痛剧烈,无法入睡,必须使用止痛药物,可伴有植物神经功能紊乱表现或被动体位。按此疼痛评估标准,胰腺癌患者可分为0级2例,Ⅰ级5例,Ⅱ级37例,Ⅲ级18例。
1.5.2 治疗疼痛评价 止痛疗效判断标准为:显效:疼痛消失或分级标准下降两级者;有效:疼痛分级标准下降一级者;无效:疼痛分级标准无下降或上升者。
1.5.3 放射性粒子植入的效果评价 治疗后2个月进行CT检查。疗效评价按WHO相关肿瘤评定标准[4]:完全缓解(CR):肿瘤消失并维持1个月;部分缓解(PR):体积缩小50%以上并维持1个月;无变化(NC)或稳定:缩小不足50%;进展(PD):肿瘤体积增大超过25%或有新病灶出现。有效率为PR+CR。
1.6 统计学方法 采用SPSS 11.0软件进行统计分析,两样本比较采用t检验,多样本比较采用秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 止痛效果 显效20例,有效19例,无效23例,总有效率(显效+有效)62.90%,平均术后3~9 d疼痛缓解。详见表1。
2.2 疗效情况 2个月后复查CT,完全缓解(CR)3例,部分缓解(PR)27例,无变化(NC)20例,进展(PD)12例。总有效率(CR+PR)为48.39%。详见表2。
2.3 随访情况 随访4个月发现3例患者有3颗粒子随血流迁徙至肝脏内;白细胞下降4例。未出现胰瘘、胰腺炎、消化道出血、腹腔脓肿等严重并发症。随着随访时间的延长,影像学检查发现局部复发或远处转移。62例胰腺癌患者的中位生存时间为11个月。植入前后的影像图情况见图1及图2。

表1 治疗后止痛效果 (n)
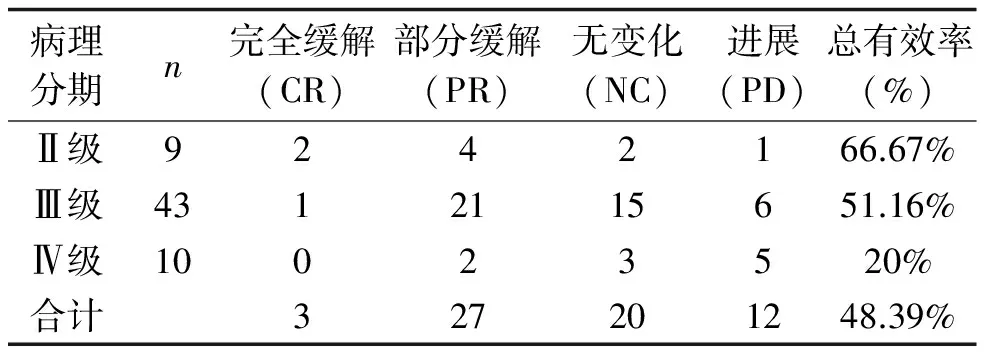
表2 临床效果评价

图1 粒子植入前

图2 粒子植入后8个月
3 讨 论
胰腺癌发病率在全世界范围内呈上升趋势[5],目前最有效的治疗手段是外科手术切除。因其解剖深在隐匿的特点,临床上难以早期发现,同时胰腺缺乏被膜,肿瘤极易侵犯至周围组织包括淋巴结、神经丛和肠系膜血管,或者转移至肝或腹膜表面,所以大约80%的胰腺癌患者就诊时已属晚期,丧失了手术切除机会[6]。而进展期胰腺癌患者的生存期,就目前现有条件无法明显延长的情况下,提高患者生存质量及控制局部病灶就成为了主要的治疗目的[7]。
由于胰腺癌对放疗敏感度低,为提高治疗效果,肿瘤靶区的放射累积剂量需达到60 Gy以上才能取得较满意的疗效,但是胰头周围解剖复杂,血管较多,十二指肠、胆总管与胰头毗邻,肿瘤靶区难以达到有效放射剂量。随着技术的发展,通过应用计算机立体定位计划系统(treatment plan system,TPS)设计方案,在现代影像设备(如B超、CT等)引导下将放射性粒子植入肿瘤内或受肿瘤浸润侵犯的组织中,放射性粒子通过发出持续、短距离的放射线,不但可以使肿瘤靶区达到有效放射剂量,而且周围正常组织不损伤或损伤极小,从而达到杀灭肿瘤细胞的目的,目前已经成为局部进展期胰腺癌患者的主要治疗方法[7]。
目前国内学者[8~11]进行胰腺癌局部放疗时主要采用CT引导下行胰腺癌125I粒子植入治疗,虽然CT对胰腺的组织分辨力较B超更强, 但其操作较复杂、无法实时显像,同时需注射专门的造影剂才能清楚地显示血管,这些缺点限制了其临床应用范围。与CT相比,彩超对肿瘤病灶的位置、大小、形态、边缘、病灶与周围组织的关系以及肿瘤病灶内的血流信号均可清晰显示,可成功避开周围重要结构,从而将粒子准确植入到侵袭部位,为粒子的均匀种植奠定基础。同时超声引导具有实时性、灵敏度高、精确、对人体其他正常部位无X线辐射损伤、操作简単、经济等特点。
我们通过TPS设计方案,在彩超引导下将I粒子根据肿瘤位置、大小及形态植入肿瘤内或受肿瘤浸润侵犯的组织中,其作用机制和优势在于:①肿瘤靶区内高剂量,而周围正常组织由于射线迅速衰减呈低剂量[12];②125I粒子的主要治疗辐射能量为35.5 keV的γ射线及27.4~31.4 keV的X射线,使肿瘤细胞DNA双链断裂和不可修复性的DNA损伤,从而达到杀灭肿瘤细胞的目的;③肿瘤内植入I粒子,半衰期为59 d,连续照射时间长,在杀伤肿瘤细胞的同时还可以减少肿瘤再增殖;④放射治疗靶区不随照射器官的移动而变化。在临床疗效上,对于疼痛症状的缓解,有效率(显效+有效)为62.90%,平均术后3~9 d疼痛缓解;2个月后CT复查,肿瘤治疗的总有效率(CR+PR)48.39%,中位生存时间12个月。与国内报道相比,治疗效果偏低,可能与肿瘤的病理类型有关。术后未发生胰瘘、胰腺炎、肠道出血、腹腔内脓肿等严重并发症,仅发生轻度白细胞下降及极少量粒子迁徙至肝脏,证明其安全性高。
125I放射性粒子植入技术治疗胰腺癌的关键在于粒子的均匀种植,粒子准确植入胰腺的理想位置有较大难度,因胰腺部位深在隐蔽,同时由于彩超是二维图像,经验不足的彩超医生可能难以精确引导粒子植入到TPS系统设计的位置,可能会出现肿瘤区粒子分布不到位而导致局部放疗剂量不足出现“冷点”。所以为避免肠道积气的干扰,获得清晰的超声图像,术前须进行严格的肠道准备,术前一日进流质饮食,术前12 h禁食,同时参与整个治疗过程的彩超医生及介入医生均必须有丰富的经验才能较好的配合,才能完成治疗过程,避免冷点的出现。
放射性粒子植入作为胰腺癌常规治疗手段(手术、化疗、中医药等)外的一种补充手段,具有微创、安全、并发症少等特点,在肿瘤局部控制、缓解患者疼痛以及提高患者生活质量方面具有一定的作用。但目前该技术仍存在缺乏规范性、临床医师对肿瘤放射剂量认识不足等问题,尚需进一步完善和发展。同时如何探讨病理类型与临床治疗效果的关系,并筛选出对放疗相对敏感的胰腺癌类型,还有待于进一步研究。
[1] Yeo CJ,Cameron JL,Lillemoe KD,et al.Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients[J].Ann Surg,1995,221(6):721-731.
[2] Wang C,Wu H,Xiong J,et al.Pancreaticoduodenectomy with vascular resection for local advancedpancreatic head cancer:a single center retrospective study[J].J GastrointestSurg,2008,12(12):2183-2190.
[3] Raben A,Mychalczak B,Brennan MF,et al.Feasibility study of thetreatment of primary unresectable carcinoma of the pancreas with 103Pd brachytherapy[J].Int J Radiat Oncol Biol Phys,1996,35(2):351-356.
[4] Miller AB,Hoogstraten B,Staquet M,et al.Reporting results of cancer treatment[J].Cancer,1981,47(1):207-214.
[5] 赫 捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:112-114.
[6] Li D,Xie K,Wolff R,et al.Pancreatic cancer[J].Lancet,2004,363(9414):1049-1057.
[7] Chang DT,Schellenberg D,Shen J,et al.Stereotactic radiotherapyfor unresectable adenocarcinoma of the pancreas[J].Cancer,2009,115(3):665-672.
[8] 俞炎平.125I放射性粒子组织间植入在局部进展期胰腺癌治疗中的研究进展[J].中国肿瘤,2013,22(5):384-387.
[9] 陆 健,郑云峰,张 欢,等.CT 导引下植入125I粒子治疗19 例晚期胰腺癌的疗效观察[J].介入放射学杂志,2010,19(7):550-553.
[10]张福君,吴沛宏,赵 明,等.CT 导引下125I粒子植入治疗胰腺癌[J].中华医学杂志,2006,86(4):223-227.
[11]李振家,王锡明,武乐斌,等.CT导向下组织间植入125I粒子治疗胰腺癌[J].中华肿瘤杂志,2005,27(3):187
[12]Huang MW,Liu SM,Zheng L,et al.A digital model individualtemplate and CT-guided 125I seed implants for malignanttumors of the head and neck[J].J Radiat Res,2012,53(6):973-977.
Ultrasound-guided125Iseedimplantioninthetreatmentofpancreaticcancer
XUBin,LIMinpeng*,HAOJun,YUYan,LUShifeng,PANMeng,FANFang,LIANKe,PANZhuang
(Departmentofsurgery,TheFirstAffiliatedHospitalofGuangxiCollegeoftraditionalChineseMedicine,Nanning530023)
ObjectiveTo investigate the clinical value of Ultrasound-guided radioactive seed125I implantation in the treatment of pancreatic cancer.MethodsSixty-two patients with pancreatic cancer, with an average of 7.35 cm in size, underwent Ultrasound-guided radioactive seed125I implantation. Of the 62 patients, 5 had severe abdominal pain and 28 had jaundice. Treatment plan system was used to design the distribution of the seed125I needed under Ultrasound guidance.ResultsComplete relief (CR) of abdominal pain was seen in 20 patients, partial relief (PR) in 19 patients, and no change(NC) in 23 cases. The abdominal pain was relieved 3-8 days after the implantation. CT performed 2 months after implantation showed CR in 3 cases, PR in 27 cases, NC in 20 cases, and progression in 12 cases, with an overall effective rate of 48. 39.9% patients died of local progression and 5 patients died of distant metastasis. The median survival time was 11 months.ConclusionUltrasound-guided radioactive seed125I implantation can improve quality of life in the treatment of pancreatic cancer, with the advantages of good short-term effect, minimal invasiveness, few complications, precise orientation, real-time monitoring.
Pancreatic neoplasms; Interstitial brachytherapy;125I seed
许斌(1980~),男,医学硕士,主治医师,研究方向:肝胆脾胰外科疾病。
R 735.9
A
1673-6575(2014)06-0705-04
10.11864/j.issn.1673.2014.06.10
2014-09-06
2014-11-10)
*通讯作者
