脑蛋白水解物注射液治疗卒中后认知功能障碍的随机对照研究
2014-08-11安中平段建钢
李 萍, 安中平, 段建钢
脑卒中是世界上导致死亡的第二大死因,也是引起成年人致残的主要原因。世界卫生组织MONICA研究表明,我国的脑卒中发生率正以每年近8.7%的速率上升。卒中不仅造成患者肢体活动障碍、语言障碍等躯体残疾,而且显著影响患者的认知功能[1]。卒中后认知功能障碍不仅严重影响患者的日常生活能力[2],也对卒中后躯体功能的恢复造成不利影响[3],是卒中致残的重要原因之一[4]。奥地利依比威药厂生产的脑蛋白水解物注射液(原名:脑活素,商品名:施普善,Cerebrolysin)是目前唯一含有神经营养因子活性片段的产品,具有内源性神经营养因子活性,可自由通过血脑屏障,通过多水平机制发挥神经保护作用。几个RCT研究[5~9]已显示脑蛋白水解物注射液对缺血性卒中有较好的疗效和安全性。有临床研究表明[10],脑蛋白水解物注射液能改善轻-中度血管性痴呆的认知功能。这些结果提示脑蛋白水解物注射液可能作为卒中后认知功能障碍的一个有效治疗手段,而相关的临床研究尚未见报道。
我们设计了一个为期90 d的脑蛋白水解物注射液对卒中后认知功能障碍疗效和安全性的随机对照的临床研究。其主要目的是观察脑蛋白水解物注射液是否有改善卒中后认知功能障碍的疗效及其安全性。
1 对象与方法
1.1 研究对象
病例来自天津市环湖医院神经内科卒中单元病房2010年5月~2012年3月收治的年龄在18~85岁,在发病48 h内入院的急性大脑半球卒中患者,其CT或MRI检查结果支持急性大脑半球卒中的临床诊断,排除颅内占位,男女性别不限;用蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)及简易智能状态检查(Mini Mental State Examination,MMSE)对每位患者在入院时进行评估,选择MoCA评分≤18分(小学及以下)、≤24分(初中及以上)及MMSE评分≤22分(小学)、≤26分(初中及以上)的患者;共纳入190例急性卒中患者,用随机数字表的方法将患者随机分为脑蛋白水解物组(96例),对照组(94例)。两组患者基线资料无明显统计学差异,具有可比性(见表1),且均已取得患者和(或)其家属知情同意。
研究对象的排除标准:发病时即有意识障碍或脑疝的患者;神经功能缺损严重(如完全失语或全瘫等)不能配合评定量表的患者;发病前即有认知功能障碍的患者;在卒中发作时有癫痫发作的患者;严重肝肾功能不全的患者;伴有严重全身疾病(重度充血性心力衰竭、急性心肌梗死)明显限制预期寿命的患者;伴随影响认知功能评估的疾病(严重痴呆、严重精神病等)的患者;同时用其他神经保护药或脑代谢活化剂治疗(吡拉西坦、胞磷胆碱等)的患者;同时应用血管扩张药(氟桂利嗪、尼莫地平等)的患者;同时应用其他改善卒中后认知功能障碍的药物的患者;近期已受过系统治疗的痴呆者;合并肿瘤的患者;不能耐受脑蛋白水解物注射液治疗的患者;怀孕或哺乳期的妇女;未取得患者或家属同意者。
1.2 方法
1.2.1 治疗方法
两组均在基线资料评估完的入院当天予药物治疗。脑蛋白水解物组:生理盐水250 ml+30 ml脑蛋白水解物注射液(由奥地利依比威药厂特殊提供)静脉滴注,超过30 min滴完,1次/d,连续治疗14 d。对照组:250 ml生理盐水静脉滴注,1次/d,连续治疗14 d。两组患者在整个观察期间都接受标准的卒中治疗:如对脑梗死患者,予阿司匹林:100 mg/次,口服,1次/d,对脑出血急性期患者予甘露醇或甘油果糖脱水,但是都不用其他神经保护药或脑代谢活化剂、血管扩张药及其他改善认知功能的药物。
1.2.2 终点事件及病例脱落的处理
以在临床及随访观察期间又新发脑卒中和死亡为终点事件。经知情同意、并筛选合格进入随机化试验的受试者,因发生终点事件未完成本方案所规定的观察周期或在随访中因种种原因丢失部分观察者,称为脱落病例,我们再次随机选择新的符合标准的急性卒中患者进行观察研究,尽力使脱落病例的例数不能超过总观察数的10%。
1.2.3 疗效评价
对两组患者均进行随访观察,用MoCA及MMSE评定患者认知功能,在入院 1 d、2 d、7 d、14 d、30 d、90 d 进行 MoCA及MMSE评分,这些量表的评估由接受过培训的医师完成。
1.2.4 安全性
副作用事件通过事先设计好的非暗示性问卷调查,所有患者、家属或医生所观察到的事件(包括发生日期、停止日期、严重程度及与试验用药的关系)都被记录在标准记录表上。血、尿常规、血糖、电解质、肝功能、肾功能、心电图、颈动脉彩超、经颅多普勒超声、头部CT/MRI在入院时及治疗结束时检查。
1.3 统计学分析
用SPSS 11.0统计软件进行统计分析,在观察期间,有失访发生时,进行意向性处理(Intention-to-treat,ITT)分析来评定疗效。计量资料采用表示,两组均数比较采用独立样本的t检验,P<0.05被认为差异有统计学意义。
2 结果
2.1 研究对象分布
总共纳入了190例急性卒中患者,男女性别不限,其中脑梗死157例,脑出血33例,被随机分为两组:脑蛋白水解物组96例,对照组94例,总共181位患者(95.26%)参与完成了整个研究过程,其中脑蛋白水解物组92例,对照组89例。在两组中早期终止研究的患者数是相似的,脑蛋白水解物组4例(4.35%),包括失访1例,由于不良反应而拒绝继续治疗3例;对照组5例(5.62%),包括失访3例,由于不良反应拒绝继续治疗2例,对两组由于不良反应而终止研究的患者,在整个研究期间尽可能随访其结局,对两组中失访的患者,采用失访者最后一次测量结果,总共190例患者(脑蛋白水解物组96例,对照组94例)进入意向性处理分析。
2.2 基线资料比较
两组的人口统计学特征:性别、年龄、文化程度均无统计学差异(P>0.05);两组的卒中类型中,半球卒中所占比例较多,且无统计学差异;两组治疗前的认知功能评分也没有统计学差异。也就是说两组基线资料无明显统计学差异,具有可比性(见表1)。
2.3 认知功能评价
在入院2 d时,两组患者的MoCA及MMSE评分无明显增加(P>0.05),随着治疗时间的延长,脑蛋白水解物组的MoCA 及 MMSE 评分逐渐增加,在 7 d、14 d、30 d、90 d,脑蛋白水解物组MoCA及MMSE评分高于对照组(P<0.01),对照组在治疗7 d、14 d时,MoCA及MMSE评分明显增加,但在30 d、90 d时,对照组MoCA及MMSE评分无明显增加,这个结果显示两组的认知功能在90 d的观察期间均有所改善,但是脑蛋白水解物组改善更明显(见表2、表3)。
2.4 安全性
安全性评估包括了被随机分配到这个研究中的所有患者。在两组中,药物不良反应的发生率非常低,绝大多数不良反应是轻微的、短暂的,脑蛋白水解物组8个患者(8.3%),对照组7例患者(7.45%)出现不良反应,两组不良反应的发生率没有统计学差别。最常见的不良反应是头晕、头痛、无力,在两组中由于不良反应终止研究的患者数是相似的,其中脑蛋白水解物组3例(3.12%),对照组 2例(2.12%)。实验室检查结果(血液学、临床生化、尿液分析)显示从基线到90 d两组之间没有明显的差别。在此项研究中,无1例死亡。
表1 两组的人口统计学特征和卒中类型()
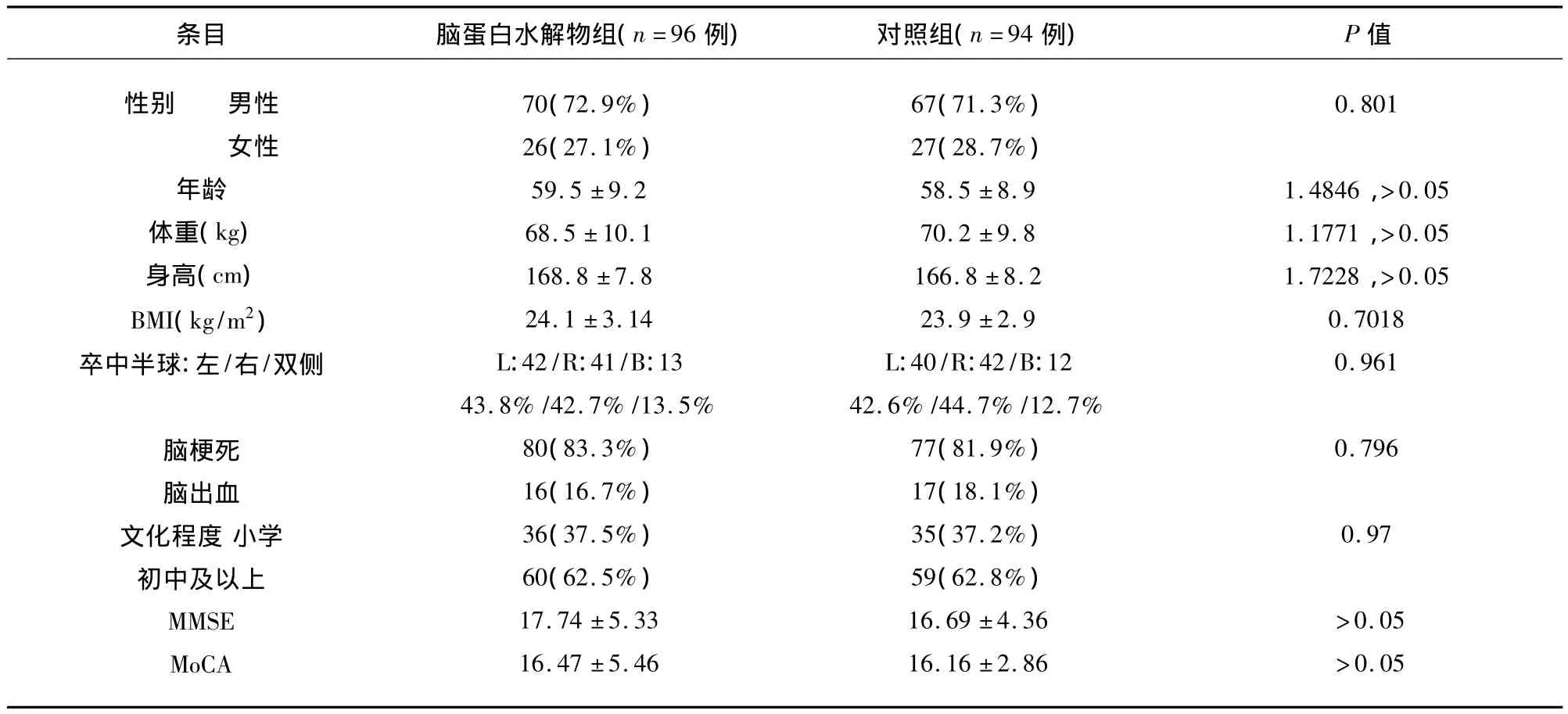
表1 两组的人口统计学特征和卒中类型()
条目 脑蛋白水解物组(n=96例) 对照组(n=94例) P值性别 男性女性年龄体重(kg)身高(cm)BMI(kg/m2)卒中半球:左/右/双侧脑梗死脑出血文化程度小学初中及以上MMSE MoCA 70(72.9%)26(27.1%)59.5 ±9.2 68.5 ±10.1 168.8 ±7.8 24.1 ±3.14 L:42/R:41/B:13 43.8%/42.7%/13.5%80(83.3%)16(16.7%)36(37.5%)60(62.5%)17.74 ±5.33 16.47 ±5.46 67(71.3%)27(28.7%)58.5 ±8.9 70.2 ±9.8 166.8 ±8.2 23.9 ±2.9 L:40/R:42/B:12 42.6%/44.7%/12.7%77(81.9%)17(18.1%)35(37.2%)59(62.8%)16.69 ±4.36 16.16 ±2.86 0.801 1.4846,>0.05 1.1771,>0.05 1.7228,>0.05 0.7018 0.961 0.796 0.97>0.05>0.05
表2 脑蛋白水解物组和对照组不同时间点的MoCA评分()
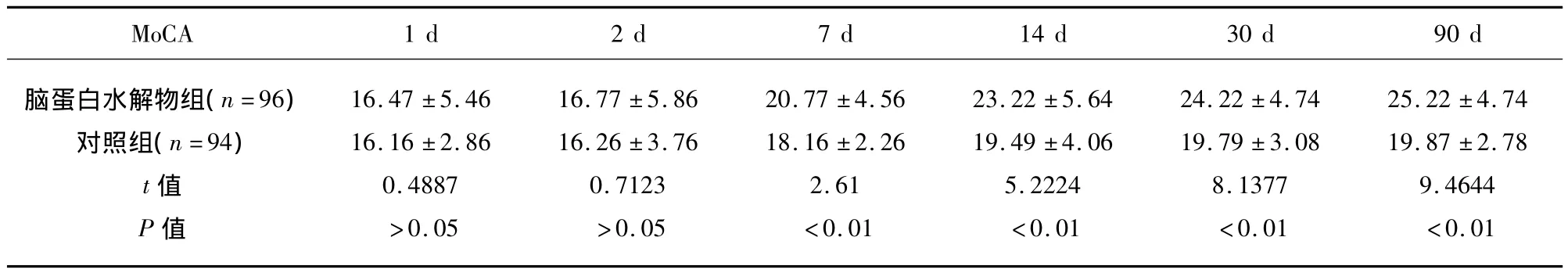
表2 脑蛋白水解物组和对照组不同时间点的MoCA评分()
MoCA 1 d 2 d 7 d 14 d 30 d 90 d脑蛋白水解物组(n=96)对照组(n=94)t值P值16.47 ±5.46 16.16 ±2.86 0.4887>0.05 16.77 ±5.86 16.26 ±3.76 0.7123>0.05 20.77 ±4.56 18.16 ±2.26 2.61<0.01 23.22 ±5.64 19.49 ±4.06 5.2224<0.01 24.22 ±4.74 19.79 ±3.08 8.1377<0.01 25.22 ±4.74 19.87 ±2.78 9.4644<0.01
表3 脑蛋白水解物组和对照组不同时间点的MMSE评分()
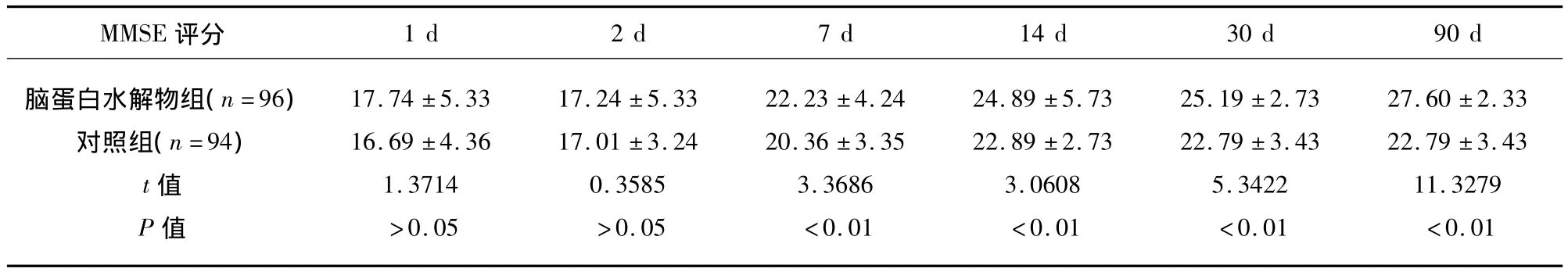
表3 脑蛋白水解物组和对照组不同时间点的MMSE评分()
MMSE评分1 d 2 d 7 d 14 d 30 d 90 d脑蛋白水解物组(n=96)对照组(n=94)t值P值17.74 ±5.33 16.69 ±4.36 1.3714>0.05 17.24 ±5.33 17.01 ±3.24 0.3585>0.05 22.23 ±4.24 20.36 ±3.35 3.3686<0.01 24.89 ±5.73 22.89 ±2.73 3.0608<0.01 25.19 ±2.73 22.79 ±3.43 5.3422<0.01 27.60 ±2.33 22.79 ±3.43 11.3279<0.01
3 讨论
目前国内脑血管病发病率逐年增高,无论是脑梗死或脑出血都有可能并发卒中后认知功能障碍,且有国外文献[11,12]报道卒中后患痴呆的风险较前加倍,而且从轻度认知损害发展至痴呆的风险较前明显增加。有文献表明胆碱酯酶抑制剂和美金刚对血管性痴呆的疗效并不确定,因为这些药物仅能在短期内改善患者的症状。找到一种安全且可长期改善认知功能障碍患者认知功能的药物对认知功能障碍患者的治疗尤为关键。
有研究表明[13]:脑蛋白水解物注射液对中重度卒中患者有较好的疗效,且安全性及耐受性良好。本研究旨在探讨脑蛋白水解物对卒中后认知功能障碍患者的疗效及安全性。所纳入的卒中后认知功能障碍患者不仅包括脑梗死,也包括脑出血患者,研究范围较前扩大[10]。对所有研究对象采用随机数字表的方法随机分组。意向处理[14](Intention-to-Treat,ITT)分析是随机对照试验设计、实施和分析过程中的一种策略。本研究采用了ITT分析评估脑蛋白水解物注射液对卒中后认知功能障碍的疗效,分别对由于失访和不良反应而终止的患者,采用失访者最后一次测量结果及在整个研究期间尽可能随访其结局,以保证真正达到随机分组的目的,并能真实地反映脑蛋白水解物注射液在临床实际中的效果。
脑蛋白水解物是猪蛋白中提取的一种肽制剂,含有水溶性氨基酸及低分子神经肽,是目前唯一含有神经营养因子活性片段的产品,具有内源性神经营养因子活性,能以多种方式作用于中枢神经。本品容易通过血脑屏障,促进脑内蛋白质的合成,促进呼吸链功能,促进脑细胞DNA合成及修复与再生,促进突触的形成,诱导神经元的分化,刺激脑内有关激素产生,改善神经递质的作用,改善脑内酶的活性,终止紊乱的酶代谢,增加脑组织糖的转化和利用,抑制钙激活蛋白酶(Calpain)活性,抑制谷氨酸的兴奋毒性,对缺氧的脑组织有良好的保护作用,能有效的保护中枢神经系统免受毒物损害,因此具有调节和改善神经元的代谢,提高脑氧葡萄糖利用度,增强脑功能供给脑细胞修复及再生所需的各种氨基酸,增强神经重塑、刺激神经发生,阻止脑损伤的进展的功能,从而改善认知、语言及运动功能[15~18]。
在整个观察期间,脑蛋白水解物组和对照组都能观察到认知功能的改善,但是脑蛋白水解物组改善更明显。脑蛋白水解物组和对照组的MoCA及MMSE评分在入院后2 d,其差异无统计学意义,随着治疗时间的延长,其差异逐渐明显,有统计学意义。说明用脑蛋白水解物治疗卒中后认知功能障碍在短期内不会产生明显疗效,需要一定的疗程,其疗效才会显现出来。并且脑蛋白水解物组在治疗中断后,仍可观察到认知功能的改善。脑蛋白水解物的远期疗效是与脑蛋白水解物尽人皆知的神经营养活性相一致的。在对照组,认知功能也逐渐改善可能是由于在对照组也同时治疗血管危险因素和伴随疾病[19]。
卒中后认知功能障碍的患者常常有许多合并症,并且同时在应用其他的药物,是非常脆弱的群体。因此,对这些患者来说,药物干预的安全性就显得格外重要。在这个试验中,两组患者药物不良反应的发生率非常低,绝大多数不良反应是轻微的、短暂的。总之,在这个研究中,脑蛋白水解物治疗是安全的,有很好的耐受性。
综上所述,这个临床试验的研究结果显示对卒中后认知功能障碍的患者,脑蛋白水解物在每天30 ml剂量下是安全、有效的,这些疗效可以至少持续90 d。在积极治疗(14 d)后,认知功能不断改善,其疗效可持续10 w。脑蛋白水解物是针对卒中后认知功能障碍的病理生理机制进行干预,其疗效远远超过了对症治疗的范围[20],且药品安全有效,效果持久,值得在临床推广使用。
[1]Vermeer SE,Prins ND,den Heijer T,et al.Silent brain infarcts and the risk of dementia and cognitive decline[J].N Engl J Med,2003,348(13):1215-1222.
[2]Sturm JW,Donnan GA,Dewey HM,et al.Quality of life after stroke:the North East Melbourne Stroke Incidence Study(NEMESIS)[J].Stroke,2004,35(10):2340 -2345.
[3]Stephens S,Kenny RA,Rowan E,et al.Association between mild vascular cognitive impairment and impaired activities of daily living in older stroke survivors without dementia[J].J Am Geriatr Soc,2005,53(1):103-107.
[4]Rockwood K,Wentzel C,Hachinski V,et al.Prevalence and outcomes of vascular cognitive impairment.Vascular Cognitive Impairment Investigators of theCanadian Study of Health and Aging[J].Neurology,2000,54(2):447 -451.
[5]Hong Z,Zhu GX,Chen HB,et al.The clinical efficacy of Cerebrolysin in the treatment of acute ischemic stroke[J].Chin J Geriatr Heart BrainVessel Dis,2005,7:331 -333.
[6]Skvortsova VI,Stakhovskaia LV,Gubski LV,et al.A randomized,double-blind,placebo-controlled study of Cerebrolysin safety and efficacy in the treatment of acute ischemic stroke[J].Zh Nevrol Psikhiatr Im S S Korsakova,2004,(Suppl 11):51 -55.
[7]Shamalov NA,Stakhovskaia LV,Burenchev DV,et al.The effect of cerebrolysin in dosage 50 ml on the volume of lesion in ischemic stroke[J].Zh Nevrol Psikhiatr Im S S Korsakova,2010,110(12 Pt 2):34-37.
[8]Skvortsova VI,Shamalov NA,Stakhovskaya LV,et al.Cerebrolysin in acute ischemic stroke:results of randomized,double-blind,placebocontrolled study[J].Cerebrovasc Dis,2005,19(Suppl 2):76.
[9]Ladurner G,Kalvach P,Moessler H.Neuroprotective treatment with cerebrolysin in patients with acute stroke:a randomised controlled trial[J].J Neural Transm,2005,112:415 -428.
[10]Guekht AB,Moessler H,Novak PH,et al.Cerebrolysin in vascular dementia:improvement of clinical outcome in a randomized,doubleblind,placebo-controlled multicenter trial[J].J Stroke Cerebrovasc Dis,2011,20(4):310 -318.
[11]Pendlebury ST,Rothwell PM.Prevalence,incidence,and factors associated with pre-stroke and post-stroke dementia:a systematic review and meta-analysis[J].Lancet Neurol,2009,8(11):1006 -1018.
[12]Leys D,Hénon H,Mackowiak-Cordoliani MA,et al.Poststroke dementia[J].Lancet Neurol,2005,4(11):752 - 759.
[13]Heiss WD,Brainin M,Bornstein NM,et al.Cerebrolysin in patients with acute ischemic stroke in Asia:results of a double-bind,placebocontrolled randomized trial[J].Stroke,2012,43(3):630 -636.
[14]刘 鸣,张世洪.临床试验中的意向处理分析[J].英国医学杂志中文版,2001,4(4):223 -224.
[15]潘均喜.胞二磷胆碱联合脑蛋白水解物治疗老年性痴呆56例[J].广西医学,2008,30(9):1044-1045.
[16]Baskys A,Wojtowiez JN.Aetlons 0f organ derived preparations on synaptie transmission in the hippoemnpus[J].Neuroiol Aging,1992,13(3):128.
[17]Shimazu S,Taehikawa N,Iwamoto N,et al.The neurotrophic and brain protective effect 0f cerebolysin[J].Neurobiol Aging,1992,13(6):50.
[18]王辉兰.脑蛋白水解物治疗帕金森病痴呆30例[J].实用医学杂志,2010,26(11):2013 -2015.
[19]Kittner B,De Deyn PP,Erkinjunnti T.Investigating the natural course and treatment of vascular dementia and Alzheimer’s disease:Parallel study populations in two randomized,placebo-controlled trials[J].Ann NY Acad Sci,2000,903:535 -541.
[20]Alvarez X,Cacabelos R,Laredo M,et al.A 24-week,double-blind,placebo-controlled study of three dosages of cerebrolysin in patients with mild to moderate Alzheimer’s disease[J].Eur J Neurol,2006,13:43-54.
