颅内血管狭窄对脑梗死后进展性运动功能缺损的预测价值
2014-08-11曹树刚葛婷婷徐文安
曹树刚,葛婷婷,徐文安,赵 昊,吴 倩,贺 军,王 建
进展性运动功能缺损(progressive motor deficits,PMD)是指缺血性卒中后5天内美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)中运动项目评分增加≥2分,且持续至少24 h[1],它主要研究的是局灶性运动功能恶化。由于持续的运动功能缺损是脑梗死患者严重残疾的主要原因之一,有关PMD预测因素的研究一直是国内外学者探讨的热点,以期寻找到能减少早期神经功能恶化的干预靶点[2~6]。以往的研究多关注于临床和生化指标,但迄今为止尚未找到可有效应用于临床的预测指标。近年来随着神经影像学的发展,有研究表明颅内动脉狭窄或闭塞有可能预测进展性卒中的发生,但相关研究较少,证据仍不充分[7~9]。因此,本研究拟通过分析幕上皮质下脑梗死患者的磁共振血管造影(magnetic resonance angiography,MRA)特点,探讨颅内动脉狭窄对脑梗死后PMD的预测价值。
1 资料与方法
1.1 研究对象
连续收集2011年6月~2013年6月在安徽医科大学附属合肥医院神经内科住院治疗的幕上皮质下脑梗死患者133例。纳入标准:(1)发病后24 h内入院,临床症状表现为运动或感觉、运动功能缺失;(2)72 h内完成头颅MRI+MRA检查,梗死部位经弥散加权成像(diffusion-weighted imaging,DWI)证实为幕上皮质下急性梗死灶;(3)所有病例均符合全国第四届脑血管病会议制订的脑梗死诊断标准。排除标准:瘤卒中、出血性卒中、心源性脑栓塞、伴严重的心肝肾疾病、年龄>80岁和(或)伴严重痴呆者、有意识障碍或进展后出现意识障碍、及有皮质缺失症状如失语、失用、偏身忽视、视野缺失等。
1.2 研究方法
1.2.1 一般资料 详细记录患者的性别、年龄、吸烟、既往史[包括高血压病、糖尿病、血脂异常、卒中史(脑梗死、脑出血或TIA史)]、发病至入院时间、入院时血压水平。
1.2.2 MRI及 MRA检查 本研究利用德国Siemens 1.5T超导型磁共振,型号为 AvantoⅠclass。所有患者均于发病72 h内完成头颅MRI+MRA扫描,行垂直脑干轴位常规自旋回波(SE)序列T1WI与 T2WI、液体衰减反转恢复(FLAIR)、DWI、MRA。以医院Anet PACS系统为平台分析图像,记录新发梗死部位、评价颅内血管狭窄或闭塞情况,主要评估病灶侧颈内动脉(internal carotid artery,ICA)海绵窦段和床突上段、大脑中动脉(middle cerebral artery,MCA)M1和M2段、大脑前动脉(anterior cerebral artery,ACA)A1和A2段、大脑后动脉(posterior cerebral artery,PCA)P1和P2段。血管狭窄指狭窄率≥50%,测量标准:狭窄率 =[(Da-Db)/Da]×100%,Da代表正常血管直径,Db代表狭窄部位的直径,Da选取标准为该动脉段内狭窄近端正常动脉的最宽处,如狭窄近端发生病变,则选取该动脉段内狭窄远端正常动脉的最宽处进行测量。
1.2.3 神经功能评分 所有患者均于入院1 d、2 d、3 d、4 d、5 d 及 7 d 的同一时间由同一检查者重复NIHSS评分,记录入院时NIHSS运动项目评分,根据病情特点及 NIHSS中运动项目评分,将患者分为PMD组和稳定组。脑梗死后5 d内NIHSS运动项目评分增加≥2分,且持续>24 h者为PMD组,其余为稳定组。
1.3 统计学分析
采用SPSS18.0软件包进行统计学处理。符合正态分布的计量资料用表示,组间比较采用两独立样本t检验,不符合正态分布的计量资料以中位数、四分位间距表示,组间比较采用 Mann-WhitneyU秩和检验;计数资料用率表示,组间比较采用χ2检验。P<0.10的变量纳入二分类logistic回归模型,结果表达采用OR值和95%CI,P<0.05为有统计学意义。
2 结果
依据入选标准及排除标准筛选病例,最终纳入133例幕上皮质下梗死患者,其中男85例,女48例,年龄最小30岁,最大80岁,平均年龄65±11岁。符合PMD诊断的有30例,稳定组103例。
2.1 两组患者基线资料比较
PMD组中卒中史患者比例显著低于稳定组(10.0% ∶34.0%,P < 0.05),而年龄、性别、高血压、糖尿病、血脂异常、发病至入院时间、入院时血压水平、基线NIHSS运动评分与稳定组比较差异均无统计学意义(P>0.05)(见表1)。
2.2 两组患者颅内血管狭窄或闭塞比较
两组比较,PMD组中ICA与MCA狭窄或闭塞患者比例均高于稳定组(分别为50.0%∶26.2%、38.6%∶20.9%),差异均有统计学意义(P<0.05),而PMD组中ACA与PCA狭窄或闭塞患者比例与稳定组比较无统计学意义(分别为42.3%∶28.2%、50.0%∶46.6%,P 均 >0.05)(见表 2)。
2.3 多因素logistic回归分析结果
以PMD为应变量,表1、表2中P<0.10的变量作为自变量纳入多因素logistic回归模型,共有5个自变量,即卒中史、入院收缩压、入院舒张压、ICA与MCA狭窄或闭塞,结果显示仅MCA狭窄或闭塞(OR 4.122,95%CI:1.258 ~13.502;P=0.019)是幕上皮质下急性脑梗死后PMD的独立预测因素(见表3)。
3 讨论
颅内动脉粥样硬化引起的动脉狭窄或闭塞是造成脑梗死的主要原因之一,且在亚洲人群脑梗死患者中颅内动脉狭窄更为常见[10,11]。数字减影血管造影术(digital substraction angiography,DSA)长期以来被认为是评价颅内动脉狭窄和闭塞的金标准,但DSA是一种有创性检查,操作技术要求严格,有发生并发症的风险,且费用较高,不可能广泛进行。而MRA是评价颅内外血管病变的一种快捷的非侵入性技术,也可较清晰的评价颅内血管狭窄和闭塞程度,是目前广泛用来评价血管病变的影像技术。因此本研究采用MRA评价颅内血管狭窄程度,经分析显示颅内血管狭窄与幕上皮质下脑梗死后PMD存在显著相关性,MCA狭窄或闭塞(OR 4.122,P=0.019)是幕上皮质下脑梗死后PMD的独立预测因素,虽然ICA狭窄或闭塞在单因素分析时有统计学意义,但校正混杂因素后未见显著相关性。
表1 两组患者的基线资料比较()
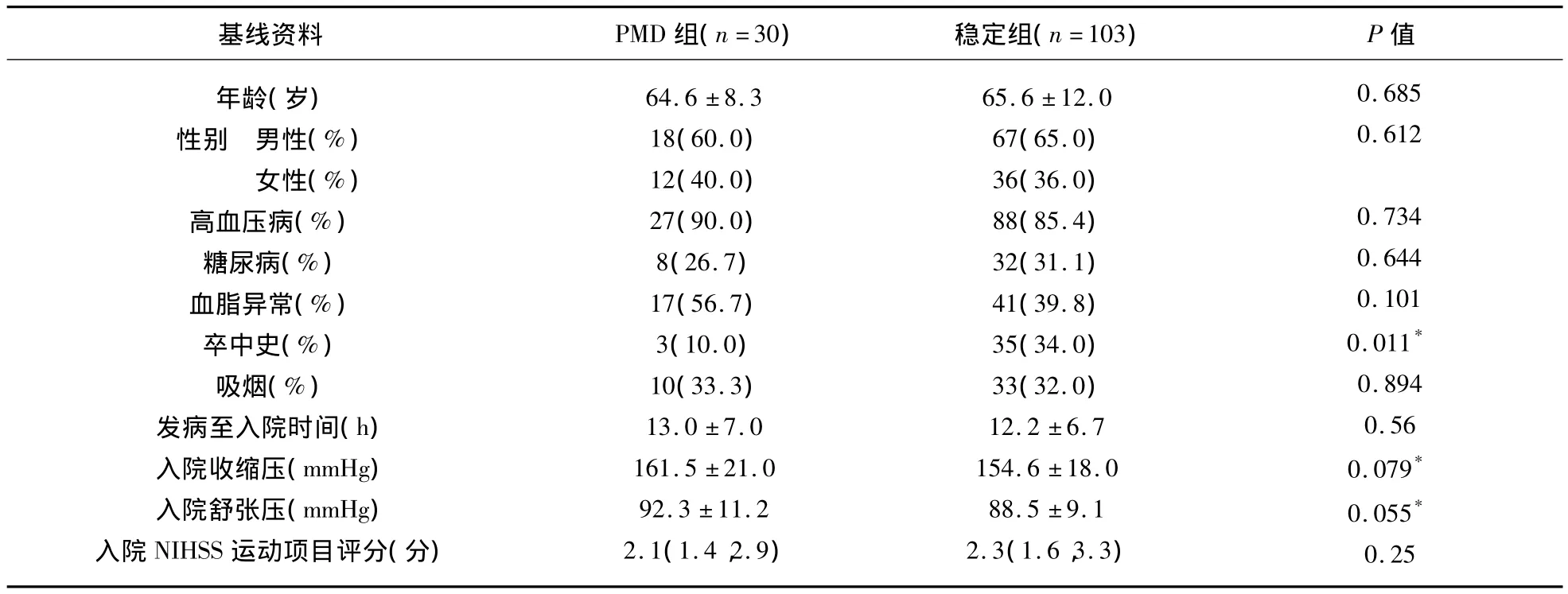
表1 两组患者的基线资料比较()
*P<0.10的变量纳入多因素logistic回归分析
基线资料 PMD组(n=30) 稳定组(n=103) P值0.685 0.612 0.734 0.644 0.101 0.011*0.894 0.56 0.079*0.055*0.25年龄(岁)性别 男性(%)女性(%)高血压病(%)糖尿病(%)血脂异常(%)卒中史(%)吸烟(%)发病至入院时间(h)入院收缩压(mmHg)入院舒张压(mmHg)入院NIHSS运动项目评分(分)64.6 ±8.3 18(60.0)12(40.0)27(90.0)8(26.7)17(56.7)3(10.0)10(33.3)13.0 ±7.0 161.5 ±21.0 92.3 ±11.2 2.1(1.4,2.9)65.6 ±12.0 67(65.0)36(36.0)88(85.4)32(31.1)41(39.8)35(34.0)33(32.0)12.2 ±6.7 154.6 ±18.0 88.5 ±9.1 2.3(1.6,3.3)
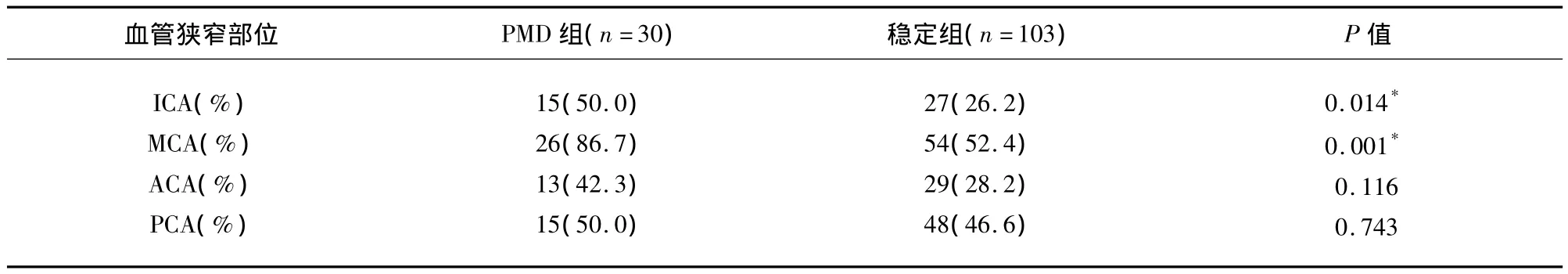
表2 颅内血管狭窄或闭塞比较
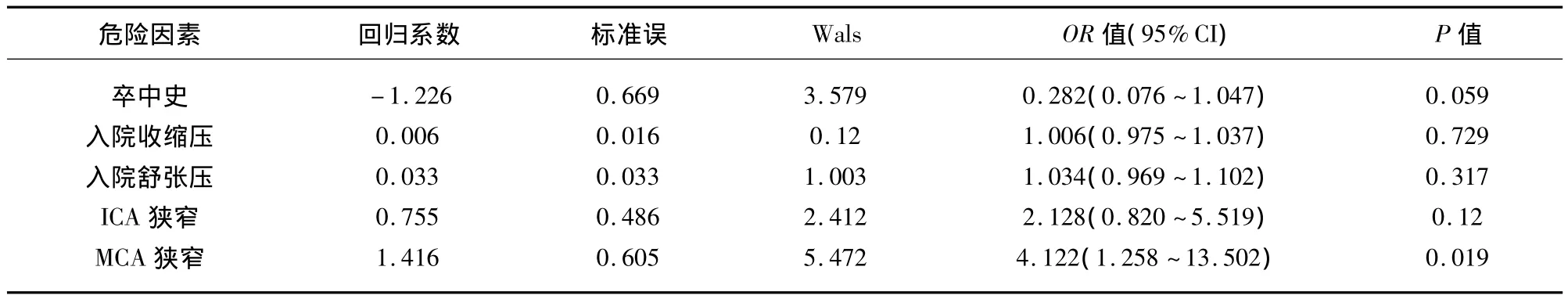
表3 多因素Logistic回归分析
动脉粥样硬化性颅内动脉狭窄(intracranial atherosclerotic stenosis,ICAS)是全球范围内缺血性脑卒中的重要病因,尤其是在中国和其他亚洲人群中更为突出[11]。血管影像学研究发现ICAS发生率高于颅外动脉狭窄,其中以MCA狭窄最为常见,ICAS的自然病程有进展性和多部位损害的特点,颅内动脉粥样性斑块导致的管腔狭窄、斑块中脂质成分比例和斑块内新生血管形成对导致临床缺血事件起重要作用[12]。ICA来源的栓子导致MCA栓塞性闭塞与MCA粥样硬化性血管狭窄和闭塞是该区域脑梗死的重要原因。其导致脑梗死的类型取决于血流变化、侧枝循环代偿程度以及脑梗死的发病机制[11]。Wong等研究发现,中重度MCA狭窄发生急性脑梗死的最常见病理生理机制是单个穿支动脉闭塞,导致小的皮层下梗死;动脉到动脉栓塞伴栓子清除障碍,主要导致分水岭区多发小灶梗死[13]。有研究证实,ICA和MCA狭窄的严重程度是预示脑梗死发生及再发的独立危险因素,提示血管狭窄及低灌注对于脑梗死的重要性[14]
颅内血管狭窄或闭塞既是急性脑梗死的病理学基础,也是发生 PMD 的病变基础[7,8]。颅内动脉狭窄导致PMD的发生机制主要有:(1)在颅内动脉粥样硬化斑块性狭窄的基础上,原位血栓的蔓延产生新的狭窄或使原有受累血管进一步狭窄或闭塞,或通过阻断侧支血管使侧支循环消失;(2)栓子脱落致梗死脑组织相同的供血动脉或邻近穿支动脉发生再栓塞致原有脑梗死范围扩大或新的脑梗死发生,与病变血管的狭窄程度及颅内动脉粥样硬化斑块脱落有关;(3)由于狭窄远端降低的血流导致侧枝循环差,脑梗死的缺血半暗带范围易受其他因素如血压和侧枝循环的影响发生不可逆的扩大,诱发细胞凋亡致使神经功能缺损进一步恶化;(4)原发梗死区域虽无扩大,但脑水肿逐渐扩散加重神经功能缺损程度。因此,在颅内血管狭窄的前提下,影响进展的因素取决于侧枝循环是否丰富、病变程度以及血流动力学情况[8]。本组研究显示MCA狭窄或闭塞是幕上皮质下脑梗死发生PMD独立的危险因素,考虑与MCA是幕上皮质下梗死部位的主要供血动脉有关,因为本研究的研究对象主要是放射冠、基底核、内囊和丘脑部位的脑梗死患者。当MCA狭窄或闭塞后,其深穿支动脉区域脑血流可急剧下降,故可影响血流动力学状态,导致MCA区域脑梗死患者的神经功能恶化。Weimar等[7]一项大样本研究显示,经血管超声诊断的颈动脉闭塞和MCA的M1段闭塞是脑梗死后神经功能恶化(NIHSS评分增加≥4分)的独立危险因素,推测当大血管狭窄或闭塞而缺乏有效侧枝循环或周边没有有效的侧枝循环建立时,此种状况可能导致脑缺血区域扩大,在临床上表现为卒中进展。但也有研究与此观点不同,Nagakane等[9]对61例急性脑梗死患者进行的研究发现,16例进展性卒中患者有2例存在ICA狭窄,3例存在MCA狭窄,而非进展性卒中患者中有6例存在ICA狭窄,7例存在MCA狭窄,经分析发现颅内动脉狭窄与卒中进展无关,但该研究的样本量较小,且为单因素分析。虽然ICA是MCA的源动脉,但本研究未能证实ICA是幕上皮质下脑梗死发生PMD的独立危险因素,可能与本研究例数有限、研究对象仅是幕上皮质下脑梗死患者有关。
此外,本研究单因素分析发现PMD组卒中史患者所占比例低于稳定组,差异有统计学意义。关于卒中史与脑梗死及卒中进展的关系一直就存在争议。以往研究多认为卒中史是脑梗死及早期神经功能恶化的危险因素,其原因考虑与导致动脉粥样硬化进展的危险因素未被有效控制有关。但近年来有关TIA及缺血耐受的研究认为,给予动物一次或多次短暂性全脑或局灶性缺血对间隔一定时间后的严重脑缺血有保护作用,表现为可使缺血性损伤体积缩小、神经元凋亡减少、血管内皮细胞得到保护和炎症反应减轻,从而使神经功能缺损程度减轻。脑梗死前无TIA的患者人院时临床症状多较重,容易出现神经功能恶化、预后较差。然而在多因素分析中并未证实卒中史是脑梗死后PMD的保护因素,可能与研究人群、样本量以及把脑出血、脑梗死和TIA史合并分析有关,有待进一步改进研究方法继续探讨。
综上可见,颅内动脉狭窄是幕上皮质下脑梗死后PMD的重要危险因素,尤其是MCA狭窄或闭塞可作为脑梗死后PMD发生的预测指标之一,早期药物干预或介入治疗有可能防止或预防卒早期神经功能恶化。
[1]Kim YB,Moon HS,Suh BC,et al.Topographic patterns and stroke subtypes according to progressive motor deficits in lacunar syndrome[J].J Stroke Cerebrovasc Dis,2011,20(4):352 -356.
[2]Miyamoto N,Tanaka Y,Ueno Y,et al.Demographic,clinical,and radiologic predictors of neurologic deterioration in patients with acute ischemic stroke[J].J Stroke Cerebrovasc Dis,2013,22(3):205 -210.
[3]Kim JT,Yoon GJ,Nam TS,et al.Internal border zone lesions as a predictor of early neurological deterioration in minor stroke patients with severe arterial steno-occlusion[J].J Neuroimaging,2011,21(2):173-176.
[4]Ohara T,Yamamoto Y,Tamura A,et al.The infarct location predicts progressive motor deficits in patients with acute lacunar infarction in the lenticulostriate artery territory[J].J Neurol Sci,2010,293(1):87-91.
[5]Takase K,Murai H,Tasaki R,et al.Initial MRI findings predict progressive lacunar infarction in the territory of the lenticulostriate artery[J].Eur Neurol,2011,65(6):355 -360.
[6]Kim SK,Song P,Hong JM,et al.Prediction of progressive motor de?cits in patients with deep subcortical infarction[J].Cerebrovasc Dis,2008,25(4):297 -303.
[7]Weimar C,Mieck T,Buchthal J,et al.Neurologic worsening during the acute phase of ischemic stroke[J].Arch Neurol,2005,62(3):393-397.
[8]Ois A,Martinez-Rodriguez JE,Munteis E,et al.Steno-occlusive arterial disease and early neurological deterioration in acute ischemic stroke[J].Cerebrovasc Dis,2008,25(1 -2):151 -156.
[9]Nagakane Y,Naritomi H,Oe H,et al.Neurological and MRI findings as predictors of progressive-type lacunar infarction[J].Eur Neurol,2008,60(3):137 -141.
[10]Wong KS.Global burden of intracranial atherosclerosis[J].Intern J Stroke,2006,1(3):158 -159.
[11]陈向燕,程 忻,范玉华,等.症状性动脉粥样硬化性颅内动脉狭窄中国专家共识[J].中国神经精神疾病杂志,2012,38(3):129-145.
[12]Chen XY,Wong KS,Lan WW,et al.Middle cerebral artery atherosclerosis:histological comparison between plaque associated with and not associated with infarct in a postmortem study[J].Cerebrovasc Dis,2007,25(1 -2):74 -80.
[13]Wong KS,Gao S,Chan YL,et al.Mechanisms of acute cerebral infarctions in patients with middle cerebral artery stenosis:a diffusionweighted imaging and microemboli monitoring study[J].ANN Neurol,2002,52(1):74 - 81.
[14]Kasner SE,Chimowitz MI,Lynn MJ,et al.Predictors of ischemic stroke in the territory of a symptomatic intracranial artery stenosis[J].Circulation,2006,113(4):555 -563.
