不同植物对禾谷缢管蚜酯酶和乙酰胆碱酯酶活性的诱导作用
2014-08-10谢佳燕
林 佳, 谢佳燕
(武汉轻工大学生物与制药工程学院,武汉 430023)
不同植物对禾谷缢管蚜酯酶和乙酰胆碱酯酶活性的诱导作用
林 佳, 谢佳燕*
(武汉轻工大学生物与制药工程学院,武汉 430023)
采用生化分析方法研究了取食不同植物对禾谷缢管蚜酯酶、乙酰胆碱酯酶活性及对吡虫啉敏感性的影响。结果发现,取食不同植物的禾谷缢管蚜的酯酶活性存在显著差异,但其乙酰胆碱酯酶活性无显著差异。取食不同寄主植物的禾谷缢管蚜对吡虫啉的敏感性也存在显著差异,且与其酯酶活性的变化规律相一致。结果表明寄主植物可诱导禾谷缢管蚜体内酯酶活性的改变,从而影响其对吡虫啉敏感性的变化,但寄主植物对其乙酰胆碱酯酶活性无明显影响。
寄主植物; 禾谷缢管蚜; 吡虫啉; 酯酶; 乙酰胆碱酯酶
植物是植食性昆虫赖以生存的场所,在植物与害虫的协同进化过程中,植物产生化学防御物质抵御害虫侵害;同时,害虫也能不断适应植物分泌的有毒代谢物,诱导其体内相关酶系来克服食物中的潜在毒性[1-3]。研究发现,植食性昆虫体内的解毒酶活性可被寄主植物中的次生物质诱导激活或抑制,最终还可导致昆虫对杀虫剂敏感性的改变[4]。禾谷缢管蚜[Rhopalosiphumpadi(L.)]是我国长江流域麦区的重要害虫,可直接造成麦类作物的大量减产[5]。禾谷缢管蚜具有广泛的寄主范围,可严重为害小麦、大麦、玉米等主要农作物及其他多种禾本科、莎草科和香蒲科植物[6]。蚜害在我国麦田已连续多年严重发生,由于麦蚜的生物学特征及其在不同寄主间的迁飞转换,加之长期的化学防治和不合理用药,导致作物农药残留和害虫抗药性增加的问题越来越突出[5,7]。害虫抗药性的产生与其解毒酶和靶标酶活力的改变密切相关[8];此外,昆虫取食不同植物中次生物质种类和含量多样性的差异, 也可对害虫的抗药性产生明显影响[4]。研究发现不同寄主植物对禾谷缢管蚜发育历期、繁殖、寿命、内禀增长率等生物学参数及嗅觉反应均可产生明显的影响[9-10],但寄主植物对禾谷缢管蚜药剂敏感性及其相关酶活性影响的研究较少。因此,本研究通过检测田间取食不同寄主植物禾谷缢管蚜体内的相关酶活性,分析其与对杀虫剂敏感性变化间的关系,以期了解田间取食不同植物的禾谷缢管蚜抗性改变的机制,为在田间进行综合防治提供理论和实践依据。
1 材料和方法
1.1 供试昆虫
禾谷缢管蚜分别于2011年4-6月采自武汉市郊麦田内取食小麦(TriticumaestivumLinn.)、燕麦(AvenasativaLinn.)及鹅观草(RoegneriakamojiOhwi)的无翅成蚜。
1.2 试剂及药剂
10%吡虫啉(imidacloprid)可湿性粉剂,陕西省西安喷得绿农化有限公司;α-乙酸萘酯、考马斯亮蓝G-250、固蓝B盐均为国药集团化学试剂有限公司产品;乙酰胆碱酯酶(T-CHE)测试盒,南京建成生物工程研究所产品。
1.3 生物测定
药膜法参照McKenzie 等[11]的方法进行了改进。用丙酮作对照,每瓶放25~30头无翅成蚜,每个浓度重复3次。5 h后检查死虫数(死亡标准为轻触时虫体不动),计算死亡百分率。
1.4 酯酶活力测定
挑选大小一致的无翅成蚜约50头,加入pH 7.0的0.1 mol/L磷酸缓冲液冰浴匀浆,制备酶液冰浴备用。酯酶活力测定参照Abdel-Aal 等[12]的方法,酶活力测定重复3次。
1.5 乙酰胆碱酯酶(AChE)活力测定
采用南京建成生物工程研究所的乙酰胆碱酯酶(T-CHE)测试盒,依据说明书进行检测,酶活力测定重复3次。
1.6 蛋白质含量测定
参照Bradford[13]的方法,用牛血清白蛋白(BSA)作标准曲线。
1.7 数据分析
数据处理采用Excel软件,毒力回归方程的计算、单因素方差分析以及不同平均值间进行Duncan’s test分析均采用SPSS 14.0 软件。
2 结果与分析
2.1 生物测定
取食不同寄主植物的禾谷缢管蚜对吡虫啉的敏感性见表1。结果表明,吡虫啉对禾谷缢管蚜的毒力效应因取食寄主植物不同而异。其中,取食小麦的禾谷缢管蚜的半数致死浓度(LC50)最低,取食鹅观草的最高。取食燕麦和鹅观草的禾谷缢管蚜的LC50分别是取食小麦的1.63和2.21倍。
表1吡虫啉对取食不同寄主植物禾谷缢管蚜的毒力效应
Table1ToxicityofimidaclopridtoRhopalosiphumpadiondifferenthostplants
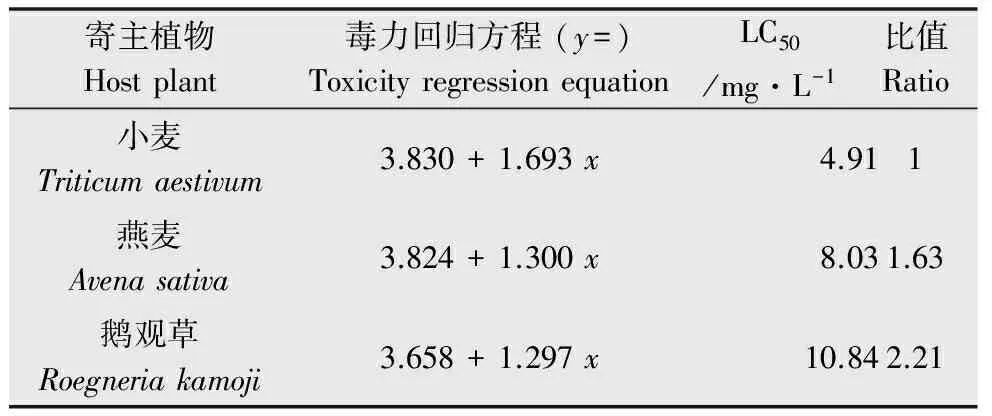
寄主植物Hostplant毒力回归方程(y=)ToxicityregressionequationLC50/mg·L-1比值Ratio小麦Triticumaestivum3.830+1.693x4.911燕麦Avenasativa3.824+1.300x8.031.63鹅观草Roegneriakamoji3.658+1.297x10.842.21
2.2 取食不同植物的禾谷缢管蚜的酯酶活力
取食不同植物的禾谷缢管蚜的酯酶活力见图1。结果表明,取食不同寄主植物的禾谷缢管蚜其酯酶活力存在显著差异 (F0.05(2, 6)=52.80,P=0.00)。取食鹅观草的禾谷缢管蚜其酯酶活力分别是取食小麦和燕麦的1.96 和1.71倍,统计分析表明两者之间存在极显著差异(P<0.01, Duncan’s test),但取食小麦与燕麦的禾谷缢管蚜间的酯酶活力无明显差异(P>0.05, Duncan’s test)。将取食不同寄主植物禾谷缢管蚜的酯酶活力与吡虫啉对其的LC50相比,发现不同寄主禾谷缢管蚜酯酶活性的变化规律与其对吡虫啉的敏感性变化相一致。
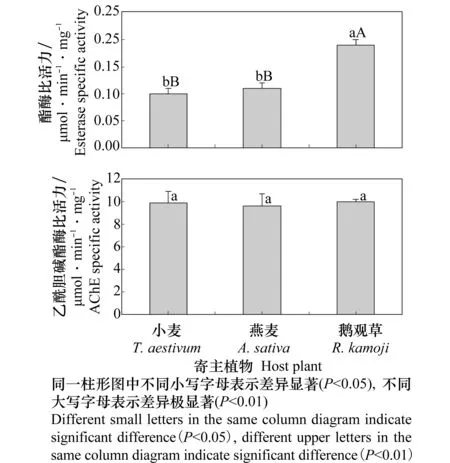
图1 取食不同寄主植物禾谷缢管蚜的酯酶(上)和乙酰胆碱酯酶活力(下)
2.3 取食不同植物的禾谷缢管蚜的乙酰胆碱酯酶活力
取食不同植物的禾谷缢管蚜的乙酰胆碱酯酶活力见图1。结果表明,禾谷缢管蚜取食3种不同植物后,其乙酰胆碱酯酶活力在不同寄主植物间无显著差异 (F0.05(2, 6)=0.05,P=0.95)。将取食不同寄主植物禾谷缢管蚜的乙酰胆碱酯酶活力与吡虫啉对其的LC50值相比,未发现两者间具有明显的相关性。
3 讨论
取食不同寄主植物的昆虫,可对其体内的相关酶活性产生不同的影响[14-15]。取食4种不同植物的B 型烟粉虱(Bemisiatabaci)其羧酸酯酶与谷胱甘肽-S-转移酶活力均存在显著差异[16]。东方虎凤蝶(PapilioglaucusglaucusL.)取食不同植物后,其可溶性酯酶和微粒体酯酶活性也存在明显差异,表明不同寄主植物对不同酯酶的诱导水平不同[17]。本研究也发现,田间取食3种不同植物的禾谷缢管蚜,其酯酶活力间存在显著差异,但其乙酰胆碱酯酶活力间无明显影响。对取食6种不同寄主植物的小菜蛾(PlutellaxylostellaL.)进行研究也发现,其乙酰胆碱酯酶活性无明显差异,但其艾氏剂环氧化酶活力存在显著不同[18]。
植食性昆虫对杀虫剂的敏感性还可受到其寄主植物的影响[19-21]。昆虫依靠体内具普遍防御性的酶系来克服其食物中的潜在毒性,这对于同为外来异生物质(xenobiotics)的杀虫剂亦是如此[4]。研究表明植食性昆虫对植物次生物质和化学杀虫剂起代谢作用的酶系是相同或相似的[22]。因此,昆虫体内相应酶系的活性可被植物次生物质诱导激活或抑制,最终可导致对杀虫剂敏感性的变化[4]。研究发现取食不同寄主植物的棉铃虫(HelicoverpaarmigeraHübner)[21]和甜菜夜蛾(SpodopteraexiguaHübner)[23]的酯酶活性发生改变,并且酶活性差异与害虫对杀虫剂的敏感性变化明显相关。本研究也发现取食不同寄主植物的禾谷缢管蚜对吡虫啉的敏感性也存在显著差异,且这种敏感性变化与其酯酶活性的变化规律相一致。吡虫啉还可显著诱导禾谷缢管蚜体内酯酶的大量表达,酯酶活力的变化与麦蚜对吡虫啉抗性的形成可能密切相关[24]。Sasabe 等[25]采用植物次生物质诱导并克隆相关的P450 基因,发现由次生物质诱导P450 基因转录表达的解毒酶能够同时代谢植物次生物质和杀虫剂,表明寄主植物的次生物质能够诱导解毒酶系的表达,增强昆虫对杀虫剂的抗性。因此,寄主植物已成为植食性害虫与杀虫剂之间的重要纽带,在田间进行害虫综合治理时,应充分考虑三者之间的相互关系。利用多食性害虫取食不同寄主植物产生抗药性的差异及寄主间转换的习性,合理布局,防止对杀虫剂可产生高耐受性的害虫向农田转移,降低田间害虫的大发生。
[1]Brattsten L B, Wilkinson C F, Eisner T. Herbivore-plant interactions: mixed-function oxidases and secondary plant substances[J]. Science,1977, 196(4296): 1349-1352.
[2]许纲, 钦俊德. 实夜蛾属二近缘种对寄主植物次生物质的反应:次生物质对幼虫生长和食物利用的影响[J]. 昆虫学报,1987, 30(4): 359-366.
[3]Terriere L C. Induction of detoxication enzymes in insects[J]. Annual Review of Entomology,1984, 29: 71-88.
[4]姚洪渭, 叶恭银, 程家安. 寄主植物影响害虫药剂敏感性的研究进展[J]. 昆虫学报,2002, 45(2): 253-264.
[5]曹雅忠, 李世功. 麦蚜及其综合治理[M]∥李光博, 曾士迈, 李振岐. 小麦病虫草鼠害综合治理. 北京: 中国农业科技出版社,1990: 316-318.
[6]张广学, 钟铁森. 中国经济昆虫志 第二十五册[M]. 北京: 科学出版社,1983.
[7]王晓军, 陶岭梅, 张青文. 麦长管蚜和禾谷缢管蚜对吡虫啉敏感性的比较研究[J]. 昆虫知识,2004, 41(2): 155-157.
[8]唐振华, 吴士雄. 昆虫抗药性的遗传与进化[M]. 上海:上海科学技术文献出版社, 2000.
[9]李川, 朱亮, 龚豪, 等. 不同小麦品种对有翅与无翅型禾谷缢管蚜生长发育与繁殖的影响[J]. 应用昆虫学报,2011, 48(4):941-947.
[10]李庆, 叶华智, 杨群芳, 等. 七种与小麦近缘的野生植物对禾谷缢管蚜抗性的生化机制[J]. 植物保护学报,2004, 31(1):1-5.
[11]McKenzie C L, Cartwright B.Susceptibility ofAphisgossypii(Glover) to insecticides as affected by host plant using a rapid bioassay[J]. Journal of Entomological Science, 1994, 29(3):289-301.
[12]Abdel-Aal Y A I, Wolff M A, Roe R M, et al. Aphid carboxylesterases: biochemical aspects and importance in the diagnosis of insecticide resistance[J]. Pesticide Biochemistry and Physiology,1990, 38(3):255-266.
[13]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976, 72:248-254.
[14]张睿. 寄主植物-植食性害虫-杀虫剂三者的关系[J]. 山西农业科学,2011, 39(3):276-277, 294.
[15]高希武. 寄主植物对棉蚜羧酸酯酶酶活性的影响[J]. 昆虫学报,1992, 35(3): 267-272.
[16]周奋启, 陆艳艳, 姚远, 等. 不同寄主植物对B型烟粉虱种群保护酶和解毒酶的影响[J]. 江苏农业学报,2011, 27(1):57-61.
[17]Lindroth R L. Differential toxicity of plant allelochemicals to insects: roles of enzymatic detoxification systems[M]∥Bernays E A, ed. Insect-plant interactions. Vol. 3. CRC Press,1991:1-33.
[18]李云寿, 罗万春, 慕立义, 等. 不同寄主植物对小菜蛾艾氏剂环氧化酶和乙酰胆碱酯酶活性的影响[J]. 植物保护学报,1996, 23(2):181-184.
[19]Hunter M D, Biddinger D J, Carlini E J, et al. Effects of apple leaf allelochemistry on tufted apple bud moth (Lepidoptera:Tortricidae) resistance to azinphosmethyl[J]. Journal of Economic Entomology,1994, 87(6):1423-1429.
[20]王建军, 戴志一, 杨益众. 取食不同寄主植物的棉铃虫对高效氯氰菊酯敏感性的变化[J]. 棉花学报, 2001,13(5):286-289.
[21]谭维嘉, 赵焕香. 取食不同寄主植物的棉铃虫对溴氰菊酯敏感性的变化[J]. 昆虫学报, 1990, 33(2):155-160.
[22]Brattsten L B.Potential role of plant allelochemicals in the development of insecticide resistance[M]∥Barbosa P, Letourneau D K,eds. Novel aspects of insect plant interactions. New York: John Wiley & Sons, 1988.
[23]姜卫华, 陆自强, 马式廉, 等. 寄主植物对甜菜夜蛾酯酶活性及杀虫剂敏感性的影响[J]. 植物保护, 2001, 27(5):13-14.
[24]谢佳燕. 不同浓度吡虫啉对禾谷缢管蚜酯酶的影响[J]. 植物保护, 2012, 38(3): 102-104.
[25]Sasabe M, Wen Z, Berenbaum M R, et al. Molecular analysis of CYP321A1, a novel cytochrome P450 involved in metabolism of plant allelochemicals (furanocoumarins) and insecticides (cypermethrin) inHelicoverpazea[J]. Gene,2004, 338(2):163-175.
InductioneffectsofdifferenthostplantsontheesteraseandacetylcholinesteraseofRhopalosiphumpadi
Lin Jia, Xie Jiayan
(SchoolofBiologyandPharmaceuticalEngineering,WuhanPolytechnicUniversity,Wuhan430023,China)
The esterase and acetylcholinesterase (AChE) activities and susceptibility to imidacloprid ofRhopalosiphumpadipopulations fed on wheat, oat andRoegneriakamojiwere tested by bioassay and biochemical analyses. Esterase activities of aphids varied with the host plants they fed on, but not their AChE activities. Moreover, tolerance of aphids to imidacloprid varied with the host plants they fed on. The change of the esterase activity of aphids on various host plants was consistent with their sensitivity to imidacloprid. It suggested that host plants could induce the esterase activity, but not the AChE ofR.padipopulations, which might affect their sensitivity to imidacloprid.
host plants;Rhopalosiphumpadi; imidacloprid; esterase; acetylcholinesterase
2013-08-20
:2013-09-30
国家自然科学基金(31201729);武汉市青年科技晨光计划(200950431197)
Q 965.9
:ADOI:10.3969/j.issn.0529-1542.2014.04.023
* 通信作者 E-mail: xjyaphid@yahoo.com
