牛角花齿蓟马为害对紫花苜蓿生长及氮代谢的影响
2014-08-10寇江涛师尚礼胡桂馨
寇江涛, 师尚礼*, 胡桂馨
(1.甘肃农业大学草业学院,兰州 730070;2.草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续研究中心,兰州 730070)
研究报告
牛角花齿蓟马为害对紫花苜蓿生长及氮代谢的影响
寇江涛1,2, 师尚礼1,2*, 胡桂馨1,2
(1.甘肃农业大学草业学院,兰州 730070;2.草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续研究中心,兰州 730070)
为了明确牛角花齿蓟马为害对紫花苜蓿生长及氮代谢的影响,测定了不同牛角花齿蓟马虫口密度下抗、感蓟马苜蓿无性系R-1、I-1的受害指数、单株生物量及氮代谢的变化。结果表明:(1)随着牛角花齿蓟马虫口密度的增加, R-1、I-1无性系各接虫处理的受害指数均升高、单株生物量均下降,在相同牛角花齿蓟马虫口密度下,R-1无性系的受害指数及产量损失率均低于I-1无性系。(2)受牛角花齿蓟马为害后,R-1无性系各接虫处理硝酸还原酶活性上升后趋于稳定,硝态氮含量呈先上升后下降的趋势,游离氨基酸含量呈持续上升的趋势;I-1无性系各接虫处理的硝酸还原酶活性呈先上升后下降的趋势,硝态氮含量呈先下降后上升的趋势,游离氨基酸含量上升后趋于稳定或下降。结果说明:硝酸还原酶活性的升高是R-1无性系对蓟马诱导抗性的一种表现,而I-1无性系氮代谢失调是其感蓟马的主要原因之一,因此R-1无性系的适应能力强,受害较轻,对牛角花齿蓟马为害的抗性和补偿生长能力高于I-1无性系。
紫花苜蓿; 牛角花齿蓟马; 受害指数; 单株生物量; 氮代谢
紫花苜蓿(MedicagosativaLinn.)是世界上栽培历史最久、遍布全球而以温带国家为重点的深根系多年生豆科牧草,具有适应性广、产量高、品质好、营养丰富、再生性强等特点,是各种食草类家畜的优质饲料[1]。苜蓿作为多年生牧草,一般在田间连续生长利用都在4年以上,多年连续生长利用而形成的稳定生境是导致其虫害日渐加重的主要原因[2]。调查表明,在我国西北、华北和东北等苜蓿主产区,为害苜蓿的优势种害虫以牛角花齿蓟马[Odontothripsloti(Haliday)]为主,绝大部分苜蓿品种虫害率均在95%以上,每年的发生面积达100%,轻者造成5%的产量损失,重者毁产[3-4],蓟马为害在造成苜蓿生长受阻、产量下降的同时,还严重影响苜蓿干草的品质[5-6]。
蓟马已成为我国北方苜蓿生产区最具危险性的害虫之一,对苜蓿产业造成严重的威胁和障碍,对苜蓿蓟马的有效防治迫在眉睫。贺春贵等[7]对40个苜蓿品种进行了田间抗蓟马评价,建立了以田间受害指数为标准的苜蓿抗蓟马评价鉴定标准。胡桂馨等[8-9]、马琳等[10]初步揭示了苜蓿的抗蓟马机制为耐害性。寇江涛等[11]研究表明,抗、感蓟马苜蓿无性系R-1、I-1在大田蓟马持续为害的条件下其补偿生长均表现为不足补偿,且两者对光能的利用能力均下降,光合效率降低,但R-1无性系对蓟马的为害具有显著的补偿光合作用,而I-1无性系的补偿光合作用滞后于初花期发生,且需要较高的光强条件[12-13]。
植物与害虫的相互关系是在长期协同进化的过程中逐渐形成的,植物为了避免自身器官被害虫取食或减少害虫取食的程度,在受到害虫为害损伤后会对害虫产生诱导抗性[14]。已有研究表明,牛角花齿蓟马为害使得苜蓿产生了生理、生化上的一系列变化[15-17],其中包括氮代谢系统的自我调节,从而提高自身的抗虫性。本研究以筛选出的抗蓟马苜蓿无性系R-1和感蓟马苜蓿无性系I-1为材料,评价不同牛角花齿蓟马虫口密度下R-1、I-1无性系的受害程度,测定其单株生物量的变化及产量损失率,并测定R-1、I-1无性系氮代谢随着牛角花齿蓟马为害时间的变化,以探索牛角花齿蓟马为害后苜蓿的补偿生长能力及生理生化反应,旨在为我国苜蓿抗蓟马育种奠定基础,为苜蓿抗虫育种提供科学的理论依据。
1 材料与方法
1.1 试验地概况
试验在甘肃农业大学兰州牧草试验站进行,试验站位于兰州市西北部,地处黄土高原西端,地理坐标为东经105°41′,北纬34°05′。该区海拔1 525 m,属温带半干旱大陆性气候,年降水量200~320 mm,年蒸发量1 664 mm,年蒸发量是降水量的5.2~8.3倍。年均日照2 770 h,全年无霜期90~210 d。年均气温9.7 ℃,最热月平均气温29.1 ℃,最冷月平均气温-14.9 ℃,>0 ℃的年积温3 800 ℃,>10 ℃的年积温3 200 ℃。区内地势平坦,肥力均匀,土壤类型为黄绵土,黄土层较薄,土壤有机质含量0.84%,pH 7.5,土壤含盐量0.25%,有效氮95.05 mg/kg,有效磷7.32 mg/kg,有效钾182.8 mg/kg。
1.2 试验材料及试验设计
供试苜蓿材料:抗蓟马苜蓿无性系R-1、感蓟马无性系I-1。R-1、I-1无性系均选自抗蚜苜蓿品系‘HA-3’,于2007-2008年通过室内和大田评价筛选、扦插扩繁得到。大田自然条件下,7、8月份,现蕾期R-1无性系的受害指数分别为53%和61%,现蕾期I-1无性系的受害指数分别为75%和79%。供试昆虫:田间自然发生的牛角花齿蓟马成虫。
于2010年4月底整地,将供试苜蓿材料R-1、I-1无性系植株移栽于试验地内,R-1株行与I-1株行按1∶1相间排列,行距20 cm,每小区10行,株距20 cm,每行15株,小区面积6 m2,重复3次。2011年4月在小区所在地搭建网室,在第1茬苜蓿生长期间每5 d喷洒1次农药(10%吡虫啉可湿性粉剂2 000倍液)进行害虫防治,第1茬苜蓿刈割后,在第2茬苜蓿生长至40 cm(分枝期)时,按0(对照:CK)、1、3、5、7头/枝条接入牛角花齿蓟马成虫,网室内各小区间用防虫网隔离,以防接入的蓟马在各小区间逃窜。
于接虫后第7天,根据苜蓿受蓟马为害的分级标准,统计不同虫口密度下R-1、I-1无性系的受害级别,并计算其受害指数,评价不同虫口密度下R-1、I-1无性系的受害程度。同时测定不同虫口密度下R-1、I-1无性系的单株生物量,并计算产量损失率。
分别于接虫后第1、2、3、4、5 天,取不同虫口密度下R-1、I-1无性系每个植株上部1/3以上完全展开的叶片,每株系取7~8片,充分混合,液氮保存,用来测定硝酸还原酶(NR)活性、硝态氮含量及游离氨基酸含量。
1.3 测定方法
受害程度的调查:根据贺春贵等[7]提出的田间苜蓿受蓟马为害的分级标准,以叶片为单位将受害苜蓿叶片分为5级(具体分级标准见表1)。
表1苜蓿叶片受蓟马为害的分级标准
Table1InjurygradingofMedicagoleavesbythrips
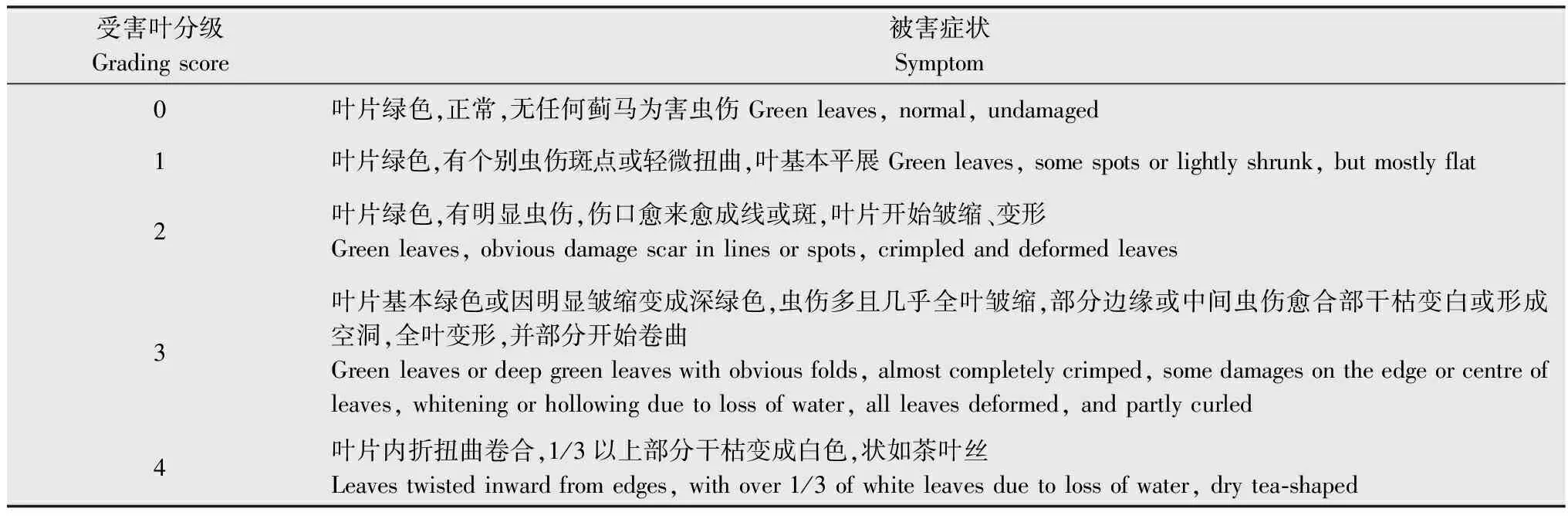
受害叶分级Gradingscore被害症状Symptom0叶片绿色,正常,无任何蓟马为害虫伤Greenleaves,normal,undamaged1叶片绿色,有个别虫伤斑点或轻微扭曲,叶基本平展Greenleaves,somespotsorlightlyshrunk,butmostlyflat2叶片绿色,有明显虫伤,伤口愈来愈成线或斑,叶片开始皱缩、变形Greenleaves,obviousdamagescarinlinesorspots,crimpledanddeformedleaves3叶片基本绿色或因明显皱缩变成深绿色,虫伤多且几乎全叶皱缩,部分边缘或中间虫伤愈合部干枯变白或形成空洞,全叶变形,并部分开始卷曲Greenleavesordeepgreenleaveswithobviousfolds,almostcompletelycrimped,somedamagesontheedgeorcentreofleaves,whiteningorhollowingduetolossofwater,allleavesdeformed,andpartlycurled4叶片内折扭曲卷合,1/3以上部分干枯变成白色,状如茶叶丝Leavestwistedinwardfromedges,withover1/3ofwhiteleavesduetolossofwater,drytea⁃shaped
每个接虫处理随机选择10个单株,统计每个植株上部1/3以上完全展开叶片的受害级别,按下式计算其受害指数[18-19]。
受害指数(%)=

单株生物量的测定:刈割随机选定的30个单株,105 ℃杀青 15 min,之后置于 60 ℃下烘至恒重(24 h),冷却后取出用 1%天平分别称量各个单株的重量。
产量损失率(%)=[(对照生物量-被害生物量)/对照生物量]×100。
NR活性采用离体法测定[20]:称取剪碎均匀的新鲜苜蓿叶片0.5 g,置于研钵中在超低温冰箱冰冻30 min,取出后置于冰浴中,加4 mL 提取缓冲液研磨至匀浆,于4 ℃在4 000 r/min离心15 min。吸取提取液0.4 mL置于试管中,加入1.4 mL 0.1 mol/L的KNO3溶液和0.2 mL 2.0 mg/mL的NADH溶液,对照不加NADH溶液,摇匀后于25 ℃水浴反应30 min。保温结束后立即加入1.0 mL 1%对氨基苯磺酸溶液终止酶反应,然后加入1.0 mL 0.02%α-萘胺溶液,显色15 min后在4 000 r/min离心5 min,取上清液于540 nm波长下测定A值。
硝态氮含量参照邹琦[20]的方法测定:称取剪碎的新鲜苜蓿叶片2.0 g置于试管中,加入10 mL去离子水后于沸水浴中提取30 min,取出后迅速用自来水冷却,将提取液过滤到25 mL容量瓶中,反复冲洗残渣并定容,吸取0.1 mL滤液置于试管中,加入0.4 mL SA-H2SO4溶液,室温下放置20 min,缓慢加入9.5 mL 8%的NaOH溶液,冷却后于410 nm波长下测定A值。
游离氨基酸含量参照孔祥生等[21]的方法测定:称取剪碎的新鲜苜蓿叶片1.0 g,加入10% CH3COOH 1 mL研磨至匀浆后转移到25 mL容量瓶中,定容、过滤,吸取2 mL滤液置于试管中,加入3 mL水合茚三酮和0.1 mL 1%的AsA,沸水浴15 min,取出冷却后于580 nm波长下测定A值。
1.4 数据处理与分析
采用Excel 2003进行数据处理和图表绘制,并采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和最小显著差数法(LSD法)进行多重比较。
2 结果与分析
2.1 牛角花齿蓟马为害后R-1、I-1无性系的受害指数
由表2可知,随着牛角花齿蓟马虫口密度的增加,R-1、I-1无性系各接虫处理的受害指数均呈上升趋势。R-1无性系接3头/枝条处理的受害指数显著高于接1头/枝条的处理(P<0.05),接5、7头/枝条处理的受害指数差异不显著,两者均显著高于接1、3头/枝条的处理(P<0.05)。I-1无性系各接虫处理之间的受害指数差异显著(P<0.05)。在牛角花齿蓟马相同虫口密度压力下,R-1无性系各接虫处理的受害指数均低于I-1无性系。
表2不同虫口密度牛角花齿蓟马为害后R-1、I-1无性系的受害指数及单株生物量1)
Table2DamageindexandindividualbiomassofR-1andI-1damagedbyOdontothripslotiatdifferentdensities

处理Treatment受害指数/%DamageindexR⁃1无性系R⁃1cloneI⁃1无性系I⁃1clone单株生物量/gIndividualbiomassR⁃1无性系R⁃1cloneI⁃1无性系I⁃1clone0头/枝条CK--(35.00±3.31)a(31.90±3.89)a1头/枝条1insectperbranch(25.00±5.00)c(30.12±3.00)d(34.22±3.82)a(29.78±4.01)ab3头/枝条3insectsperbranch(31.12±4.00)b(39.62±3.00)c(34.39±3.58)a(27.00±3.68)ab5头/枝条5insectsperbranch(45.00±5.00)a(55.12±3.00)b(32.00±4.22)ab(25.00±4.82)b7头/枝条7insectsperbranch(49.00±6.00)a(65.88±5.00)a(29.39±4.05)b(23.83±4.12)b
1) 同列不同小写字母表示各处理之间达差异显著水平(P<0.05,LSD)。
Different lowercase letters in the same column indicate significant difference among treatments (P<0.05; LSD method).
2.2 牛角花齿蓟马为害对R-1、I-1无性系生物量的影响
由表2可知,随着牛角花齿蓟马虫口密度的增加,R-1无性系、I-1无性系的单株生物量均呈下降趋势。R-1无性系接1、3、5头/枝条处理的单株生物量均与0头/枝条(CK)处理差异不显著,接7头/枝条处理的单株生物量显著低于CK(P<0.05),产量损失率为16.03%。I-1无性系接1、3头/枝条处理的单株生物量与0头/枝条(CK)处理差异不显著,接5、7头/枝条处理的单株生物量显著低于CK(P<0.05),产量损失率分别为21.63%、25.29%。在牛角花齿蓟马相同虫口密度压力下,R-1无性系各接虫处理的产量损失率均低于I-1无性系。
2.3 牛角花齿蓟马为害对R-1、I-1无性系NR活性的影响
由图1可知,R-1无性系在牛角花齿蓟马为害第1、2天时,接5、7头/枝条处理的NR活性显著高于0头/枝条(CK)(P<0.05),在为害第3天时,接3头/枝条处理的NR活性也显著高于CK(P<0.05),在为害第4、5天时,各接虫处理的NR活性均显著高于CK(P<0.05)。I-1无性系在牛角花齿蓟马为害第1天时,接7头/枝条处理的NR活性显著高于0头/枝条(CK)(P<0.05),在为害第2天时,各接虫处理的NR活性均显著高于CK(P<0.05),在为害第3天时,各接虫处理的NR活性开始下降,在为害第4、5天时,各接虫处理的NR活性均与CK差异不显著。
受牛角花齿蓟马为害后,R-1无性系接5、7头/枝条处理的NR活性在为害第1、2天时呈上升趋势,在为害第3、4、5天时,NR活性不再上升;R-1无性系接1、3头/枝条处理的NR活性在为害第1、2、3、4天时呈上升趋势,在为害第5天时,NR活性不再上升。I-1无性系各接虫处理的NR活性在为害第1、2天时呈上升趋势,在为害第3、4、5天时,NR活性呈下降趋势。

图1 不同虫口密度牛角花齿蓟马为害对R-1、I-1无性系NR活性的影响
2.4 牛角花齿蓟马为害对R-1、I-1无性系硝态氮含量的影响
由图2可知,R-1无性系在牛角花齿蓟马为害第1天时,接5、7头/枝条处理的硝态氮含量显著高于0头/枝条(CK)(P<0.05),在为害第2天时,各接虫处理的硝态氮含量均显著高于CK(P<0.05),在为害第3天时,各接虫处理的硝态氮含量开始下降,接1、3头/枝条处理的硝态氮含量与CK差异不显著,在为害第4、5天时,各接虫处理的硝态氮含量均与CK差异不显著。I-1无性系在牛角花齿蓟马为害第1天时,各接虫处理的硝态氮含量均显著高于0头/枝条(CK)(P<0.05),在为害第2天时,接1、3头/枝条处理的硝态氮含量与CK差异不显著,在为害第3天时,各接虫处理的硝态氮含量均与CK差异不显著,在为害第4天时,各接虫处理的硝态氮含量开始上升,接5、7头/枝条处理的硝态氮含量显著高于CK(P<0.05),在为害第5天时,除接1头/枝条处理的硝态氮含量与CK差异不显著外,其余各接虫处理的硝态氮含量均显著高于CK(P<0.05)。

图2 不同虫口密度牛角花齿蓟马为害对R-1、I-1无性系硝态氮含量的影响
受牛角花齿蓟马为害后,R-1无性系各接虫处理的硝态氮含量总体上呈先上升后下降的趋势,I-1无性系各接虫处理的硝态氮含量在为害第1天时迅速上升,而后呈下降后上升的趋势。
2.5 牛角花齿蓟马为害对R-1、I-1无性系游离氨基酸含量的影响
由图3可知,R-1无性系在牛角花齿蓟马为害第1天时,各接虫处理的游离氨基酸含量均与0头/枝条(CK)差异不显著,在为害第2天时,接7头/枝条处理的游离氨基酸含量显著高于CK(P<0.05),在为害第3天时,接5、7头/枝条处理的游离氨基酸含量显著高于CK(P<0.05),在为害第4、5天时,各接虫处理的游离氨基酸含量均显著高于CK(P<0.05)。I-1无性系在牛角花齿蓟马为害第1天时,各接虫处理的游离氨基酸含量均与0头/枝条(CK)差异不显著,在为害第2、3、4、5天时,各接虫处理的游离氨基酸含量均显著高于CK(P<0.05)。

图3 不同虫口密度牛角花齿蓟马为害对R-1、I-1无性系游离氨基酸含量的影响
受牛角花齿蓟马为害后,R-1无性系各接虫处理的游离氨基酸含量呈持续上升的趋势,I-1无性系各接虫处理的游离氨基酸含量在为害第1、2、3天时呈上升趋势,在为害第4、5天时,接1、3头/枝条处理的游离氨基酸含量不再上升,接5、7头/枝条处理的游离氨基酸含量呈下降趋势。
3 讨论
3.1 牛角花齿蓟马为害胁迫下R-1、I-1无性系的抗性表现
在我国西北苜蓿种植区,苜蓿被蓟马为害率通常达到100%,因此以叶片受害程度级别为基础的苜蓿受害程度评价更能直观、明确地表达大田条件下苜蓿植株的真实受害状态。不同苜蓿品种对蓟马的抗性差异较大,而且在不同抗性水平的苜蓿品种上为害的蓟马数量也不同,这与苜蓿对蓟马的抗性差异有关,还有诸多外界因素有关,但不同苜蓿品种对蓟马的抗性差异最终表现为受害程度不同。贺春贵等[7]以受害指数为标准,对引进的40个不同品种(品系)苜蓿进行了田间抗蓟马评价,结果表明,这些引进的苜蓿品种(品系)在田间受蓟马为害后,受害指数分布范围为65%~88%,抗性普遍较低。胡桂馨等[8-9]对10个不同品种苜蓿进行苗期室内抗性评价,结果表明,随着牛角花齿蓟马密度的增加,不同苜蓿品种的受害指数均明显上升。受牛角花齿蓟马为害后,R-1、I-1无性系各接虫处理的受害指数均随着牛角花齿蓟马虫口密度的增加呈上升趋势,在相同牛角花齿蓟马虫口压力下,I-1无性系各接虫处理的受害指数均高于R-1无性系,这与上述研究结果一致,说明R-1无性系对牛角花齿蓟马的为害具有较强抗性,而I-1无性系的抗性明显低于R-1无性系。
在一定条件下,昆虫适度的取食,不仅不会危害植物的生长发育,相反还会促进其生长和发育,即适度伤害对植物有益[22-23]。胡桂馨等[9]对苜蓿苗期受牛角花齿蓟马为害后的补偿作用研究发现,在低虫口密度蓟马为害后,抗虫品种‘HA-3’苜蓿产量增加,表现为超补偿生长。寇江涛等[11]通过对R-1、I-1无性系第二茬生长期间蓟马持续为害后调查发现,R-1、I-1无性系的单株生物量均下降,说明在蓟马的持续为害下,R-1、I-1无性系的补偿生长均为不足补偿。受牛角花齿蓟马为害后,R-1、I-1无性系各接虫处理的单株生物量均下降,这与寇江涛等的研究结果一致。作物对虫害的补偿作用具有一定的普遍性,作物受害后,离产量形成尚有较长一段时间,在此情况下,作物的补偿才是有效的[24]。从这个角度来看,受牛角花齿蓟马为害后R-1、I-1无性系各接虫处理的产量下降主要是由于牛角花齿蓟马的为害时间短,苜蓿产生补偿生长的缓冲时间不足所致。所以苜蓿在牛角花齿蓟马为害后产生超补偿生长的最适虫口量及时间还有待于进一步研究。但在相同虫口密度牛角花齿蓟马压力下,I-1无性系各接虫处理的产量损失率均高于R-1无性系,这与胡桂馨等[9]、马琳等[10]有关抗虫株系的产量损失率显著低于感虫株系的结果一致,说明I-1无性系受牛角花齿蓟马为害的程度大于R-1无性系,这与相同牛角花齿蓟马压力下I-1无性系各接虫处理的受害指数均高于R-1无性系的结果相吻合。
3.2 牛角花齿蓟马为害对紫花苜蓿氮代谢的影响
研究牛角花齿蓟马为害后苜蓿体内NR活性及硝态氮、游离氨基酸含量的变化,可能会对缓解各种胁迫的氧化伤害及深入了解逆境胁迫下氮代谢与其他生理过程的关系提供新的思路,从而有效调节苜蓿的氮代谢,提高产量和品质。NR是硝态氮同化步骤中的第一个酶,也是氮代谢中的一个重要的调节酶和限速酶,以NR为中心的调控系统是植物最原始、最基本的氮代谢调控系统,在植物氮素代谢过程中起关键作用,有关NR的研究一直是植物生理生化研究的重点[25-26]。NR可直接调节硝酸盐还原,从而调节氮代谢,并进一步影响到碳代谢[27],因此植物体内NR活性的高低及其硝态氮、游离氨基酸的含量三者之间紧密联系。
受牛角花齿蓟马为害后,R-1无性系各接虫处理的NR活性在为害初期呈上升趋势,为害后期不再上升,且因虫口压力不同而有所差异,I-1无性系各接虫处理的NR活性呈先上升后下降的趋势,可能是由于牛角花齿蓟马为害诱导NR活性升高,硝态氮还原速度加快,最终产生了NO,而NO能够影响植物的生长、发育、衰老和抗病等生理代谢过程,缓解各种胁迫下的活性氧伤害,还能作为第二信使激活各种抗病防卫基因的表达[28],所以NR活性的升高可能是紫花苜蓿对蓟马诱导抗性的一种表现。
由于R-1无性系各接虫处理的NR活性上升后趋于稳定,并处于较高的活性水平,对硝态氮的还原能力增强,所以R-1无性系各接虫处理的硝态氮含量总体上呈先上升后下降的趋势,而I-1无性系各接虫处理的NR活性上升后随着为害时间的延长下降,为害后期对硝态氮的还原能力降低,所以硝态氮含量呈下降后上升的趋势,与NR活性的变化趋势相反。
大多数氨基酸是植食害虫生长发育的必需营养物质,已有研究表明,棉叶中氮或可溶性氨基酸的含量与棉花的感蚜程度呈正相关[29],但酪氨酸不是棉蚜生长发育的必需氨基酸,能够缩短棉蚜的龄期,使其虫体变小,甚至大量死亡,表现出抗蚜性[30]。由此可见,游离氨基酸对棉蚜具有双重作用。受牛角花齿蓟马为害后,R-1无性系各接虫处理的游离氨基酸含量呈持续上升的趋势,I-1无性系各接虫处理的游离氨基酸含量在为害初期时呈上升趋势,为害后期因虫口压力不同而有所差异。一方面可能是由于可溶性蛋白的不断水解,致使游离氨基酸含量增加,另一方面可能是由于R-1无性系在蓟马为害后可诱导产生大量的对蓟马生长发育有害的非必需氨基酸,而I-1无性系则可能不产生或者只产生少量的对蓟马生长发育有害的非必需氨基酸,所以I-1无性系在蓟马为害后期游离氨基酸含量不再上升,并且表现出的为害症状较R-1无性系严重。
[1]洪绂曾. 苜蓿科学[M]. 北京: 中国农业出版社,2009.
[2]吴永敷, 赵秀华, 特木尔布和. 蓟马是我国苜蓿生产的主要害虫[J]. 中国草地,1990(3):65-66.
[3]严林, 梅洁人. 青海省紫花苜蓿病虫种类及害虫天敌的调查[J]. 植物保护,1996,22(5):24-25.
[4]张蓉, 马建华,王进华, 等. 宁夏苜蓿病虫害发生现状及防治对策[J]. 草业科学,2003,20(6): 40-44.
[5]吴永敷, 赵秀娴, 赵秀华, 等. 蓟马对苜蓿的危害[J]. 中国草地,1988(2):25-27.
[6]贺春贵. 苜蓿病虫草鼠害防治[M]. 北京: 中国农业出版社, 2004.
[7]贺春贵, 王森山, 曹致中, 等. 40个苜蓿品种(系)对蓟马田间抗性评价[J]. 草业学报, 2007, 16(5): 79-83.
[8]胡桂馨, 贺春贵, 王森山, 等. 不同苜蓿品种对牛角花齿蓟马的抗性机制初步研究[J]. 草业科学,2007,24(9):86-89.
[9]胡桂馨, 师尚礼, 王森山, 等. 不同苜蓿品种对牛角花齿蓟马的耐害性研究[J]. 草地学报,2009,17(4): 505-509.
[10]马琳, 贺春贵, 胡桂馨, 等. 四个苜蓿品种无性系大田抗蓟马性能评价[J]. 植物保护,2009, 35(6): 146-149.
[11]寇江涛, 胡桂馨, 张新颖, 等. 持续危害下抗、感蓟马苜蓿无性系大田生长特性的比较[J]. 草原与草坪,2011,31(4): 35-40.
[12]寇江涛, 师尚礼, 胡桂馨, 等. 抗、感蓟马苜蓿无性系对蓟马危害的补偿光合生理反应比较[J]. 昆虫学报,2011,54(8): 910-917.
[13]寇江涛, 师尚礼, 胡桂馨, 等. 紫花苜蓿对蓟马危害的光合生理响应[J]. 中国农业科学,2013,46(12): 2459-2470.
[14]陈建明, 俞晓平, 程家安, 等. 植物耐虫性研究进展[J]. 昆虫学报, 2005, 48(2): 262-272.
[15]寇江涛, 师尚礼, 胡桂馨. 牛角花齿蓟马为害对紫花苜蓿MDA含量及防御酶活性的影响[J]. 植物保护,2013,39(5):165-171.
[16]寇江涛, 师尚礼, 胡桂馨. 牛角花齿蓟马为害对紫花苜蓿AsA、GSH含量及相关代谢酶活性的影响[J]. 应用昆虫学报,2013,50(6):1600-1607.
[17]寇江涛, 师尚礼, 胡桂馨, 等. 牛角花齿蓟马为害对紫花苜蓿活性氧代谢的影响[J]. 核农学报,2013,27(12): 1948-1954.
[18]周明牂. 作物抗虫性原理及应用[M]. 北京: 北京农业大学出版社,1992.
[19]Niranjan P, Gurdev S K. Host plant resistance to insects[M]. UK: CAB International,1995.
[20]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社,2006.
[21]孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社,2008.
[22]Belsky A J. Does herbivory benefit plants? A review of the evidence[J]. The American Naturalist,1986, 127: 870-892.
[23]盛承发. 生长的冗长—作物对于虫害超越补偿作用的一种解释[J]. 应用生态学报,1990,1(1): 26-30.
[24]盛承发. 超补偿理论及其在虫害控制中的意义[J]. 自然灾害学报,1993,2(2): 13-19.
[25]张涛, 陈云, 谢虹, 等. 硝酸还原酶活性的调节及可能机制的研究进展[J]. 广西植物,2004,24(4): 367-372.
[26]李健身. 硝酸还原酶活性的调节[J]. 阴山学刊,2009,23(1): 40-42.
[27]田华, 段美洋, 王兰. 植物硝酸还原酶功能的研究进展[J]. 中国农学通报,2009,25(10): 96-99.
[28]Klessig D F, Durner J, Noad R, et al. Nitric oxide and salicylic acid signaling in plant defense[J]. Proceedings of the National Academy of Science of USA,2000,97(16): 8849-8855.
[29]陆宴辉, 杨益众, 印毅, 等. 棉花抗蚜性及抗性遗传机制研究进展[J]. 昆虫知识,2004,41(4): 291-294.
[30]吴振廷, 赵慧丽, 吴成方. 棉花苗期植株营养物质变化对棉蚜生存的影响[J]. 植物保护学报,1990, 17(1): 95-96.
EffectsofOdontothripslotidamageonalfalfagrowthandnitrogenmetabolism
Kou Jiangtao1,2, Shi Shangli1,2, Hu Guixin1,2
(1.CollegeofGrasslandScience,GansuAgriculturalUniversity,Lanzhou730070,China; 2.KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China)
Damage index, individual biomass and nitrogen metabolism were investigated on alfalfa clones R-1 and I-1, resistant and susceptible toOdontothripsloti, respectively, under different pest densities to determine the effects ofO.lotidamage on alfalfa growth and nitrogen metabolism. The results indicated that: (1) all damage indices of both R-1 and I-1 increased and individual biomasses decreased as pest density increased, and at the same density level, damage index and yield loss of R-1 were lower than those of I-1; (2) after being damaged by thrips, NR (nitrate reductase) activity of all inoculated R-1 increased till stabilization, and nitrate nitrogen content firstly increased and then decreased, and free amino acids increased continuously; NR activity of all inoculated I-1 firstly increased and then decreased, while nitrate nitrogen content decreased firstly, followed by increase; free amino acid content firstly increased, then remained stable or decreased. These results indicated that the increase of NR activity was a manifestation of induced resistance of R-1 to thrips, while nitrogen disorder of I-1 is the main reason leading to their susceptibility, all of which ultimately resulted in stronger adaptability and minor damage of R-1, as well as stronger resistance and compensation growth capability than I-1.
alfalfa;Odontothripsloti; damage index; individual index; nitrogen metabolism
2013-11-03
:2014-01-06
国家现代牧草产业技术体系建设专项(CARA-35);全国种质资源保种项目(NB2130135);教育部高校博士学科点基金(20106202110003);农业部行业专项(201003023);国家自然科学基金项目(31260579)
S 433.89
:ADOI:10.3969/j.issn.0529-1542.2014.04.003
* 通信作者 E-mail:shishl@gsau.edu.cn
