胎儿缓慢性心律失常诊断治疗及管理进展
2014-08-10周开宇李一飞华益民
周开宇 王 川 李一飞 华益民
·综述·
胎儿缓慢性心律失常诊断治疗及管理进展
周开宇 王 川 李一飞 华益民
胎儿缓慢性心律失常主要包括窦性心动过缓、房室传导阻滞(AVB)、长QT综合征(LQTS)、其他离子通道病以及房性期前收缩(APB)伴传导阻滞等。部分胎儿缓慢性心律失常能在产前明确诊断,但仍有部分类型产前诊断存在困难;相对于胎儿快速性心律失常而言,胎儿缓慢性心律失常预后相对较差、产前干预手段有限且疗效不尽如意,导致这一领域研究进展较慢。但面对胎儿缓慢性心律失常较高的致残率及病死率,近5年学者们逐渐突破困境,取得该领域诊断治疗及管理的诸多进展。
1 胎儿缓慢性心律失常的诊断
胎儿缓慢性心律失常是指无宫缩时胎心率低于正常心率下限的20%并持续10 s以上,可伴有胎心节律不规则[1~6]。完整心律失常诊断应包括胎儿心脏节律、心血管结构及心脏功能评估。
1.1 胎心听诊和胎心监护 可发现胎儿心动过缓及心律不齐,但不能进行分类及反映胎儿心血管形态结构及血流动力学方面的信息。
1.2 胎儿心电图 可发现胎儿心动过缓及心律不齐等,甚至可诊断胎儿完全性AVB(CAVB,图1)[6]。但通常情况下经母体腹壁检测的胎儿心电图信号弱,干扰大,难以诊断复杂类型胎儿心律失常[1,2,4~6]。

图1 妊娠37周胎儿心电图显示胎儿完全性房室传导阻滞
注 A:不同导联母体心电图; B:不同导联胎儿心电图;红色箭头: 母亲心电图波形;蓝色箭头:胎儿心电图波形。引自Simcha Yagel.FetalCardiology(2nd), 2009:449-482
1.3 胎儿超声心动图(fUCG)
1.3.1 M型超声 是基于对心房、心室运动时序来分析评价心律失常,结合脉冲及频谱多普勒技术,测量房室频谱时间间距,根据右肺动脉和肺静脉频谱估测PR间期等方法,是目前诊断胎儿心律失常的主要方法[1~6]。图2A为M型超声诊断29+4周胎儿窦性心动过缓,1∶1房室传导,心率110·min-1;图2B为M型超声诊断28+5周胎儿CAVB,心房率144·min-1(黑箭头), 心室率68·min-1(白箭头);图2C为31+2周胎儿,胎心率65·min-1,M型超声发现心房律规则、频率正常(小箭头),但远慢于心室率(空箭头),似乎存在2∶1房室关系, 警惕Ⅱ°AVB(莫氏Ⅰ型),脉冲多普勒取样线置于降主动脉和左房后壁,左心房壁运动显示心房活动(黑三角),主动脉血流信号显示心室活动(白三角),相同显示2∶1房室模式,但心室活动与其相关的心房活动延迟时间明显增加,提示房室活动已经不存在关联,诊断为CAVB;图2D为频谱多普勒超声诊断29+5周胎儿心动过缓,胎心率96·min-1,降主动脉血流信号显示2个规则波形间距470 ms,其后出现延长间距770 ms,考虑可能性最大为房室阻滞,出现心房异位搏动,但亦应考虑到2∶1 AVB(文氏现象)可能,结合M型超声心动图提示APB未下传;图2E为采用同时记录右肺动脉(基线上方)和右上肺静脉频谱(基线下方)的方法,甚至可估测PR间期(a-V),从而实现Ⅰ°及Ⅱ°AVB、预激综合征等的诊断。
1.3.2 组织多普勒影像技术(TDI) TDI可对房室瓣游离缘的运动情况进行描述[6],也可通过TDI曲线分析技术,对不同位置的心肌组织节段运动同时进行描记,以反映胎儿心脏不同房室水平的运动特征[5],其优势在于可直观地显示心律失常胎儿房室瓣的运动, 且所需的胎儿四腔心切面较脉冲多普勒所需五腔心切面易于获取,便于诊断胎龄较小的胎儿,并可同时评价心律失常胎儿的心功能变化。图2F和G为组织多普勒在三尖瓣瓣环处分别显示正常搏动波形和期前收缩。图2H为胎儿心振动图心尖四腔切面,图2I为从心尖四腔切面获取的组织速度影像(TVI)曲线。心房波速度慢,与A波(心房收缩波)方向相反。
1.3.3 胎儿心振动图 基于原始组织速度多普勒成像技术,可同时对左、右房室壁速率进行采样, 精确实时分析左、右房室活动, 应用所获得的时间数据, 通过梯形图来诊断胎儿心律失常,并提供准确的间期分析[7,8]。胎儿心振动图可监测胎儿心脏功能,判断房室传导时间延长,在依靠传统超声技术较难准确诊断的AVB、LQTS等胎儿心律失常类型方面优于胎儿TDI,在辅助诊断胎儿心律失常方面开启了新的窗户, 而且为研究抗心律失常药物作用及药物对胎儿心脏电生理的影响等方面提供了新的工具[7,8]。图2J和K为胎儿心振动图同步采样得到的心室TVI曲线(黑色)和心房TVI曲线(灰色)显示APB。图2J为APB在2个正常窦性周期后发生,开始在心室快速充盈期,心房曲线出现与心房A波方向相反的A′波,该轻微提前出现的A′波引起了心室收缩(S波),该S波幅度较正常S波减少。随后的E波波幅略减,与窦房结去极化有关;图2K为APB未下传;胎儿的APB(箭头)提前出现,出现于上一个心室收缩时。如不结合心房TVI曲线,仅单纯观察心室TVI曲线就可能误诊为Ⅱ°AVB。
1.4 胎儿心磁图(fMCG) fMCG是近年发展起来的一种新的、通过心脏磁场的变化而探测心脏电生理变化的无创性检测技术,能对心律失常胎儿在药物治疗的同时监测孕妇和胎儿心脏节律[9~12],但测量复极时间受多种因素影响,有待于建立统一的测量标准。图3A为1例妊娠25周胎儿,胎心率103·min-1,窦性心动过缓,诊断为LQTS;图3B为妊娠34周胎儿,胎心率125·min-1,诊断为Ⅱ°AVB;图3C为妊娠31周胎儿,胎心率为106·min-1,诊断为Ⅱ°
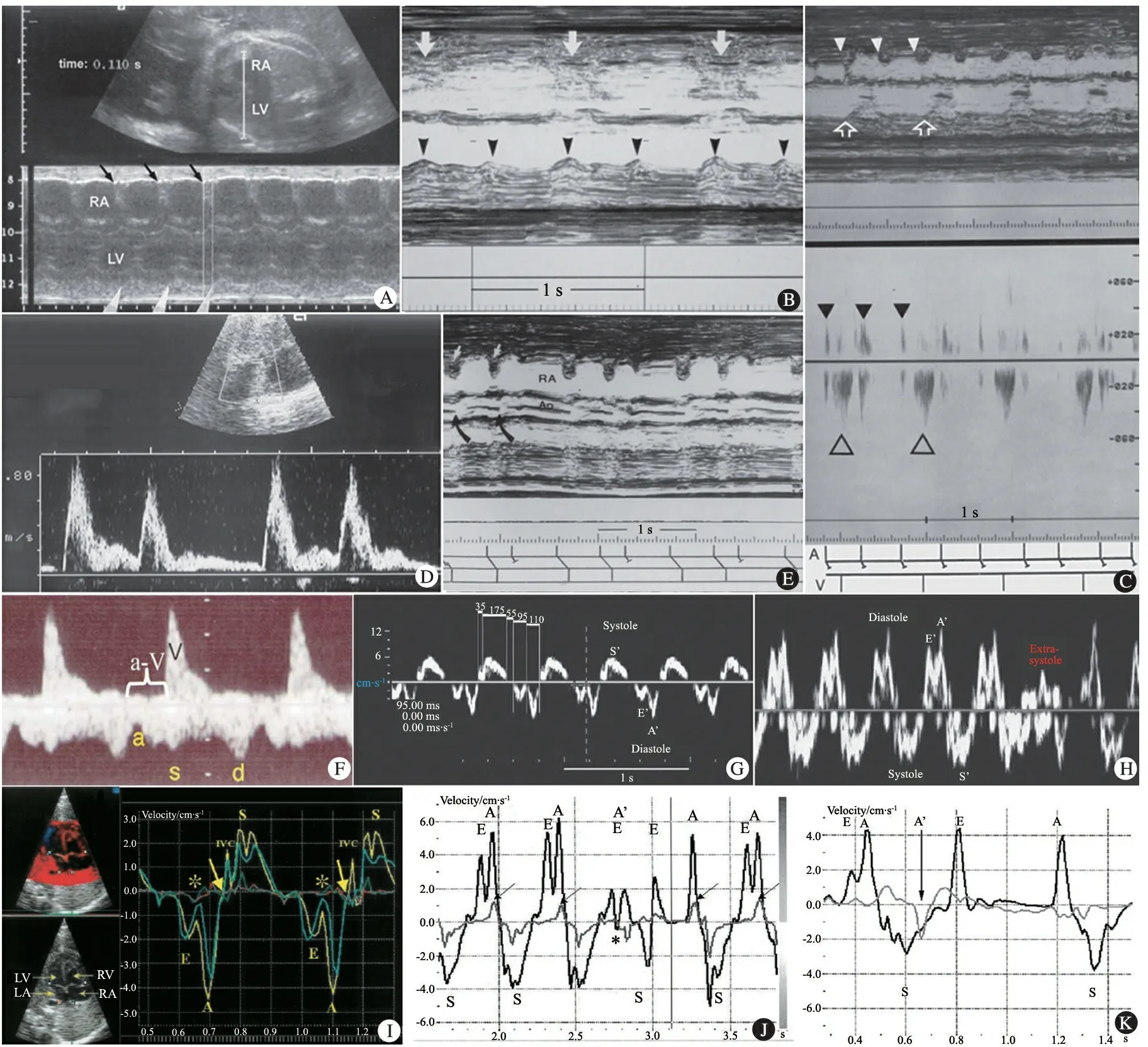
图2 胎儿心律失常超声心动图、多普勒影像和心振图所见
注 图A~G引自Simcha Yagel.FetalCardiology(2nd), 2009:449-482;图H和I引自Rein AJ.Circulation, 2002,106(14):1827-1833;图J和K引自Rein AJ.Circulation, 2009,119(14):1867-1872。RA:右心房;LV:左心室;;LA:左心房;RV:右心室;S:收缩充盈波;D:舒张期充盈波;V:肺动脉射血波;systole:收缩期,S′波;diastole:舒张期,E′峰及A′峰;Extra-systole:期前收缩;S:心室收缩;IVC:下腔静脉,左室等容收缩。图2I中星号和箭头分别指示的心房收缩的起始和终止
AVB和尖端扭转性室性心动过速(TdP);图3D为妊娠32周胎儿,SVT发作时心率 270·min-1,1∶1房室传导,发作终止后进行fMCG检查诊断为胎儿预激综合征。
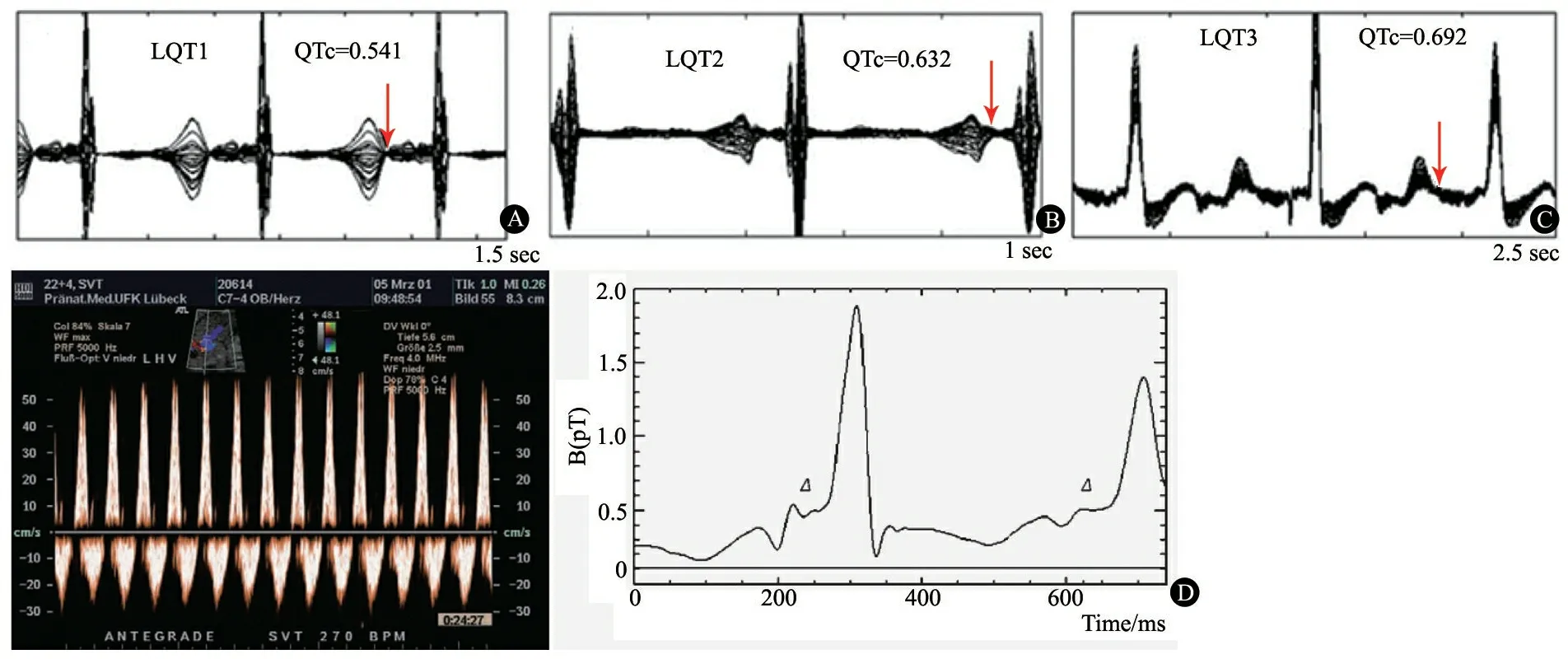
图3 胎儿心律失常心磁图所见
注 图A~D引自Cuneo BF.Circulation, 2013, 128(20): 2183-2191
2 胎儿缓慢性心律失常的产前干预及管理
对需要进行产前药物治疗的持续胎儿缓慢性心律失常,治疗前应明确治疗目的及疗效,确定是达到转复为窦性心律的理想状态?还是以达到控制心室率及心力衰竭为目标?对这些患胎而言,虽经产前治疗后大多不能转复为窦性心律,但有效提高了心室率并能控制心力衰竭,保证了胎儿有效心排血量及重要脏器灌注,对长期预后有不可忽视的积极意义。在治疗过程中应注意动态监测患胎病情演变,进行动态妊娠决策。
2014年美国心脏联合会(AHA)“胎儿心血管疾病诊断治疗科学声明”[4]中,明确提出胎儿缓慢性心律失常的药物治疗指征(表1)及胎儿心动过缓的产前干预管理方案(表2),将促进胎儿缓慢性心律失常产前干预领域的长足进步。

表1 胎儿缓慢性心律失常心脏药物治疗指征[4]
注 AVB:房室传导阻滞。表中证据等级和推荐强度标准来自文献[13]。A级:证据来自多中心RCT或Meta分析;B级:证据来自单中心RCT或设计良好的非随机对照试验;Ⅱa:操作或治疗的利益有效性利大于弊;Ⅱb:操作或治疗的利益有效性弊大于利
2.1 胎儿窦性心动过缓及AVB 近年,在胎儿心动过缓疾病谱,母体自身抗体阳性胎儿AVB发生机制,CAVB危险因素及预后不良的因素,胎儿心动过缓宫内治疗探索等诸多方面都取得了较大进步。
2008至2010年西班牙9个研究中心共纳入了37例胎儿心动过缓[14], Ⅱ°及以上AVB 19例,APB二联律伴房室阻滞15例,窦性心动过缓3例;AVB病例中,16%伴有先天性心脏病,63%与母体抗SSA/Ro抗体相关,21%为特发性。Roy等[15]及Tunks等[16]分别回顾性分析了11例及37例伴有孕妇抗SSA/Ro抗体阳性的孤立性CAVB患胎的围生期结局,结果表明,胎儿CAVB诊断时间约为妊娠24周,母体无症状在文献[15]和[16]中分别为45%和50%,母体患有SLE分别为25%和30%,母体患有未分类结缔组织病分别为15%和23%,母体患有干燥综合征(SjS)分别为9%和13%,母体患有强直性脊柱炎分别为0和3%。诊断后均给予孕妇地塞米松4 mg·d-1口服治疗,胎儿宫内死亡在文献[15]和[16]中分别为9%和16%,患胎出生后心室率75~85·min-1的比例均为10%,尚能满足生长发育需求,出生后需要植入永久起搏器的比例分别为36.3%和72.2%,与Isayama等[17]及Eronen等[18]的研究报道相似。这些研究预示胎儿CAVB宫内预后不良的因素有:胎儿水肿、胎心率<55·min-1、男性、合并心内膜弹力纤维增生症(EFE)、瓣膜功能不良、扩张性心肌病、低出生体重、早产以及新生儿狼疮(NLE),而最根本的原因是胎心率过低、胎儿心肌收缩力减退等导致心排血量不足,而妊娠期口服羟氯喹及小剂量糖皮质激素是改善胎儿预后的有效措施[19]。Ambrosi等[20]进行的大样本研究显示,对纳入研究的145个家庭355次妊娠(抗SSA/Ro、抗SSB/La抗体阳性190例,阴性165例)进行对照研究,结果显示自身抗体阳性的孕妇中胎儿传导束损伤的发生率为12.1%,与孕妇年龄(孕妇年龄越大,胎儿心脏传导束损伤概率越高)、妊娠孕周和季节(妊娠18~24周处于每年1~3月份的胎儿心脏传导束损伤概率最高)有关,但与胎儿性别、胎次及产次无关。
胎儿CAVB围生期致残率及病死率高,50%~89%的孕妇患有临床或亚临床型结缔组织病,因而对抗SSA/Ro、抗SSB/La抗体阳性的母亲密切监测非常重要。多中心研究发现[21~23],如孕妇患有免疫系统疾病,其血清中抗SSA/Ro和抗SSB/La等自身抗体通过胎盘沉积在胎儿心肌导致炎性反应,最终出现纤维化,在传导系统中表现尤为明显。

表2 胎儿心动过缓的产前干预管理[4]
注 表中证据等级和推荐强度标准来自文献[13]。A级:证据来自多中心RCT或Meta分析;B级:证据来自单中心RCT或设计良好的非随机对照试验;C级:证据来自临床经验、描述性研究或专家委员会报告的意见;Ⅰ:证据表明或通常认为操作或治疗是有利和有效的;Ⅱa:操作或治疗的利益有效性利大于弊;Ⅱb:操作或治疗的利益有效性弊大于利
在抗SSA/Ro、抗SSB/La抗体阳性的母亲,自身抗体经胎盘转运进入胎儿体内对胎儿多系统造成损伤,这种影响在胎儿心脏发育中分为2步[23]:①母亲自身抗体与胎儿心肌细胞结合后,使受累细胞钙稳态失调,导致心脏免疫球蛋白沉积增加,渐进性损伤传导系统组织,进一步诱导细胞凋亡,这一过程可能对应临床PR间期延长和Ⅰ°AVB,是可逆性的;②炎症在有遗传背景的胎儿体内持续蔓延,逐步进展为房室结纤维化、钙化,导致CAVB发生。早期对不完全性AVB糖皮质激素治疗可在一定程度上预防CAVB发生,因而在临床上早期识别高危妊娠非常重要。
对于心脏结构正常的胎儿,胎儿CAVB大部分与母体抗SSA/Ro、抗SSB/La抗体阳性相关,这种免疫损伤常导致妊娠16~17周胎儿即可表现出AVB,妊娠20~24周或更早即可发生CAVB病理演变过程,一旦出现CAVB就不可逆,因此尽量寻找预测CAVB风险的生物学标志物非常重要。近年Phoon等[19]及Friedman等[22]报道了PR间期及地塞米松疗效评价(PRIDE)研究,纳入了127例母体抗SSA/Ro、抗SSB/La抗体阳性的胎儿,结果提示,PR间期>150 ms考虑PR间期延长,可诊断为Ⅰ°AVB。研究认为尽管尚不能明确胎儿PR间期延长对CAVB的预测作用,Ⅰ°AVB也并非CAVB的必经过程,但通常认为PR间期延长及Ⅰ°AVB是CAVB的早期表现,故应非常重视PR间期监测(图4)[19,22]。免疫性抗体相关的胎儿传导束损伤进展迅速,因而对母体抗SSA/Ro、抗SSB/La抗体阳性的胎儿应密切监测PR间期变化,及早处理,防止传导束发生不可逆免疫损伤[19~24]。
若不治疗,胎儿窦性心动过缓及CAVB等缓慢性胎儿心律失常有较高的致残率及病死率[1~6,21~23]。目前尚无广泛认可的胎儿缓慢性心律失常宫内治疗策略及成熟方案,主要采用拟交感肾上腺能药物、地塞米松等单用或联合使用。针对胎儿心动过缓症状,可使用孕妇口服拟交感肾上腺能药物提升胎儿心率,可采用静脉注射沙丁胺醇后改为口服特布他林维持治疗,多能提升胎儿心率15%~25%,异丙肾上腺素对胎儿心率无明显提升作用[25,26]。总之,目前围生医学、胎儿医学对各种类型胎儿心律失常临床处理的最优方案尚未达成共识。
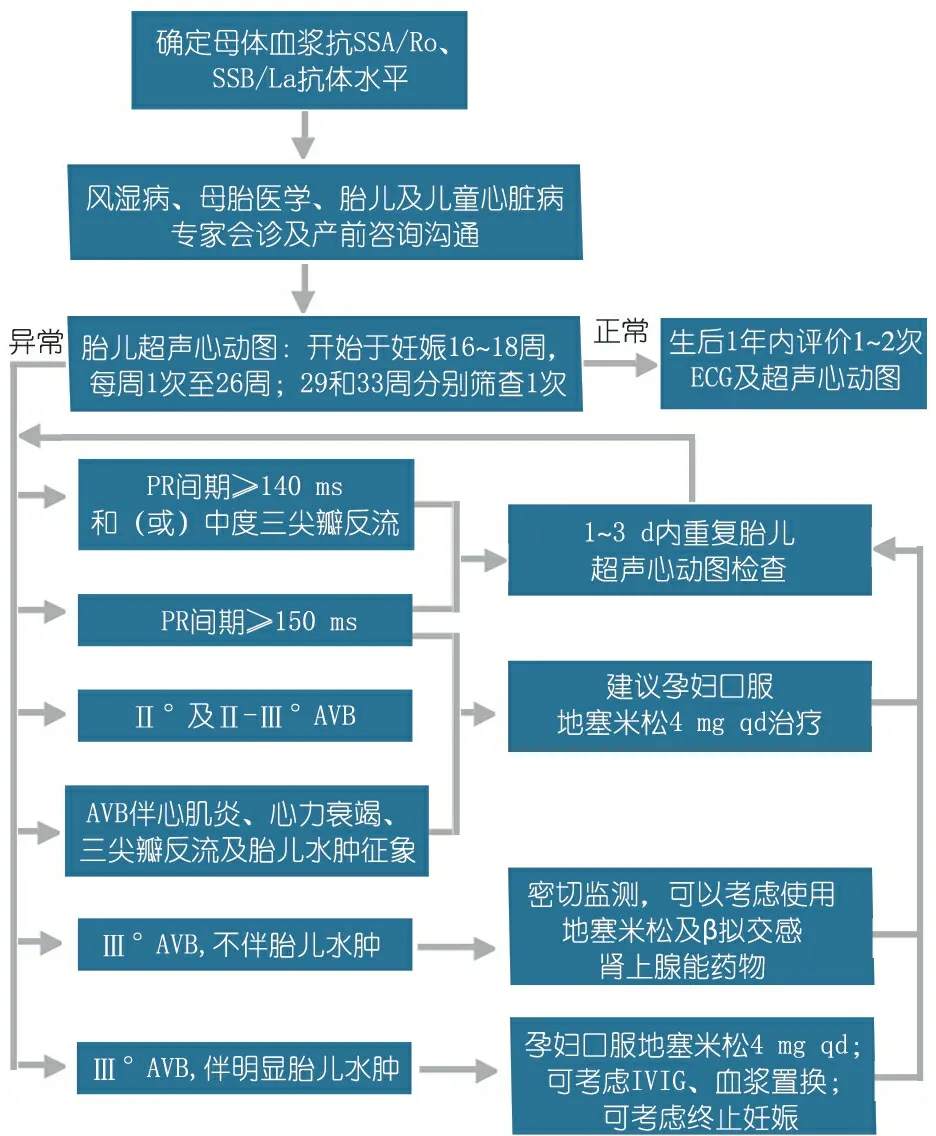
图4 PRIDE研究建议的基于PR间期的胎儿心动过缓检测、治疗管理流程
Notes AVB:房室传导阻滞。引自Friedman DM.AmJCardiol, 2009, 103(8):1102-1106
2.2 胎儿LQTS 研究表明,宫内胎儿病死率约为1%,其中胎儿LQTS是重要因素[27,28],胎儿LQTS与复杂类型胎儿心律失常伴发存在,如TdP、Ⅱ°AVB等,相当比例的病例有家族史,一般认为胎心率<110·min-1应考虑到胎儿LQTS可能,fUCG对此诊断较为困难,可借助fMCG进行诊断及预后研究。Cuneo等[11]研究纳入30例有LQTS家族史的孕妇,用fMCG测量不同胎龄胎儿心率反应性、QT时间、T波特点、TdP发作及终止时间,并与新生儿心电图进行比较,并进行了新生儿LQTS相关基因突变检测,结果提示:fMCG可初步诊断LQTS类型;当胎儿矫正QT间期(QTc)>620 ms可进行宫内LQTS筛查,胎儿QTc>490 ms可预测胎儿发生TdP,上述结果可用于产前、产后LQTS危险度分层管理。
2013年发表的1篇Meta分析[12]检索纳入了1979至2011年以主题词为“long QT syndrome”、“fetal arrhythmia”和“congenital heart disease”的相关英文文献30篇,研究结果表明,LQTS占胎心率<110·min-1的心脏结构正常胎儿心动过缓的15%~17%,胎儿LQTS的征象为胎儿AVB、短暂心动过速、心包积液和胎儿水肿。此外,胎儿LQTS等离子通道病发生机制多样,临床表现各异,常与复杂类型的胎儿心律失常伴发存在,可纳入胎儿不规则心律进行管理。
2.3 胎儿不规则心律的产前管理及干预 胎儿不规则心律包括胎儿异位心搏、Ⅱ°AVB和LQTS等,大部分预后相对良好[1~5]。由于常规听诊等检查手段很难区分APB、室性期前收缩和其他严重心律失常类型(如LQTS、Ⅱ°AVB),因而对频发胎儿异位心搏(如期前收缩二联律、三联律等)应通过fUCG进行心脏结构基线评价,并判断心律失常机制。若胎儿期前收缩性质不明,或异位搏动持续1~2周仍未消失,就应进行fUCG检查。胎儿APB远比室性期前收缩常见[1~5],胎儿异位心搏导致胎儿心动过速发生风险为0.5%~1.0%,二联律及房室阻滞可能增加胎儿心动过速发生风险[1~5]。对胎儿室性期前收缩、频发胎儿APB不推荐首先使用药物治疗,而是建议每周随访监测。2014年AHA“胎儿心血管疾病诊断治疗科学声明”[4]中总结了胎儿不规则心律的产前管理及干预方式的证据等级和推荐强度(表3)。
2.4 胎儿心动过缓起搏器治疗 1986年Carpenter等[29]完成了首例胎儿CAVB的起搏器手术植入。2003年Assad等[30]经母体腹部、子宫、胎儿胸壁穿刺胎儿左心室心肌,通过18G穿刺鞘组植入新型T型起搏导管进行胎儿心脏起搏,胎儿起搏心率为140·min-1。尽管上述研究结果不理想,最终胎儿均死亡,但这种治疗方式激励学者们进行相关探索。2005年Fayn等[31]在人类胎儿进行了超声引导下胎儿起搏器植入的可行性研究,研究中对起搏器大小、电池要求、不同胎龄胎儿剑突至心包距离和穿刺角度、不同胎儿心力衰竭状态下的起搏指征及模式等临床问题进行探索,这些经验的积累无疑将促进胎儿心脏起搏治疗技术的进步。胎儿起搏器植入难度及风险大,为了能够对需要起搏器治疗的患胎有效地成功实施治疗,学者们对妊娠期的试验胎猪、胎兔、胎狗、 胎大鼠和胎仓鼠进行了起搏器植入的系列
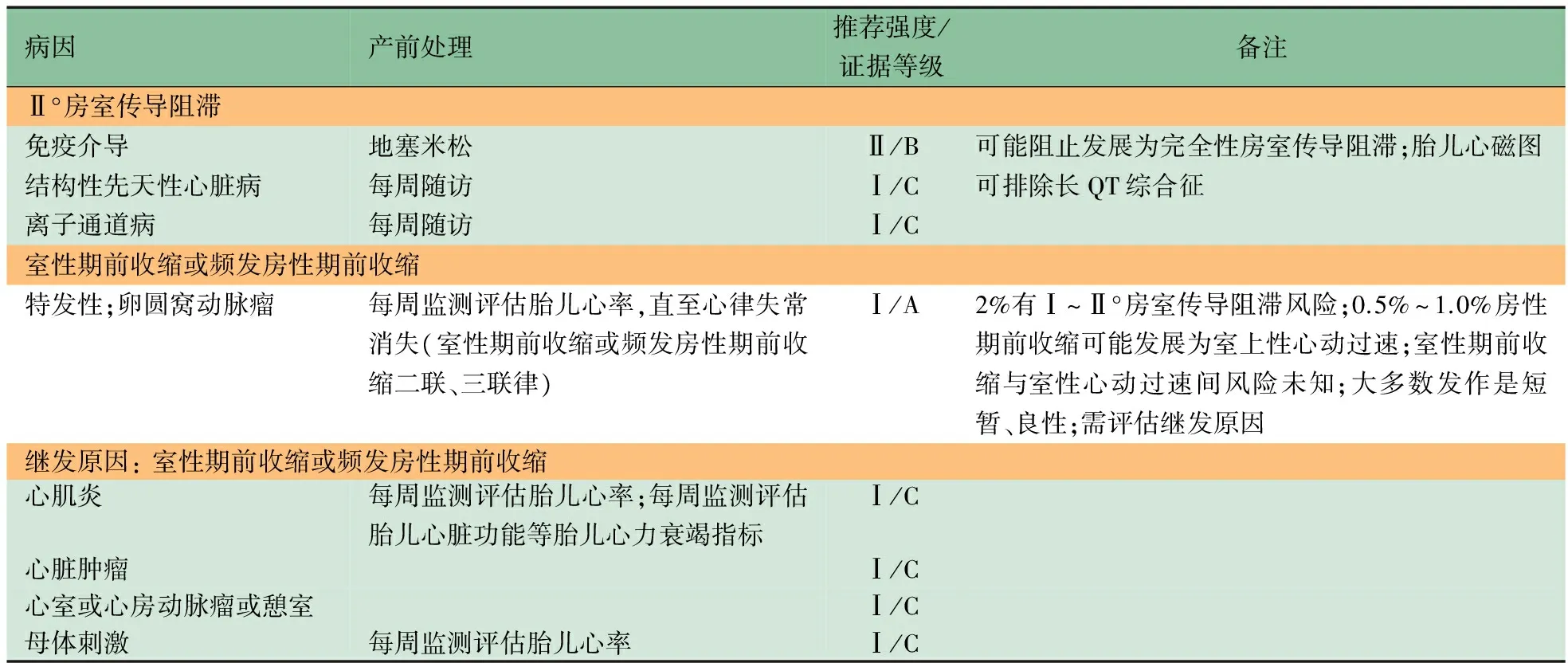
表3 胎儿不规则心律产前处理[4]
注 表中证据等级和推荐强度标准来自文献[13]。A级:证据来自多中心RCT或Meta分析;B级:证据来自单中心RCT或设计良好的非随机对照试验;C级:证据来自临床经验、描述性研究或专家委员会报告的意见;Ⅰ:证据表明或通常认为操作或治疗是有利和有效的;Ⅱ:对操作或治疗的利益及有效性的证据有争议,观点有分歧
研究[32~37],并通过注射抗SSA/Ro抗体建立了CAVB 胎猪模型进行水肿胎猪起搏器植入可行性研究,也有学者研究不同起搏部位对胎鼠心排量的影响,并研究干细胞植入胎鼠心肌后生物起搏效果,同时对新型胎儿起搏器进行设计及改良,以期更加符合胎儿特点。
3 胎儿缓慢性心律失常临床困境及展望
对于胎儿缓慢性心律失常RCT研究最大的限制是患者群体小,在目前尚无统一研究标准的状况下,多中心研究更加难以实施[38]。此外这种困境还源于以下因素[38]:①与无水肿胎儿相比,水肿胎儿需要更为紧急及有力的治疗,无法进行随机分组;②目前缺乏占主导地位的疗法,联合用药、分层研究以及分期分阶段治疗要求更大的胎儿群体;③胎儿心脏病学领域医疗实践需要多学科合作,在不同医学中心,占团队主导地位的医生群体不同,负责治疗的医生相关知识及认知程度不同,缺乏统一的培训达到统一认识,决定了临床实践模式不同。上述多因素造成前瞻性研究及达到统一标准及认知的困境。相信随着2014年AHA关于“胎儿心血管疾病诊断治疗科学声明”中关于胎儿缓慢性心律失常诊疗管理相关方案的发布,各国学者将结合临床实际,制定符合统一标准的可行性方案,共同促进胎儿心脏病学的极大进步。
[1]Kleinman CS. Cardiac arrhythmias in the human fetus. Pediatr Cardiol, 2004, 25(3) : 234-251
[2]McElhinney DB, Tworetzky W, Lock JE. Current status of fetal cardiac intervention. Circulation, 2010, 121(10):1256-1263
[3]Magnus W. Fetal medicine and treatment. Handb Exp Pharmacol, 2011, 205:271-283
[4]Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation, 2014, 129(21):2183-2242
[5]ApiCarvalho JS. Best Pract ice & Research in Clinical Obst et rics. Gynaecology, 2008, 22(1): 31-48
[6]Simcha Y, Norman HS, Ulrich G. Fetal Cardiology (Embryology, Genetics, Physiology, Echocardiographic Evaluation, Diagnosis and Perinatal Management of Cardiac Diseases, 2nd), 2009:449-482
[7]Eibschitz I, Abinader EG, Klein A, et al. Intrauterine diagnosis and control of fetal ventricular arrhythmia during labor. Am J Obstet Gynecol, 1975, 122(5):597-600
[8]Newburger JW, Keane JF. Intrauterine supraventricular tachycardia. J Pediatr, 1979, 95(5 Pt 1):780-786
[9]Yu S, Van Veen BD, Wakai RT. Detection of T-wave alternans in fetal magnetocardiography using the generalized likelihood ratio test. IEEE Trans Biomed Eng, 2013, 60(9):2393-2400
[10]Kiefer-Schmidt I, Lim M, Wacker-Gussmann A, et al. Fetal magnetocardiography (fMCG): moving forward in the establishment of clinical reference data by advanced biomagnetic instrumentation and analysis. J Perinat Med, 2012, 40(3):277-286
[11]Cuneo BF, Strasburger JF, Yu S, et al. In utero diagnosis of long QT syndrome by magnetocardiography. Circulation, 2013, 128(20): 2183-2191
[12]Ishikawa S, Yamada T, Kuwata T, et al. Fetal presentation of long QT syndrome--evaluation of prenatal risk factors: a systematic review. Fetal Diagn Ther, 2013, 33(1):1-7
[13]Methodology Manual and Policies From the ACCF/AHA Task Force on Practice Guidelines. American College of Cardiology Foundation and American Heart Association, Inc. 2010, http:// assets.cardiosource.com/Methodology_Manual_for_ACC_AHA_Writing_Committees.pdf and http://my.americanheart.org/idc/groups/ahamah-public/@wcm/@sop/documents/downloadable/ucm_319826.pdf. Accessed May 16, 2012
[14]Perin F, Rodríguez Vázquez Del Rey MM, Deiros Bronte L, et al. Fetal bradycardia: A retrospective study in 9 Spanish centers. An Pediatr (Barc), 2014, 81(5):275-282
[15]Roy KK, Subbaiah M, Kumar S, et al. Feto-maternal outcome in pregnancies complicated by isolated fetal congenital complete heart block. J Obstet Gynaecol, 2014, 34(6):492-494
[16]Tunks RD, Clowse ME, Miller SG, et al. Maternal autoantibody levels in congenital heart block and potential prophylaxis with antiinflammatory agents. Am J Obstet Gynecol, 2013, 208(1):64.e1-7
[17]Isayama T, Inamura N, Shiono N, et al. Neonatal lupus erythematosus complicated by improved congenital complete heart block. Pediatr Int, 2013, 55(4):521-524
[18]Eronen M, Sirèn MK, Ekblad H, et al. Short- and long-term outcome of children with congenital complete heart block diagnosed in utero or as a newborn. Pediatrics, 2000, 106(1 Pt 1):86-91
[19]Phoon CK, Kim MY, Buyon JP, et al. Finding the "PR-fect" solution: what is the best tool to measure fetal cardiac PR intervals for the detection and possible treatment of early conduction disease? Congenit Heart Dis, 2012, 7(4):349-360
[20]Ambrosi A, Salomonsson S, Eliasson H, et al. Development of heart block in children of SSA/SSB-autoantibody-positive women is associated with maternal age and displays a season-of-birth pattern. Ann Rheum Dis, 2012, 71(3):334-340
[21]Jaeggi ET, Fouron JC, Silverman ED, et al. Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease. Circulation, 2004, 110(12):1542-1548
[22]Friedman DM, Kim MY, Copel JA, et al. Prospective evaluation of fetuses with autoimmune-associated congenital heart block followed in the PR Interval and Dexamethasone Evaluation (PRIDE) Study. Am J Cardiol, 2009, 103(8):1102-1106
[23]Wahren-Herlenius M, Sonesson SE. Specificity and effector mechanisms of autoantibodies in congenital heart block. Curr Opin Immunol, 2006, 18(6): 690-696
[24]Makino S, Yonemoto H, Itoh S, et al. Effect of steroid administration and plasmapheresis to prevent fetal congenital heart block in patients with systemic lupus erythematosus and/or Sjögren's syndrome. Acta Obstet Gynecol Scand, 2007, 86(9):1145-1146
[25]Mevorach D, Elchalal U, Rein AJ. Prevention of complete heart block in children of mothers with anti-SSA/Ro and anti-SSB/La autoantibodies: Detection and treatment of first-degree atrioventricular block. Curr Opin Rheumatol, 2009, 21(5): 478-482
[26]Anami A, Fukushima K, Takasaki Y, et al. The predictive value of anti-SS-A antibodies titration in pregnant women with fetal congenital heart block. Mod Rheumatol, 2013, 23(4):653-658
[27]Crotti L, Tester DJ, White WM, et al. Long QT syndrome-associated mutations in intrauterine fetal death. JAMA, 2013, 309(14):1473-1482
[28]Mitchell JL, Cuneo BF, Etheridge SP, et al. Fetal heart rate predictors of long QT syndrome. Circulation, 2012, 126(23): 2688-2695
[29]Carpenter R, Strasburger JF, Garson A, et al. Fetal ventricular pacing for hydrops secondary to complete atrioventricular block. J Am Coll Cardiol, 1986, 8(6):1434-1436
[30]Assad RS, Zielinsky P, Kalil R, et al. New lead for in utero pacing for fetal congenital heart block. J Thorac Cardiovasc Surg, 2003, 126(1):300-302
[31]Fayn E, Chou HA, Park D, et al. Ultrasonic biophysical measurements in the normal human fetus for optimal design of the monolithic fetal pacemaker. Am J Cardiol, 2005, 95(10):1267-1270
[32]Dell'Orfano J, Chou HA, Park D, et al. The monolithic fetal pacemaker: prototype lead design for closed thorax deployment. Pacing Clin Electrophysiol, 2003, 26(4): 805-811
[33]Loeb GE, Zhou L, Zheng K, et al. Design and testing of a percutaneously implantable fetal pacemaker. Ann Biomed Eng, 2013, 41(1):17-27
[34]Zhou L, Chmait R, Bar-Cohen Y, et al. Percutaneously injectable fetal pacemaker: electrodes, mechanical design and implantation. Conf Proc IEEE Eng Med Biol Soc, 2012:6600-6603
[35]Loeb GE, Zhou L, Zheng K, et al. Design and testing of a percutaneously implantable fetal pacemaker. Ann Biomed Eng, 2013, 41(1):17-27
[36]Dell'Orfano J, Chou HA, Park D, et al. The monolithic fetal pacemaker: prototype lead design for closed thorax deployment. Pacing Clin Electrophysiol, 2003, 26(4 Pt 1):805-811
[37]Ruhparwar A, Tebbenjohanns J, Niehaus M, et al. Transplanted fetal cardiomyocytes as cardiac pacemaker. Eur J Cardiothorac Surg, 2002, 21(5):853-857
[38]Saul JP, Cain NB. Can we do a prospective trial for fetal arrhythmia? The barriers to clinical trials in small patient populations. Circulation, 2011, 124(16): 1703-1705
(本文编辑:张萍)
10.3969/j.issn.1673-5501.2014.06.012
国家自然科学基金:81070136、81270226;四川省科技支撑计划项目:2014SZ0009;成都市科技项目 :2014-HM01-00006-SF;长江学者和创新团队发展计划:IRT0935
四川大学华西第二医院儿童心血管科,妇儿疾病与出生缺陷教育部重点实验室,四川大学华西第二医院西部妇幼研究院 成都,610041
华益民,E-mail:nathan_hua@163.com
2014-10-17
2014-11-20)
