miR-155特异性siRNA增强阿糖胞苷诱导的Burkitt淋巴瘤Raji细胞凋亡*
2014-08-09刘平平朱锦灿刘善淘谭广销何冬梅刘革修
刘平平, 朱锦灿, 郑 力, 刘善淘, 谭广销, 何冬梅, 刘革修△
(1清华大学第一附属医院血液肿瘤科,北京 100016; 2暨南大学医学院血液病研究所, 广东 广州 510632)
Burkitt淋巴瘤是一种罕见而又高度恶性的非霍奇金淋巴瘤,约占成人非何杰金淋巴瘤的1%~5%。虽然利妥昔单克隆抗体使Burkitt淋巴瘤患者的总生存率有了明显提高,但是化疗依然是本病主要的治疗方案。然而化疗仍然存在多种不良反应,如高强度阿糖胞苷(cytosine arabinoside,Ara-C)可导致骨髓抑制、高尿酸血症、骨骼和肌肉疼痛、咽痛、发热、全身不适等。所以,进一步研究提高疗效方案,增强其对化疗药物敏感性,对治疗具有重要意义。最近研究[1-6]发现miR-155在肿瘤中高表达可能直接或间接地抑制肿瘤细胞凋亡,如其在小儿Burkitt淋巴瘤、弥漫大B细胞性淋巴瘤、原发纵隔B细胞淋巴瘤和霍奇金淋巴瘤中的表达水平远远高于正常循环中B细胞,而且表达水平高者预后较差。本研究将通过观察miR-155特异性siRNA对Ara-C诱导Burkitt淋巴瘤Raji细胞凋亡的影响,为Burkitt 淋巴瘤的临床治疗研究提供基础依据。
材 料 和 方 法
1 材料
LipofectamineTM2000购于Invitrogen;miR-155 siRNA由上海吉玛公司设计及合成;miRcute miRNA cDNA第1链合成试剂盒和miRcute miRNA 荧光定量检测试剂盒购于天根生化科技有限公司;CCK-8试剂盒购于同仁化学研究所; 阿糖胞苷购于苏州市尤利特生物医药科技有限公司;annexin V/PI双染试剂盒购于碧云天生物技术研究所;RPMI-1640培养基和胎牛血清购于HyClone;Burkitt淋巴瘤Raji细胞株由本实验室保存。
2 方法
2.1细胞培养 将Raji细胞接种于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基中置于37 ℃、5% CO2、饱和湿度孵育箱中培养。
2.2CCK-8法检测细胞增殖活性 实验分为正常对照组、溶媒对照组、Ara-C组(浓度分别为:2.5、5、10、20 mg/L)、siRNA组(浓度分别为:0.1、0.3、0.9、2.7、8.1 μmol/L)和Ara-C+siRNA组,根据LipofectamineTM2000操作说明进行siRNA转染。取对数生长期细胞以2×107/L密度接种于96孔板中, 每孔200 μL,置于37 ℃、5% CO2、饱和湿度孵育箱中培养。培养48 h后采用CCK-8法检测,并通过以下公式计算增殖抑制率:增殖抑制率(%)=[1-(实验组A450-正常组A450)/正常组A450]×100%,实验重复3次。
2.3qRT-PCR检测miR-155的表达 取对数生长期细胞以5×107/L密度接种于6孔板中, 每孔2 000 μL,以1.0 μmol/L siRNA转染干预, 24 h后,收集细胞,加入miRcute miRNA提取分离试剂盒提取miRNA,经纯度及电泳检测后,根据miRcute miRNA cDNA第一链合成试剂盒操作说明,反转录合成cDNA第1链,采用实时荧光定量PCR 法检测miR-155的表达,以U6 snRNA为内参照,采用2-ΔΔCt法进行miR-155相对表达量的计算。其中,U6 snRNA上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。miR-155上游引物5’-GCGGTTAATGCTAATCGTGAT-3’,下游引物5’-GTGCAGGGTCCGAGGT-3’。
2.4细胞凋亡的检测 Annexin V-PI 双染观察经不同处理后的Raji细胞凋亡率。取转染48 h后各组Raji细胞, 加入195 μL annexin V-FITC结合液轻轻重悬细胞,加入5 μL annexin V-FITC轻轻打匀,室温避光孵育10 min,离心弃上清,190 μL annexin V-FITC结合液重悬细胞,加入10 μL PI染色液,冰浴避光,行流式细胞术检测。
2.5Western blotting印迹法检测 Ara-C(5 mg/L)单独或联合miR-155 siRNA处理Raji细胞48 h,收集并PBS洗2遍,加入蛋白抽提液抽提总蛋白,BCA法测定蛋白浓度,经10% SDS-PAGE电泳分离后,常规转移至PVDF膜,5%脱脂牛奶封闭液封闭1 h。鼠抗人caspase-3和GAPDH抗体4 ℃过夜,1∶2 000稀释的HRP标记Ⅱ抗室温孵育1 h,用TBST洗3次,ECL显色液显色。
3 统计学处理
采用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析(One-way ANOVA),多重比较采用SNK-q或Tukey检验。以P<0.05为差异有统计学意义。
结 果
1 转染后miR-155表达水平
转染后24 h,提取总RNA,qRT-PCR检测各组细胞miR-155的表达水平,见图 1。其中miR-155 siRNA组(siRNA group)分别与未转染组(normal group)及无义转染组(scrambled control group)相比,miR-155表达量显著下降,差异有统计学意义(P<0.05),未转染组与无义序列转染组比较,差异无统计学意义(P>0. 05)。
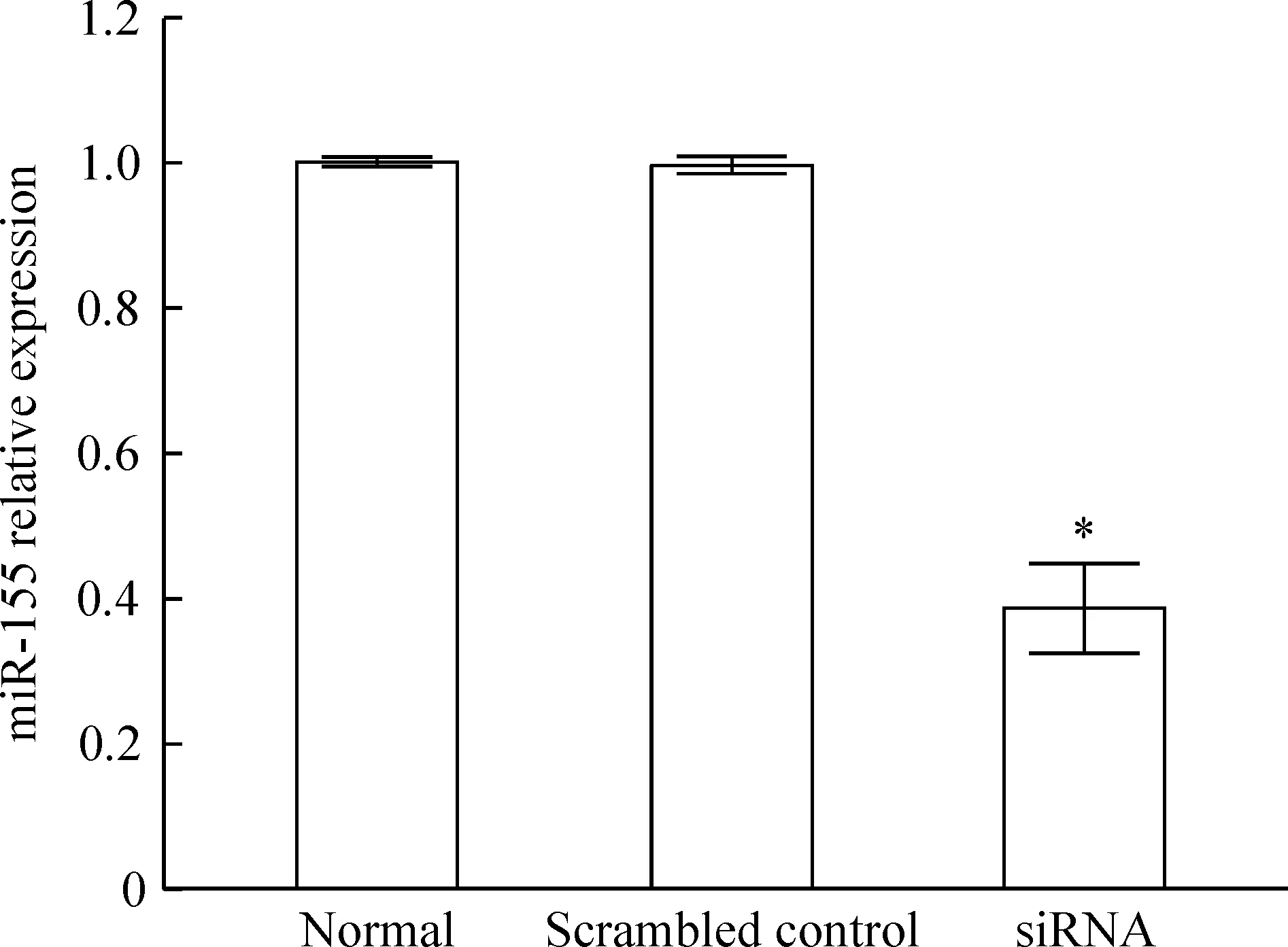
Figure 1. The relative expression of miR-155 in Raji cells after transfection with miR-155 siRNA.Mean±SD.n=3.*P<0.05 vs normal group.
2 miR-155 siRNA与Ara-c单独及联合作用对Raji细胞增殖的抑制作用
CCK-8结果显示,miR-155 siRNA单独处理Raji细胞显现出一定程度的增殖抑制作用,不同浓度的Ara-C均显示出增殖抑制性,并呈量效关系,与正常组比较差异有统计学意义(P<0.05);同时,miR-155 siRNA与Ara-C联合作用于Raji细胞后,增殖抑制率明显高于相应Ara-C,差异有统计学意义(P<0.05),见图2。这表明转染miR-155 siRNA入Raji细胞后可使Ara-C抑制增殖的作用明显增强。
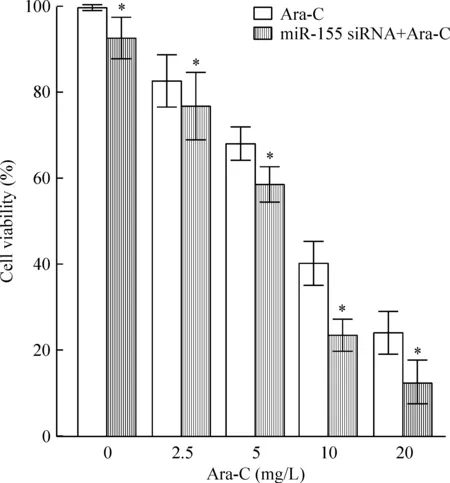
Figure 2. Ara-C alone or in combination with miR-155 siRNA inhibited the proliferation of Raji cells.Mean±SD.n=3.*P<0.05 vs Ara-C group.
3 Annexin V-PI 双标记检测Raji细胞凋亡
流式细胞术结果显示siRNA+Ara-C组凋亡率为 (38.4±1.4)%;Ara-C组、siRNA组凋亡率分别为 (16.5±0.3)%和 (14.6±0.3)%。siRNA+Ara-C组与Ara-C组、siRNA组及对照组[(3.6±0.4)%]相比都有显著差异(P<0.05),见图3。这表明miR-155 siRNA与Ara-C联合作用比单用miR-155 siRNA或Ara-C显示出更强的诱导Raji细胞凋亡的作用。

Figure 3. The effects of Ara-C alone or combined with miR-155 siRNA on the apoptosis of Raji cells.Mean±SD.n=3.*P<0.05 vs Ara-C group.
4 miR-155 siRNA联合阿糖胞苷对Raji细胞caspase-3蛋白表达的影响
与Ara-C(5 mg/L)单独使用相比,Ara-C(5 mg/L)与miR-155 siRNA联合作用于Raji细胞,其caspase-3蛋白的表达显著增加,见图4。
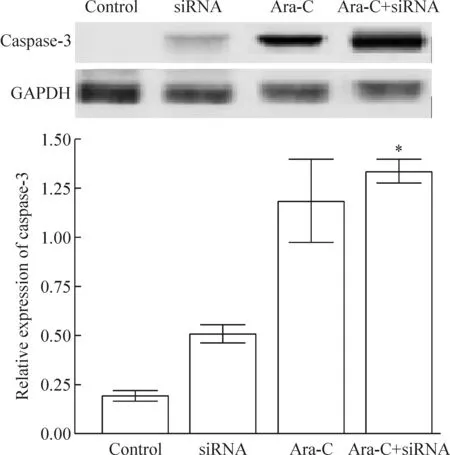
Figure 4. The effects of Ara-C or combined with miR-155 siRNA on the protein expression of caspase-3 in Raji cells.Mean±SD.n=3.*P<0.05 vs Ara-C group.
讨 论
miRNA以不完全互补的方式与靶基因mRNA的3’UTR结合,调控多个靶基因,或多个miRNA共同调节一些特殊的靶基因[7]。siRNA是两端各有2个碱基突出并小于25个碱基对的双链RNA。采用RNAi技术在多种白血病细胞系中封闭白血病特异癌基因的表达已有报道[8]。因此,通过siRNA技术封闭与肿瘤发生发展相关的miRNA的表达具有良好的研究前景。
miR-155位于21号染色体,由来自于B细胞整合簇上非编码RNA的外显子转录而形成[9-11],在小儿Burkitt淋巴瘤的表达水平远远高于正常。Yamanaka等[12]研究进一步发现,miR-155在淋巴瘤中的治疗具有良好的应用前景。另有研究发现NK细胞淋巴瘤高表达miR-155,并进而导致了PTEN、PDCD4和SHIP1低表达以及AKT(Ser473)高磷酸化,通过反义寡核苷酸干扰miR-155表达后可提高PTEN、PDCD4和SHIP1表达,下调AKT(Ser473)磷酸化,抑制肿瘤增殖,提示miR-155在淋巴瘤发病及治疗方面有重要作用[13]。阿糖胞苷是一种细胞周期特异性药物,通过干扰细胞增殖S期的嘧啶类代谢,抑制细胞增殖。阿糖胞苷进入人体后经激酶磷酸化为阿糖胞苷三磷酸及阿糖胞苷二磷酸,前者可抑制 DNA 聚合酶的合成,后者则抑制二磷酸胞苷转变为二磷酸脱氧胞苷,从而抑制细胞 DNA 聚合及合成[14]。研究报道,caspase-3是miR-155的靶点[15]。
本研究通过应用miR-155 siRNA和Ara-C单独及联合作用于Raji细胞,观察miR-155 siRNA能否增强Ara-C对Raji细胞的增殖凋亡作用。在本研究中,将miR-155 siRNA转染至Raji细胞后能显著干扰miR-155的表达。接着通过CCK-8检测发现,miR-155 siRNA与Ara-C联合作用较单独使用miR-155 siRNA或Ara-C有更明显的抑制增殖作用。为了探讨联合作用对Raji细胞凋亡的影响,行流式细胞术检测发现,联合使用miR-155 siRNA能显著增强Ara-C单独使用时诱导Raji细胞凋亡的作用。具体机制则与miR-155 siRNA通过抑制miR-155表达而上调caspase-3的表达有关,与文献报道一致[15]。
综上所述,miR-155 siRNA与阿糖胞苷联合作用于Raji细胞可增强阿糖胞苷的抑制增殖作用及促凋亡作用。本研究结果为今后临床Burkitt 淋巴瘤治疗研究提供基础依据。
[参 考 文 献]
[1] Huang X, Shen Y, Liu M, et al. Quantitative proteomics reveals that miR-155 regulates the PI3K-AKT pathway in diffuse large B-cell lymphoma[J]. Am J Pathol, 2012, 181(1):26-33.
[2] Rai D, Kim SW, McKeller MR, et al. Targeting of SMAD5 links microRNA-155 to the TGF-beta pathway and lymphomagenesis[J]. Proc Natl Acad Sci U S A, 2010, 107(7):3111-3116.
[3] Dagan LN, Jiang X, Bhatt S, et al. miR-155 regulates HGAL expression and increases lymphoma cell motility[J]. Blood, 2012,119(2):513-520.
[4] Kopp KL, Ralfkiaer U, Gjerdrum LM, et al. STAT5-mediated expression of oncogenic miR-155 in cutaneous T-cell lymphoma[J]. Cell Cycle, 2013, 12(12):1939-1947.
[5] Pouliot LM, Chen YC, Bai J, et al. Cisplatin sensitivity mediated by WEE1 and CHK1 is mediated by miR-155 and the miR-15 family[J]. Cancer Res, 2012, 72(22):5945-5955.
[6] Liu C, Iqbal J, Teruya-Feldstein J, et al. MicroRNA expression profiling identifies molecular signatures associated with anaplastic large cell lymphoma[J]. Blood, 2013, 122(12):2083-2092.
[7] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[8] Scherr M, Battmer K, Winkler T, et al. Specific inhibition ofbcr-ablgene expression by small interfering RNA[J]. Blood, 2003, 101(4):1566 -1569.
[9] Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Cur Biol, 2002, 12(9):735-739.
[10] Tam W, Ben-Yehuda D, Hayward WS.bic, a novel gene activated by proviral insertions in avian leukosis virus-induced lymphomas, is likely to function through its nonco-ding RNA[J]. Mol Cell Biol, 1997, 17(3):1490-1502.
[11] Wang J, Wu J. Role of miR-155 in breast cancer[M]. Front Biosci (Landmark Ed),2012,17:2350-2355.
[12] Yamanaka Y, Tagawa H, Takahashi N, et al. Aberrant overexpression of microRNAs activate AKT signaling via down-regulation of tumor suppressors in natural killer-cell lymphoma/leukemia[J]. Blood, 2009, 114(15):3265-3275.
[13] O’Connell RM, Chaudhuri AA, Rao DS, et al. Inositol phosphatase SHIPl is a primary target of miR-155[J]. Proc Natl Acad Sci U S A, 2009, 106(17):7113-7118.
[14] Grant S. Ara-C: cellular and molecular pharmacology [J]. Adv Cancer Res, 1998,72:197-233.
[15] Wang HQ, Yu XD, Liu ZH, et al. Deregulated miR-155 promotes Fas-mediated apoptosis in human intervertebral disc degeneration by targeting FADD and caspase-3[J]. J Pathol, 2011, 225(2): 232-242.
