RXR/VDR激动剂对糖尿病ApoE-/-小鼠胸主动脉硬化及NF-κB表达的调控*
2014-08-09刘永萍许昌声柴大军林金秀
刘永萍, 彭 峰, 许昌声, 柴大军, 林金秀△
(福建医科大学 1第一临床医学院,2附属第一医院心内科,福建省高血压研究所, 福建 福州 350005)
冠状动脉粥样硬化性心脏病(冠心病)是目前世界上最常见的心血管死亡原因,其主要病理学基础是冠状动脉发生粥样变化,而糖尿病是诱导动脉粥样硬化(atherosclerosis,AS)发生的独立危险因素。近年来的研究认为,AS的发生与核因子κB(nuclear factor kappa B,NF-κB)的活性有关[1]。NF-κB是具有多向转录调节作用的核蛋白因子,经高糖、低氧等刺激活化后参与调控多种细胞因子的生成,可引起平滑肌细胞由动脉中膜移行至内膜并增殖,进而触发动脉粥样斑块的形成。有研究发现补充视黄醇X受体(retinol X receptor,RXR)激动剂或维生素D(vitamin D,VD)均可抑制NF-κB的激活[2-3],由此我们推断:NF-κB的激活受核受体RXR和维生素D受体(vitamin D receptor,VDR)的调控。
RXR和VDR均属于核受体超家族中的重要成员,能够各自识别其特异性配体发挥生物学作用。有研究发现RXR激动剂可抑制AS的进展[4];近年来的流行病学调查及临床研究发现体内维生素D的含量与AS的发生密切相关[5-6]。本研究旨在观察RXR激动剂贝沙罗汀(bexarotene,Bex)和VDR激动剂骨化三醇(calcitriol,Cal)对链脲佐菌素(streptozotocin,STZ)诱导的载脂蛋白E(apolipoprotein E,ApoE)基因敲除(STZ-ApoE-/-)小鼠胸主动脉粥样硬化及NF-κB表达的调控,探讨Bex和Cal抗动脉粥样硬化的可能机制,为防治动脉粥样硬化提供新的思路。
材 料 和 方 法
1 动物和材料
8周龄ApoE-/-雄性小鼠(SPF级),购于北京大学医学部,合格证号为SCXK(京)2011-0012。
STZ(Sigma);Bex(Eisai);Cal(罗盖全;上海罗氏制药有限公司);β-actin单克隆抗体(Santa Cruz);NF-κB单克隆抗体(Cell Signaling);HRP标记Ⅱ抗(Abcam);免疫组化Ⅱ抗(北京中杉)。PVDF膜(Millipore);低温冰箱(日本三洋);超速低温离心机(AllegraTM64R,Beckman);垂直电泳槽(Bio-Rad);DYY-III-6B型稳压稳流电泳仪(北京六一仪器厂);蛋白转移设备(北京六一仪器厂)。
2 方法
2.1糖尿病模型的建立[7]70只小鼠(10只C57BL/6,60只ApoE-/-),体重22~24 g,普通饲料喂养在福建医科大学实验动物中心。适应性喂养1周后,50只ApoE-/-小鼠禁食12 h,腹腔注射STZ 150 mg/kg,连续2 d,(STZ配制:pH 4.4枸橼酸缓冲液10 mL加100 mg STZ充分溶解即成STZ溶液,浓度为10 g/L,腹腔注射STZ前动物禁食12 h,注射量为0.1 mL/10 g体重),注射STZ后给予自由饮水取食,3 d后,测空腹血糖≥11.2 mmol/L的ApoE-/-小鼠用于实验(共48只)。
2.2动物分组与取材 实验分6组:C57组、ApoE-/-组、STZ-ApoE-/-(糖尿病,diabetes mellitus,DM)组、STZ-ApoE-/-+Bex(10 mg·kg-1·d-1)组(Bex组)、STZ-ApoE-/-+Cal(10 μg/kg,每周2次)[8]组(Cal组)、STZ-ApoE-/-+Bex(10 mg·kg-1·d-1)+Cal(10 μg/kg,每周2次)组(Bex+Cal组)。连续灌胃12周,对照组给予同量生理盐水灌胃。用药12周后:小鼠眼底静脉取血约2 mL,随后立即行胸腹部切开,取胸主动脉于PBS漂洗,去除血迹及血管周围结缔组织,液氮冻存。
2.3Western blotting检测小鼠胸主动脉NF-κB p65蛋白表达水平 取胸主动脉50 mg于0.5 mL悬浮缓冲液[0.1 mol/L NaCl,0.01 mol/L Tris·HCl (pH 7.6),0.001 mol/L EDTA (pH 8.0),1 mg/L aprotinin,100 mg/L苯甲基磺酰氟(PMSF),200 μmol/L DTT(aprotinin和PMSF及DTT临用前加入)],匀浆,加入等体积的2×SDS,剧烈振荡并于-80 ℃冰箱冻融2次,放入水浴锅中100 ℃煮10 min,4 ℃ 12 000×g离心10 min,取上清分装,放入-80 ℃冰箱备用;经凝胶电泳、转膜、封闭、Ⅰ抗孵育、Ⅱ抗孵育、显影。Image 6.0成像分析系统分析。
2.4免疫组化法观察小鼠胸主动脉NF-κB p65的分布及表达水平 取胸主动脉于PBS漂洗,去除血迹及血管周围结缔组织,4%甲醛固定24 h,石蜡包埋切片常规脱蜡,3%H2O2室温孵育10 min,PBS浸泡5 min×3次,加入NF-κB单克隆抗体,4 ℃过夜。PBS冲洗,加适量组化Ⅱ抗,37 ℃孵育30 min;PBS冲洗后,DAB显色2~5 min,自来水冲洗,苏木素染色,70%、85%、95%乙醇梯度脱水,烤片机烤干,中性树脂封片。Image 6.0成像分析系统分析。
2.5苏木素-伊红染色(hematoxylin-eosin staining)步骤 取胸主动脉于PBS漂洗,去除血迹及血管周围结缔组织,4%甲醛固定24 h,石蜡包埋切片常规脱蜡,苏木素染色,水洗复染,70%、85%、95%乙醇梯度脱水,1%伊红乙醇染色,二甲苯透明,中性树脂封片。显微镜下观察斑块面积并拍照。
3 统计学处理
采用SPSS 19.0软件分析,数据以均数±标准差(mean±SD)表示,多组间的比较采用单因素方差分析(One-way ANOVA),各组两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
用药12周后,C57组及ApoE-/-组小鼠精神佳,皮毛光亮顺滑,活动量大,垫料干燥。STZ诱导的糖尿病小鼠均为精神萎靡,毛发稀疏凌乱,体重偏低,垫料较湿。DM组及Cal组因眼睛溃烂各死亡1只,Bex组左上肢瘫痪1只,各组均有不同程度的颊部脓肿形成,考虑是糖尿病的并发症。
1 各组小鼠空腹血糖的比较
与C57组相比,ApoE-/-组的血糖水平无明显变化,DM组的血糖明显增高(P<0.05);Bex和Cal对STZ-ApoE-/-小鼠的血糖无显著影响,见表1。
2 各组小鼠血脂的比较
与C57组相比,ApoE-/-组血清低密度脂蛋白(low-density lipoprotein,LDL)、总胆固醇(total cholesterol,TC)及甘油三酯(triglyceride,TG)水平升高(P<0.05);与ApoE-/-组相比,DM组的血清LDL和TC进一步升高(P<0.05),Bex和Cal对STZ-ApoE-/-小鼠的血清LDL、TC及TG无显著影响,Bex可升高血清高密度脂蛋白水平,见表1。
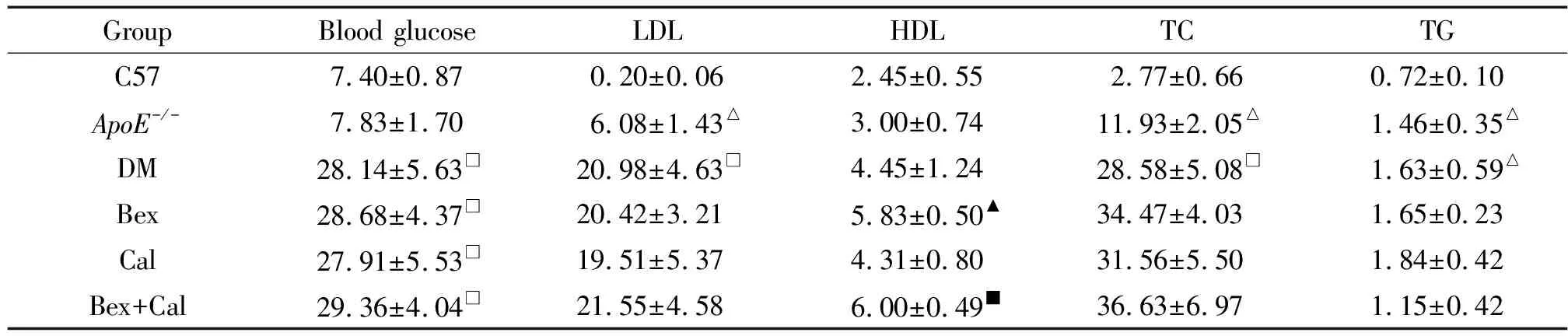
表1 各组小鼠空腹血糖、血脂水平的比较
3 Bex和Cal对NF-κB p65蛋白表达的影响
与C57组相比,ApoE-/-组和DM组的NF-κB p65蛋白水平增加(0.07±0.01vs0.84±0.09、0.86±0.10,P<0.05);与DM组相比,Bex组和Cal组的NF-κB p65蛋白减少(0.86±0.10vs0.67±0.01、0.65±0.10,P<0.05),Bex+Cal组的NF-κB p65蛋白水平减少更显著(0.86±0.10vs0.10±0.02,P<0.01),见图1。
4 免疫组化法观察Bex和Cal对小鼠主动脉内皮NF-κB p65分布的影响
染色结果出现棕色为NF-κB p65阳性。C57组小鼠的主动脉内膜下未见明显棕色沉淀,ApoE-/-组主动脉斑块处可见少许细胞浆棕染。与ApoE-/-组相比,DM组的NF-κB p65在细胞核分布明显增多(3 557.46±729.60vs11 500.49±1 415.49,P<0.01);与DM组相比,Bex组和Cal组的NF-κB p65减少(11 500.49±1 415.49vs4 755.55±578.88、5 416.21±767.90,P<0.05),Bex+Cal组减少更明显(11 500.49±1 415.49vs2 770.86±981.76,P<0.01),见图2。
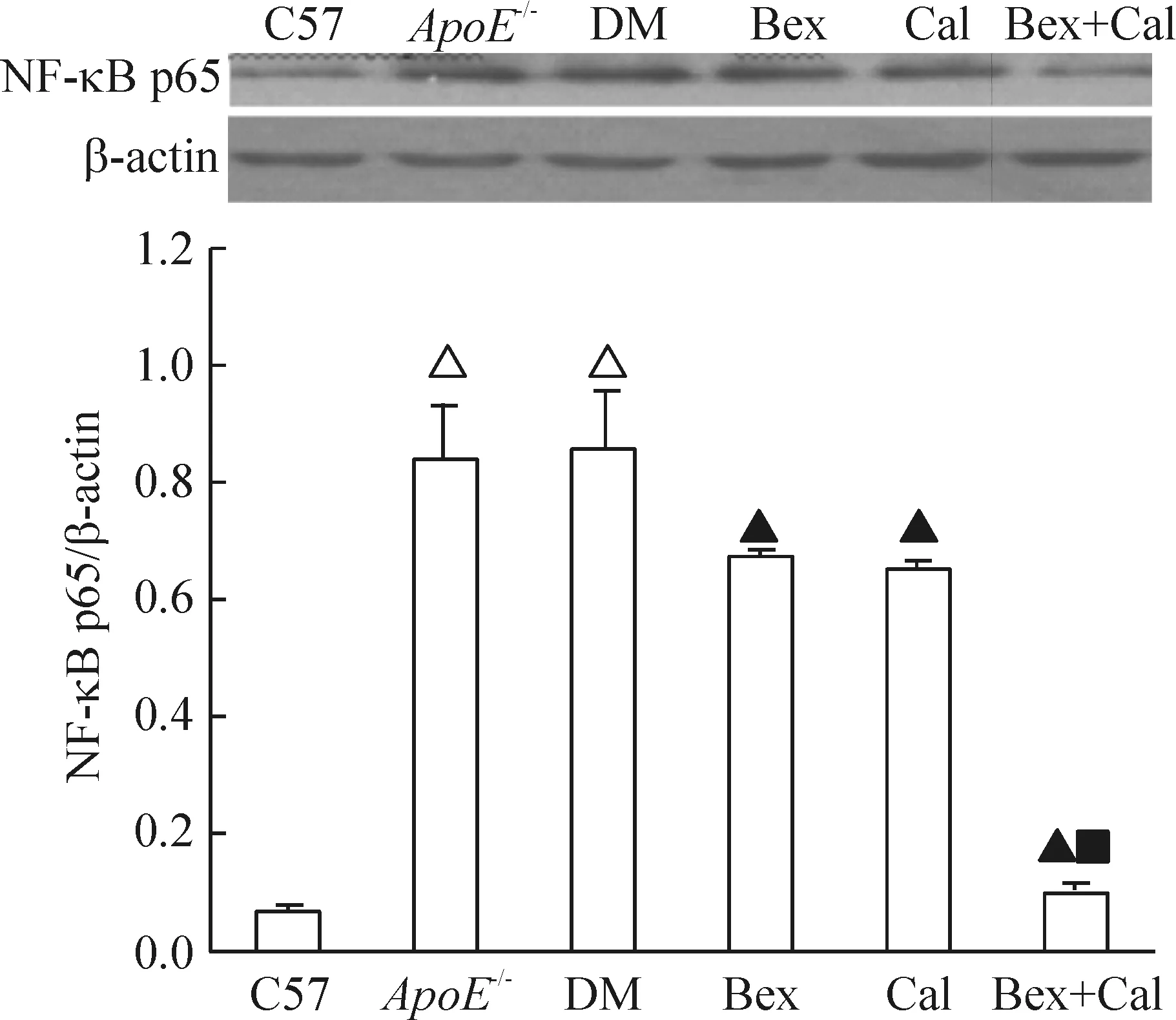
Figure 1. Effect of Bex and Cal on the protein expression of NF-κB p65. Mean±SD.n=3.△P<0.05 vs C57; ▲P<0.05 vs DM;■P<0.05 vs Cal.
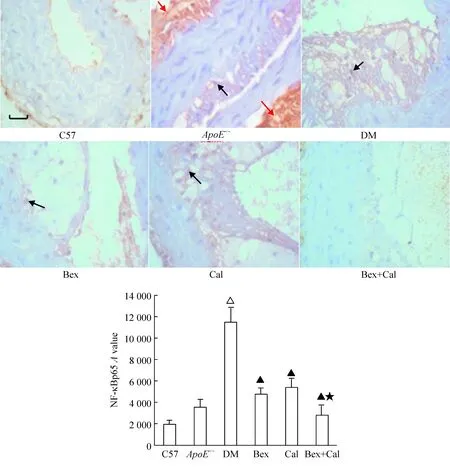
Figure 2. Effect of Bex and Cal on the distribution of NF-κB p65 in the thoracic aorta.Scale bar=200 μm. Black arrows indicate positive staining, while red arrows indicate non-specific staining. Mean±SD.n=5.△P<0.05 vs ApoE-/-; ▲P<0.05 vs DM; ★P<0.05 vs Bex.
5 Bex和Cal对STZ诱导的ApoE-/-小鼠胸主动脉斑块的影响
C57组小鼠的主动脉内膜光滑完整,未见到脂质斑块形成;ApoE-/-组可见内膜粗糙及脂质小斑块形成;DM组和Cal组的血管内膜不规则,管腔变小且形成巨大脂质斑块,斑块下方有脂质空洞形成,Bex组内膜脂质斑块减小,形成薄而均匀的脂质外层;B+C组内膜脂质斑块显著减小。斑块面积分析:与ApoE-/-组相比,DM组的斑块面积显著增高(P<0.01);Bex和Cal可降低STZ-ApoE-/-小鼠的胸主动脉斑块面积,联合用药组的斑块面积减少更显著(P<0.01),见图3。
讨 论
本研究发现,RXR激动剂Bex和VDR激动剂Cal对STZ诱导的糖尿病ApoE-/-小鼠血糖、血脂水平无影响,但可抑制其胸主动脉NF-κB的激活、减小其斑块面积。
对于AS的研究,既往认为控制血糖血脂是预防AS发生的关键[9]。近年来提出内皮学说即AS的发病机制涉及血管内皮的损伤、炎细胞的聚集、脂质的沉积、平滑肌细胞的增生迁移等多种因素,并指出AS的发展与NF-κB的异常激活有关[1]。NF-κB是一种多效性的转录因子。在糖尿病环境下,血管内皮细胞NF-κB异常活化,调控多种细胞因子如细胞间黏附因子、血管细胞黏附因子、E选择素等生成增多[2];同时,NF-κB激活后可抑制细胞的凋亡,引起血管平滑肌细胞的反应性增生及纤维化,进而促使动脉粥样斑块形成。我们在研究中同样发现,AS的发展与NF-κB的激活密切相关。有研究报道高糖诱导的人脐静脉血管内皮细胞核中NF-κB p65蛋白的表达明显增多[2]。徐雷等[10]发现糖尿病大鼠体内NF-κB表达明显增多,Watson等[11]也发现STZ诱导的糖尿病ApoE-/-小鼠体内NF-κB p65表达明显增多、主动脉斑块面积明显增大,与我们的研究结果一致。
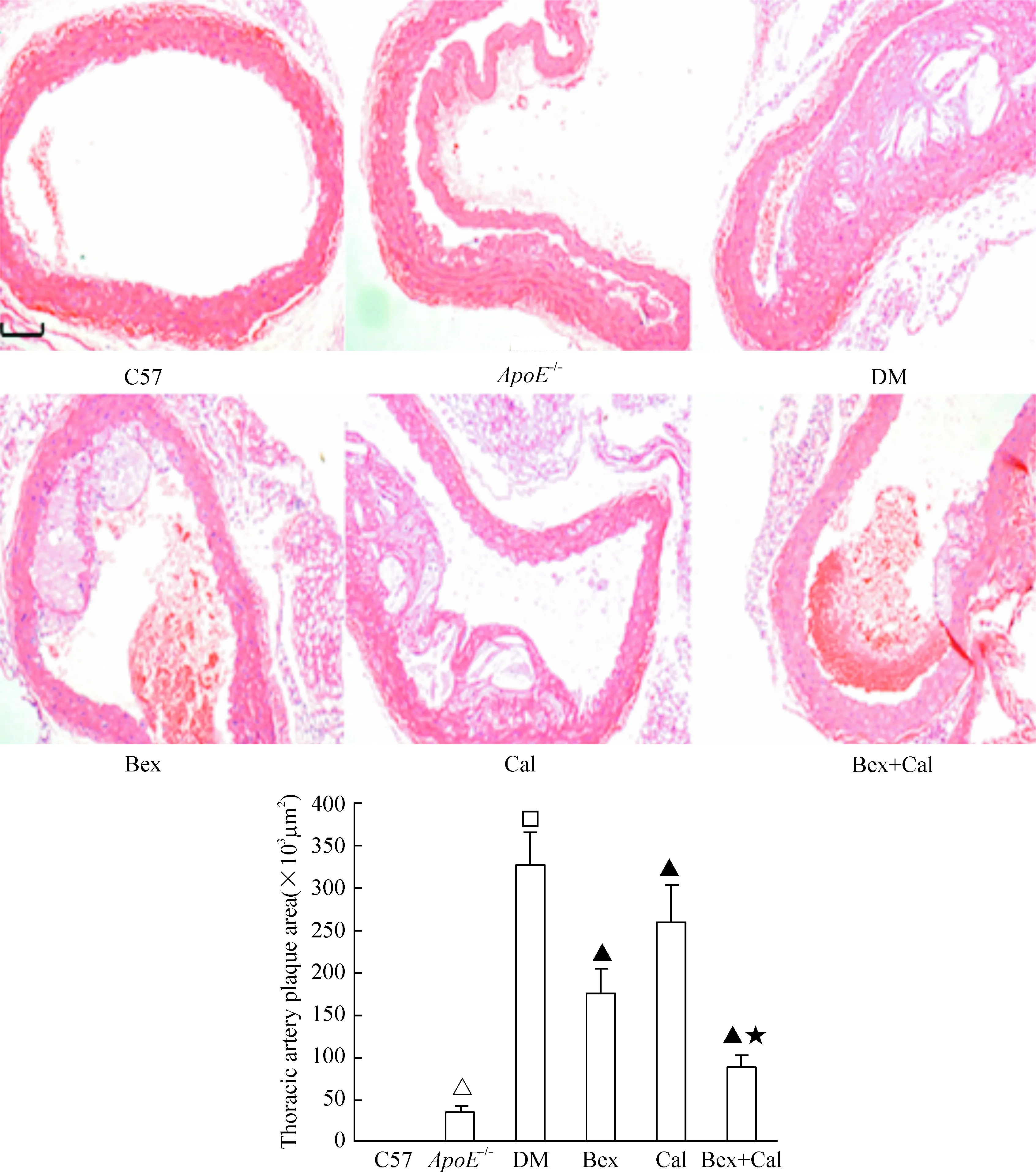
Figure 3. The effect of Bex and Cal on the thoracic artery plaque area (HE staining, scale bar=100 μm).Mean±SD.n=10.△P<0.05 vs C57; □P<0.05 vs ApoE-/-; ▲P<0.05 vs DM; ★P<0.05 vs Bex.
RXR和VDR同是核受体超家族的成员,属于配体依赖型转录因子,即需与其特异性配体(RXR激动剂、维生素D3)结合才能发挥生物学效应。有研究报道RXR激动剂能显著降低高糖所致的血管内皮细胞核中NF-κB p65的蛋白水平[2],Claudel等[12]也提出RXR激活能延缓ApoE-/-小鼠AS的进展。本研究同样发现,Bex能抑制STZ-ApoE-/-小鼠胸主动脉NF-κB p65的激活及减小斑块面积。
近几年的流行病学调查和临床研究均显示,维生素D的缺乏与心血管疾病的危险因素有着密切的联系,补充维生素D3可以降低2型糖尿病患者冠心病的发病率[5]。Tukaj等[3]认为补充维生素D3可增加血管平滑肌细胞中抑制蛋白IκB (IκBα)的蛋白表达。大量动物实验亦证实,维生素D和VDR缺失更容易出现平滑肌细胞的增殖及动脉硬化斑块的形成[13-14],补充适量的VD可以延缓AS的发生[8]。我们的研究同样发现Cal可抑制STZ-ApoE-/-小鼠胸主动脉NF-κB的激活及减小AS的斑块面积。本研究还发现,联合用Bex和Cal抑制NF-κB的活性及抗AS作用更显著。
RXR作为核受体超家族的重要成员,可优先与不同配体介导的受体(如VDR、LXRs、PPARs、FXR等)以高亲和力形成异源二聚体,亦可形成同源二聚体,参与多种基因转录活性的调控。随着研究的进展,有报道称单独给予维生素D3或9-顺式维甲酸均不能抑制异源二聚体VDR-RXR靶基因的表达,而二者联合有协同作用[15]。由此我们推测,单独补充Bex或Cal可能是通过形成同源二聚体RXR-RXR或VDR-VDR发挥调节作用,而联用Bex或Cal则形成异源二聚体VDR-RXR发挥协同作用,调节STZ-ApoE-/-小鼠胸主动脉NF-κB的活性及发挥抗AS作用。
综上所述,本研究发现Bex或Cal在对STZ诱导的糖尿病ApoE-/-小鼠血糖血脂水平无显著影响的情况下,可能是通过与受体RXR、VDR结合发挥调控作用,抑制小鼠胸主动脉NF-κB的激活,减少脂质斑块面积的形成,最终发挥抗动脉粥样硬化的作用。
[参 考 文 献]
[1] 周晓慧,牛成伟,曹 凯,等.丹皮酚通过抑制NF-κB信号通路下调高脂血清诱导的人脐静脉内皮细胞黏附分子的表达[J]. 中国病理生理杂志,2011, 27(2):249-253.
[2] 柴大军,林金秀,许昌声,等.视黄醇类X受体激动剂抑制高糖诱导内皮细胞氧化应激[J].中华高血压杂志, 2009, 17(11):1010-1014.
[3] Tukaj S, Trzonkowski P, Tukaj C. Regulatory effects of 1,25-dihydroxyvitamin D3on vascular smooth muscle cells[J].Acta Biochim Pol, 2012, 59(3):395-400.
[4] Lalloyer F, Fiévet C, Lestavel S,et al. The RXR agonist bexarotene improves cholesterol homeostasis and inhibits atherosclerosis progression in a mouse model of mixed dyslipidemia[J]. Arterioscler Thromb Vasc Biol, 2006, 26(12):2731-2737.
[5] 姚 维,张振建,钱 进,等.血清25-羟维生素D浓度与2型糖尿病并发冠心病的关系[J]. 临床荟萃,2013, 28(1):7-10.
[6] van de Luijtgaarden KM,Vote MT, Hoeks SE,et al. Vitamin D deficiency may be an independent risk factor for arterial disease[J].Eur J Vasc Endovasc Sur, 2012, 44(3):301-306.
[7] Dekel Y, Glucksam Y, Elron-Gross I,et al. Insights into modeling streptozotocin induced diabetes in ICR mice[J]. Lab Animal, 2009, 38(2):55-60.
[8] Takeda M,Yamashita T,Sasaki N,et al. Oral administration of an active form of vitamin D3(calcitriol) decreases atherosclerosis in mice by inducing regulatory T cells and immature dendritic cells with tolerogenic functions[J]. Arterioscler Thromb Vasc Biol, 2010, 30(12):2495-2503.
[9] UK Prospective Diabetes Study Group.Tight blood pressure control and risk of macrovascular and microvasccular complications in type 2 diabetes: UKPDS 38[J].BMJ, 1998, 317(7160):703-713.
[10] 徐 雷,冯 波,王 华,等.抗氧化剂α-硫辛酸对2型糖尿病大鼠动脉组织NF-κB表达的影响[J]. 中国病理生理杂志,2007, 23(12):2474-2475,2493.
[11] Watson AM,Li J, Schumacher C, et al. The endothelin receptor antagonist avosentan ameliorates nephropathy and atherosclerosis in diabetic apolipoprotein E knockout mice[J]. Diabetologia, 2010, 53(1):192-203.
[12] Claudel T, Leibowitz MD, Fiévet C, et al. Reduction of atherosclerosis in apolipoprotein E knockout mice by activation of the retinoid X receptor[J]. Proc Natl Acad Sci U S A, 2001, 98(5):2610-2615.
[13] Ish-shalom M, Sack J, Vechoropoulos M, et al. Low-dose calcitriol decreases aortic renin, blood pressure, and atherosclerosis inApoE-null mice[J]. J Atheroscler Thromb, 2012, 19(5):422-434.
[14] Szeto FL, Reardon CA, Yoon D, et al. Vitamin D receptor signaling inhibits atherosclerosis in mice[J]. Mol Endocrinol, 2012, 26(7):1091-1101.
[15] Dave VP, Kaul D, Sharma M. Crosstalk between RXR,LXR and VDR within blood mononuclear cellular model[J].Indian J Exp Biol,2012,50(1):35-40.
