香烟烟雾提取物通过蛋白激酶C-核因子相关因子2调节大鼠气道上皮细胞血红素加氧酶1表达
2014-08-09张卫东
江 刚, 张卫东
(湖南省人民医院呼吸内科,湖南 长沙 410005)
氧化应激机制是引起慢性阻塞性肺疾病(chro-nic obstructive pulmonary disease,COPD)的主要发病机制之一。香烟烟雾中含有大量的氧自由基和活性氧,引起细胞内氧化/抗氧化失衡,吸烟是引起COPD的主要危险因素。红系衍生的核因子相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)是细胞内抗氧化应激的关键转录因子,是氧化还原反应感受器,在氧化应激状态下调节抗氧化基因和Ⅱ相解毒酶如谷氨酰半胱氨酸合成酶、血红素加氧酶1(heme oxygenase-1, HO-1)的表达,避免细胞损伤[1-3]。HO-1是血红素代谢的限速酶,具有抗氧化损伤、抗炎症反应及细胞保护效应。近来研究表明,蛋白激酶C(protein kinase C,PKC)信号通路参与Nrf2激活及其对抗氧化基因的调节,其是否参与香烟烟雾诱导的HO-1表达尚待进一步研究[4-5]。本实验通过香烟烟雾提取物(cigarette smoke extract, CSE)诱导大鼠气道上皮细胞产生氧化应激,使用PKC抑制剂及Nrf2 siRNA,观察Nrf2、PKC和HO-1蛋白的表达情况,以及Nrf2的核转位变化,进一步探讨PKC-Nrf2-HO-1通路在大鼠气道上皮细胞抗氧化应激机制中的作用,及其在 COPD中可能参与的机制。
材 料 和 方 法
1 材料与动物
白沙牌香烟(湖南白沙卷烟厂);胎牛血清(天津灏阳);细菌蛋白酶ⅩⅣ(Sigma);蛋白提取液(Pierce);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)偶联的抗大鼠抗体和FITC偶联的抗兔抗体(北京中杉金桥);p-PKC抗体(Cell Signaling);RO318220、HO-1抗体和Nrf2多克隆抗体(Santa Cruz);荧光显微镜(IX-70型,Olympus;中南大学湘雅医院中心实验室);凝胶图像分析系统(上海Tanon Gis-2010);病理图文分析系统PAS9000(无锡朗珈生物医学工程有限公司)。
雄性清洁级SD大鼠25只,体重180~200 g,由中南大学湘雅医院动物实验部提供。
2 方法
2.1SD大鼠气道上皮细胞原代培养及分组 参照Wu等[6]方法,将雄性SD大鼠用戊巴比妥钠麻醉,分离气管,D-Hanks液反复冲洗其内膜面,在管腔内注满150 mg/L的细菌蛋白酶ⅩⅣ,结扎两端后4 ℃冰箱过夜;取出气管,剪开气管两端,用含20 %胎牛血清的DMEM/F12 培养基冲洗气管内膜面,收集细胞悬液,4 ℃、1 000 r/min离心5 min,弃上清液,用上述培养基重悬细胞,待气道上皮细胞80%融合时,分别取1×106个细胞用于实验,每次实验重复5次。
2.2细胞分组 将25只SD大鼠的气道上皮细胞随机分为对照组、CSE 3 h组、PKC抑制剂RO318220组、Nrf2 siRNA组和Nrf2 siRNA+RO318220组,每组5只。CSE 3 h组为含10%CSE的DMEM/F12培养基共培养3 h;PKC抑制剂RO318220组则加入CSE前0.5 h加入3 μmol/L RO318220抑制剂;Nrf2 siRNA组为加入CSE前加入Nrf2 siRNA;Nrf2 siRNA+RO318220组为加入CSE前加入3 μmol/L RO318220抑制剂及Nrf2 siRNA。
2.3CSE的制备 参照Vayssier-Taussat等[7]方法,将白沙牌香烟点燃,其过滤嘴端接1根橡皮管,橡皮管的另一端接注射器。点燃香烟,模拟人实际吸烟状况,每分钟吸1次,每次30 mL,持续2 s,共收集10管300 mL烟雾,注入含10 mL DMEM玻璃瓶中,摇动玻璃瓶使烟雾充分溶解制成悬液。悬液用1 mol/L NaOH调至pH 7.4,经0.22 μm 滤膜过滤后稀释10倍制成含10% CSE及10%胎牛血清培养基。制备的CSE在30 min内用于实验。
2.4siRNA转染 Nrf2的siRNA序列由上海吉玛生物(Genepharma)合成,Nrf2 siRNA正义链5’-AGAUUUAGAUCAUUUGAAATT-3’,反义链5’-UUUCAAAUGAUCUAAAUCUTG-3’;阴性对照siRNA正义链5’-UUCUCCGAACGUGUCACGUTT-3’,反义链5’-ACGUGACACGUUCGGAGAATT-3’。取1×105气道上皮细胞接种在6孔板上,待细胞汇合达到80%进行实验。用250 μL Opti-MEM® I分别稀释5 μL LipofectamineTM2000和7.5 μL siRNA,轻轻混匀并孵育5 min,然后混合稀释的siRNA和LipofectamineTM2000,轻轻混合并孵育20 min,将siRNA - LipofectamineTM2000复合物加入到每一个包含细胞和培养基的孔中,37 ℃、5% CO2培养箱孵育24~48 h进行转染,使转染效率达到70%以上。
2.5免疫细胞化学染色 采用链霉亲和素蛋白-过氧化物酶法,按以下步骤进行:将爬有SD大鼠气道上皮细胞的盖玻片经常规4%多聚甲醛固定,0.1% Triton X-100穿透细胞,3% H2O2处理封闭内源性过氧化氢酶活性,加正常山羊血清消除非特异性反应,然后滴加Ⅰ抗,加生物素化Ⅱ抗,加链霉亲和素和3,3’-二氨基联苯胺显色,苏木素复染,脱水、透明、封片、观察,阳性结果呈棕黄色。阴性对照片以PBS代替Ⅰ抗进行孵育。结果观察:各组随机取5个视野,计算机自动测量并计算阳性信号积分吸光度(IA)值, 取平均值作为各实验组阳性表达的相对强度。
2.6细胞免疫荧光染色 Ⅰ抗为兔抗大鼠Nrf2多克隆抗体,Ⅱ抗为FITC标记的抗兔抗体,操作步骤同免疫细胞化学,荧光显微镜下观察荧光的表达部位。
2.7Western blotting检测 PBS漂洗细胞2次,刮下细胞至1.5 mL EP管中,按Pierce蛋白提取液操作说明书提取胞浆蛋白和核蛋白,采用BCA法进行蛋白定量。样品分装,贮存-80 ℃待用。每份样本上样200 μg,经恒压SDS-PAGE,用半干法将蛋白转移至硝酸纤维素膜,0.65 mA/cm恒流电泳,室温,2.5 h,室温封闭3 h后,按0.1 mL/cm膜面积加入1∶1 000 稀释的Ⅰ抗杂交,4 ℃过夜,封闭液漂洗后按0.1 mL/cm膜面积加入1∶2 000 稀释的Ⅱ抗,室温下摇床孵育1 h,用增强化学发光法发光,X线胶片显影,凝胶图像分析系统对所得条带吸光度半定量,计算待测条带的吸光度与内参照吸光度比值。
2.8RT-PCR检测 采用Trizol、氯仿/异丙醇法提取细胞中总RNA,按逆转录试剂盒说明操作,逆转录成cDNA后进行PCR扩增。大鼠HO-1上游引物5’-CTTTCAGAAGGGTCAGGTGTCCA-3’,下游引物5’-CTGAGAGGTCACCCAGGTAGCGG-3’,扩增产物为309 bp。PCR反应条件为94 ℃30 s,63 ℃30 s,72 ℃ 60 s,32个循环。以GAPDH为内参照,其上游引物5’-TCACCATCTTCCAGGAGCGAG-3’,下游引物5’-TGTCGCTGTTGAAGTCAGAG-3’,扩增产物为450 bp。取8 μL 扩增产物经1.5%琼脂糖凝胶电泳观察,用Bio-Rad Gel Doc 2000型凝胶图像分析系统进行扫描分析,所测扩增条带积分光密度值用内参照修正。
2.9HO-1活性测定 根据HO-1降解血红素生成胆红素和一氧化碳的原理,测定样品反应物中胆红素生成量可代表HO-l的活性[8]。取1×106个细胞,用含20 mmol/L Tris-HCl和Triton X-100缓冲液漂洗,然后4 ℃、15 000×g离心15 min,收集上清液,加入含2 mmol/L MgCl2、2.75 mmol/L NADPH、1×103U/L肝胆绿素还原酶和1 mmol/L正铁血红素200 μL中,置37 ℃暗处1 h,之后加入氯仿1 mL 终止反应。以不含NADPH的样品作空白对照,样品与空白均做双份,在分光光度计上用400 nm和650 nm双波长测定胆红素生成量。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 19.0统计软件处理,多个样本比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 细胞免疫荧光观察Nrf2蛋白的表达位置
细胞免疫荧光显示在正常对照组Nrf2蛋白主要分布在大鼠气道上皮细胞胞浆中。在CSE 3 h组,Nrf2蛋白集中分布在气道上皮细胞胞核中,其表达明显增强,提示Nrf2蛋白由胞浆向胞核转位。当预先给予PKC抑制剂RO318220,Nrf2蛋白主要位于大鼠气道上皮细胞胞浆,而胞核未见明显显现,提示RO318220抑制Nrf2蛋白核转位,见图1。

Figure 1. The protein expression of Nrf2 in the rat airway epithelial cells detected by immunofluorescence. A: control group (×200); B: CSE 3 h group (×200); C: RO318220 group (×100).
2 Western blotting检测各组PKC、HO-1和Nrf2蛋白的表达
Western blotting法检测结果显示Nrf2胞浆蛋白在对照组和RO318220组表达增强,在CSE 3 h组、RO318220抑制剂组、Nrf2 siRNA组及Nrf2 siRNA+RO318220组表达均明显减弱(P<0.05)。Nrf2胞核蛋白和HO-1蛋白在CSE 3 h组表达明显强于对照组,差异有统计学意义(P<0.05),在RO318220组、Nrf2 siRNA组及Nrf2 siRNA+RO318220组表达均减弱,各组间比较差异无统计学意义,与对照组相比无统计学意义(P>0.05)。p-PKC蛋白在CSE 3 h组和Nrf2 siRNA组较对照组表达均明显增强(P<0.05),在RO318220组和Nrf2 siRNA+RO318220组表达降低,与对照组比较均无显著差异(P>0.05),见图2。

Figure 2. The protein expression of nuclear Nrf2, cytoplasmic Nrf2, HO-1 and p-PKC in the rat airway epithelial cells determined by Western blotting. The corresponding β-actin was showed as the loading control.Mean±SD.n=5.*P<0.05 vs control group; #P<0.05 vs CSE 3 h group.
3 免疫细胞化学观察各组HO-1蛋白的变化
HO-1蛋白主要表达在大鼠气道上皮细胞胞浆中,在对照组其胞浆弱阳性表达,在CSE 3 h组其胞浆呈强阳性表达;在RO318220组、Nrf2 siRNA组和RO318220+Nrf2 siRNA组其胞浆弱阳性表达,与CSE 3 h组比较差异显著(P<0.05),与对照组相比差异无统计学意义(P>0.05),见图3。

Figure 3. The protein expression of HO-1 in the rat airway epithelial cells detected by immunocytochemistry (×200). A: control group; B: CSE 3 h group; C: Nrf2 siRNA group; D: RO318220 group; E: RO318220+Nrf2 siRNA group.
4 RT-PCR检测各组HO-1 mRNA表达水平
HO-1 mRNA水平在CSE 3 h组明显高于对照组,差异有统计学意义(P<0.05);在RO318220组、Nrf2 siRNA组及RO318220+Nrf2 siRNA组HO-1 mRNA均低表达,与对照组比较,差异均无统计学意义(P>0.05),但明显低于CSE 3 h组,差异均有统计学意义(P<0.05),见图4。
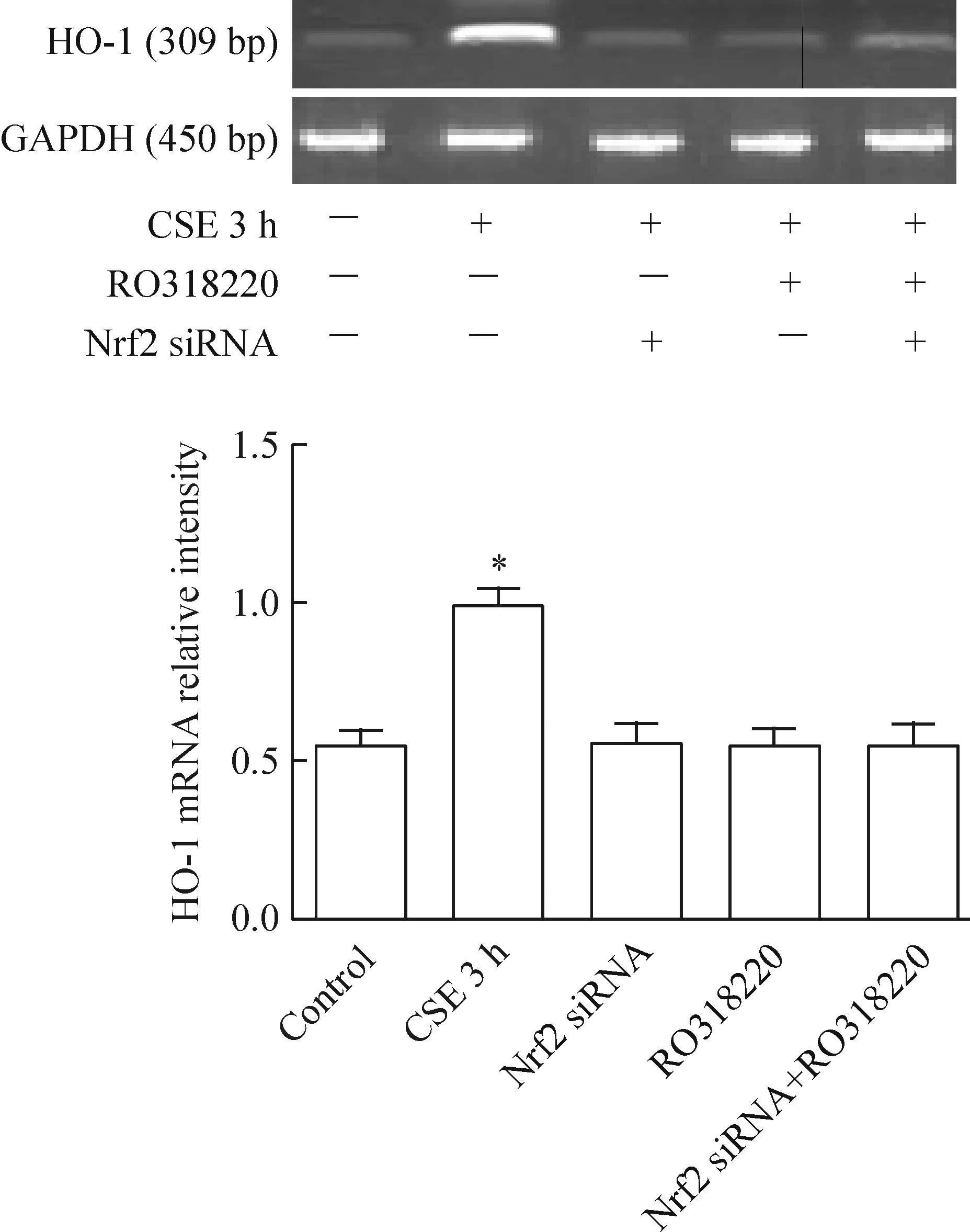
Figure 4. The mRNA expression of HO-1 in the rat airway epithelial cells determined by RT-PCR. The correspon-ding GAPDH was showed as the loading control.Mean±SD.n=5. *P<0.05 vs control group.
5 各组HO-1活性
HO-1活性在CSE 3 h组为(2.34±0.16) nmol·(g protein)-1·h-1,明显高于对照组(0.75±0.07)nmol·(g protein)-1·h-1。在RO318220组、Nrf2 siRNA组和Nrf2 siRNA+RO318220组,HO-1活性分别下降到(0.78±0.07)、(0.82±0.10)和(0.76±0.07)nmol·(g protein)-1·h-1,明显低于CSE 3 h组(P<0.05),与对照组比较差异无统计学意义(P>0.05)。
讨 论
HO-1是血红素代谢的限速酶,催化血红素分解为一氧化碳、铁和胆绿素。HO-1位于非神经组织中,具有抗氧化损伤、抗炎症反应和细胞保护效应,在氧化应激、硝化应激、巯基化物质及细胞因子等作用下诱导表达。香烟烟雾中含有大量的自由基和活性氧,通过氧化应激引起肺损伤,而气道上皮细胞和肺泡细胞内抗氧化基因和Ⅱ相解毒酶如HO-1过表达以对抗损伤。研究证明槲皮素增加HO-1表达,避免过氧化氢诱导的肺上皮细胞损伤[9]。本研究表明,大鼠气道上皮细胞暴露CSE 3 h后,HO-1蛋白在大鼠气道上皮细胞胞浆中表达明显增强,HO-1 mRNA及蛋白表达水平上调,HO-1活性增强,说明CSE通过氧化应激上调大鼠气道上皮细胞HO-1表达。
Nrf2属于bZIP转录因子,具有保护细胞避免内源性及外源性应激。Keap1是Nrf2的主要抑制因子,和Nrf2构成氧化应激的关键感受器,在氧化应激时通过与抗氧化基因如谷氨酰半胱氨酸合成酶、HO-1、醌氧化酶1等基因的抗氧化反应元件(antioxidant response element, ARE)结合,调节抗氧化基因的表达。近来研究发现,HO-1诱导剂姜黄素通过Nrf2与HO-1的ARE结合,上调HO-1表达。甘菊通过提高Nrf2磷酸化水平和核转位,与HO-1的ARE结合,提高HO-1表达水平[10]。同型半胱氨酸通过Nrf2调节HepG2细胞HO-1表达[11]。本实验发现,大鼠气道上皮细胞暴露CSE 3 h后,Nrf2蛋白由胞浆向胞核转位,其胞核蛋白表达明显增强,胞浆蛋白明显降低,HO-1活性、mRNA和蛋白水平明显升高。然而,使用siRNA敲除Nrf2,明显抑制了Nrf2胞浆和胞核蛋白表达,而且显著抑制了HO-1活性、mRNA和蛋白水平。这表明Nrf2的激活及其核转位在CSE调节H抗氧化基因O-1的表达中具有非常重要作用。
研究表明丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和PKC信号通路参与激活Nrf2,引起Nrf2核转位,调节抗氧化基因的表达[1, 4, 6]。PKC信号通路通过磷酸化Nrf2 (Ser40),使Nrf2与Keap1分离,从而调节抗氧化基因表达。Zhang等[12]对离体兔心脏缺血再灌注的研究中发现,PKC诱导Nrf2的核转位,增强HO-1的抗氧化防御能力。Quesada等[13]研究表明力生长因子24参与激活PKCε-Nrf2,上调HO-1表达,保护SH-SY5Y细胞避免6-羟多巴胺引起的细胞凋亡。本实验研究发现,当大鼠气道上皮细胞暴露CSE 3 h后,PKC蛋白表达增强,Nrf2蛋白出现核转位,HO-1活性、mRNA及蛋白表达均明显增强。然而,预先加入RO318220,抑制Nrf2核转位,其胞浆蛋白水平增强,胞核蛋白水平减弱,且HO-1活性明显降低,其mRNA及蛋白表达明显减弱。预先给予Nrf2 siRNA,Nrf2胞浆和胞核蛋白、HO-1活性、mRNA及蛋白表达水平均显著降低,而PKC蛋白表达增强。同时加入RO318220和Nrf2 siRNA,PKC蛋白和HO-1活性、mRNA及蛋白表达均明显降低。这表明PKC参与Nrf2核转位及HO-1上调表达。然而,Lee等[14]对人脐静脉上皮细胞的研究中发现,非瑟酮通过PKC-δ和p38 MAPK信号通路激活Nrf2活性,引起Nrf2核转位,与HO-1的ARE结合,上调HO-1表达,从而对抗过氧化氢诱导的氧化应激。鹅掌菜酚通过ERK和 PI3K/Akt信号通路激活Nrf2,上调HO-1表达,降低氧化应激对中国地鼠肺纤维细胞的损伤[15]。这表明诱导HO-1表达的信号通路在不同诱导剂和不同细胞种类之间具有差异。所以,PI3K/Akt和MAPK是否参与香烟烟雾诱导的Nrf2核转位和HO-1表达仍需进一步研究。
本研究证明CSE引起大鼠气道上皮细胞产生氧化应激;通过PKC信号通路激活Nrf2,诱导Nrf2核转位,上调HO-1表达,可维持细胞内氧化/抗氧化平衡。因此,对PKC-Nrf2-HO-1信号通路的进一步研究有助于更加深入了解COPD氧化/抗氧化发病机制,为寻找一种新的调节Nrf2抗氧化药物在COPD治疗中提供理论研究基础。
[参 考 文 献]
[1] Boutten A, Goven D, Artaud-Macari E, et al. NRF2 targeting: a promising therapeutic strategy in chronic obstructive pulmonary disease[J]. Trends Mol Med, 2011, 17(7):363-371.
[2] 刘晓燕,戴爱国,谭双香. 慢性阻塞性肺疾病中转录因子ATF3/ATF4与Nrf2的表达及相互作用[J]. 中国病理生理杂志,2011,27(10):1961-1966.
[3] 吴 露,黄小平,邓常清,等. 人参皂苷R g1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响[J]. 中国病理生理杂志,2013,29(11):2066-2071.
[4] Yun BR, Lee MJ, Kim JH, et al. Enhancement of parthenolide-induced apoptosis by a PKC-alpha inhibition through heme oxygenase-1 blockage in cholangiocarcinoma cells[J]. Exp Mol Med, 2010, 42(11):787-797.
[5] Lee SE, Yang H, Jeong SI, et al. Induction of heme oxygenase-1 inhibits cell death in crotonaldehyde-stimulated HepG2 cells via the PKC-δ-p38-Nrf2 pathway[J]. PLoS One, 2012, 7(7): e41676.
[6] Wu R, Nolan E, Turner C. Expression of tracheal diffe-rentiated function in serumfree hormone-supplemented medium[J]. J Cell Physiol, 1985, 125(2): 167-181.
[7] Vayssier-Taussat M, Camilli T, Aron Y, et al. Effect of tobacco smoke and benzo[a]pyrene on human endothelial cell and monocyte stress response[J]. Am J Physiol Heart Circ Physiol, 2001, 280(3): H1293-H1300.
[8] Zhou JL, Ling YL, Jin GH, et al. Endogenous carbon monoxide attenuates lung injury following ischemia-reperfusion in the hind limbs of rats[J]. Acta Physiol Sin, 2002, 53(3):229-233.
[9] Hayashi Y, Matsushima M, Nakamura T, et al. Quercetin protects against pulmonary oxidant stress via heme oxygenase-1 induction in lung epithelial cells[J]. Biochem Biophys Res Commun, 2012, 417(1):169-174.
[10] Bhaskaran N, Shukla S, Kanwal R, et al. Induction of heme oxygenase-1 by chamomile protects murine macrophages against oxidative stress[J]. Life Sci, 2012, 90(25-26):1027-1033.
[11] Mani M,Golmohammadi T,Khaghani S,et al. Homocysteine induces heme oxygenase-1 expression via transcription factor Nrf2 activation in HepG2 cell[J]. Iran Biomed J, 2013, 17(2):93-100.
[12] Zhang X, Xiao Z, Yao J, et al. Participation of protein kinase C in the activation of Nrf2 signaling by ischemic preconditioning in the isolated rabbit heart[J]. Mol Cell Biochem, 2013, 372(1-2):169-179.
[13] Quesada A, Ogi J, Schultz J, et al. C-terminal mechano-growth factor induces heme oxygenase-1-mediated neuroprotection of SH-SY5Y cells via the protein kinase Cε/Nrf2 pathway[J]. J Neurosci Res, 2011, 89(3):394-405.
[14] Lee SE, Jeong SI, Yang H, et al. Fisetin induces Nrf2-mediated HO-1 expression through PKC-δ and p38 in human umbilical vein endothelial cells[J]. J Cell Biochem, 2011, 112(9):2352-2360
[15] Kim KC, Kang KA, Zhang R, et al. Up-regulation of Nrf2-mediated heme oxygenase-1 expression by eckol, a phlorotannin compound, through activation of Erk and PI3K/Akt[J]. Int J Biochem Cell Biol, 2010, 42(2):297-305.
