白藜芦醇通过PI3K/Akt通路及线粒体途径抑制软骨肉瘤*
2014-08-09金海东蔡建武范时洋
金海东, 戴 兵, 蔡建武, 陈 辉, 范时洋, 潘 骏
(温州医科大学附属第二医院创伤骨科,浙江 温州 325000)
软骨肉瘤(chondrosarcoma)是常见的原发恶性骨肿瘤,好发于长管状骨及髂骨,晚期可以发生肺转移,在骨肿瘤中,其发病率仅次于骨肉瘤。随着医疗技术迅速发展,近年来恶性骨肿瘤的诊断和治疗有了很大的进步,患者治疗后的长期生存率也有了明显提高,但是软骨肉瘤的治疗依然是一个挑战,特别是对于微小病灶,手术不能切除病灶,或者对放化疗不敏感或耐药时。因此,寻找敏感高效低毒的抗肿瘤药物是治疗软骨肉瘤的迫切问题。白藜芦醇(resveratrol,Res)作为一种天然的药物,属于非黄酮类多酚化合物,具有多种生物学活性如抗氧化、抗炎、抗血小板聚集、抗动脉粥样硬化、调控细胞凋亡、雌激素调节、免疫调节及抗肿瘤等活性[1]。研究证明白藜芦醇对多种肿瘤包括肺癌细胞、胃癌细胞、胰腺癌细胞、肝癌细胞、前列腺癌细胞和白血病细胞等均有一定抗癌性[2-4]。鉴于PI3K/Akt信号通路在肿瘤的发生发展过程中起重要作用,而国内外鲜有文献报道白藜芦醇对软骨肉瘤的影响,本研究以软骨肉瘤SW1353细胞为研究对象,采用白藜芦醇处理肿瘤细胞后,观察其对肿瘤细胞的增殖、凋亡及PI3K/Akt信号通路的影响,探讨白藜芦醇防治软骨肉瘤的可能机制。
材 料 和 方 法
1 细胞和试剂
软骨肉瘤SW1353细胞购自中国科学院上海生命科学研究院细胞库。白藜芦醇和Hoechst 33258购自Sigma-Aldrich;抗Bcl-2、Bax、Akt和p-Akt的抗体购自Cell Signaling Technology;抗activated caspase-3的抗体购自Bioworld;CCK8试剂购自碧云天生物技术研究所。
2 方法
2.1细胞培养 将SW1353细胞接种于含10% 胎牛血清、青霉素和链霉素的DMEM/F12培养基中,置于37 ℃、5% CO2培养箱中常规培养,细胞贴壁生长,每3 d传代。用含EDTA胰蛋白酶消化,收集对数生长期细胞进行实验。
2.2倒置显微镜观察细胞形态 将细胞以1×106的密度接种在60 mm的培养板,分加药组(100 μmol/L)和对照组,药物处理24 h后在倒置显微镜下观察细胞形态。
2.3CCK8法测定细胞活性和增殖 实验分空白组、对照组(不加药)和药物组(25 μmol/L 组、50 μmol/L组和100 μmol/L 组),各组细胞均在37 ℃共同孵育24 h和48 h,按照试剂盒说明书,每孔加CCK-8溶液10 μL,继续37 ℃温育1 h后,酶标仪测定450 nm波长处各孔的吸光度(A),计算细胞活力(%)=(A加药组-A空白组)/(A对照组-A空白组)×100%。
2.4Hoechst 33258染色观察细胞凋亡 调整细胞密度为1×108/L接种于6孔板内的任意4个孔,每孔500 μL,置于37 ℃、5% CO2培养箱中培养24 h后,PBS洗涤2遍,每孔加入Hoechst 33258染色液染色20~30 min,PBS洗涤3次,荧光显微镜观察凋亡细胞的形态。
2.5Western blotting检测 用RIPA细胞裂解液和超声裂解细胞,4 ℃、12 000×g离心20 min 后收集总蛋白,并计算出上样体积。变性后SDS聚丙烯酰胺凝胶垂直电泳,电转膜,5%脱脂奶粉封闭,TBST洗膜,然后加入抗activated caspase-3、Bcl-2、Bax、Akt和p-Akt抗体(1∶1 000)4 ℃孵育过夜,TBST洗膜后加入辣根过氧化酶标记的IgG Ⅱ抗(1∶5 000)室温孵育2 h,应用超敏ECL化学发光试剂盒曝光,以β-actin蛋白作为内参照。在凝胶成像仪下曝光,用Image Lab软件分析。
2.6细胞划痕实验 6孔板每孔加入约5×105个细胞,次日用枪头每隔0.5~1 cm垂直划线,PBS洗细胞3次,去除划下的细胞,加入无血清培养基。培养箱培养24 h取样,拍照。
3 统计学处理
采用SPSS 19统计软件处理。数据以均数±标准差(mean±SD)表示,组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 白藜芦醇对SW1353细胞形态的影响
100 μmol/L白藜芦醇处理软骨肉瘤SW1353后,显微镜观察可见细胞与细胞分离,三角形形态杂乱无规律,而对照组瘤细胞则呈密集规律三角形排列,见图1。
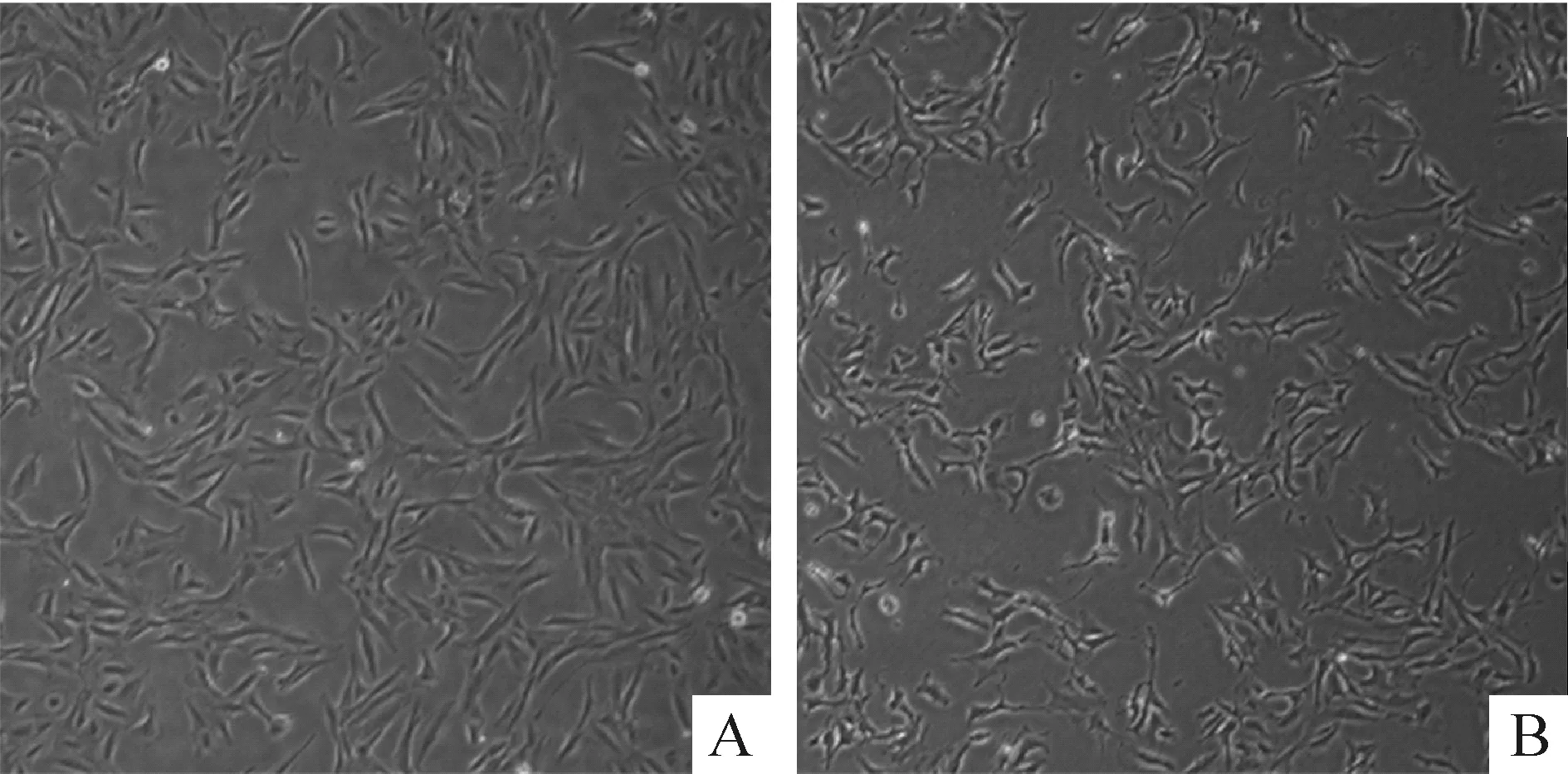
Figure 1. The effect of resveratrol (Res) on the morphological of SW1353 cells (×100). SW1353 cells were treated with 100 μmol/L Res for 24 h and the morphological changes were observed under microscope. A: control; B: 100 μmol/L Res.
2 白藜芦醇抑制软骨肉瘤细胞的活力
随着作用时间增加,白藜芦醇对细胞活力的抑制作用增大,反映出对SW1353细胞增殖的抑制作用增强。不同剂量的白藜芦醇处理细胞后均出现细胞活力的下降,见图2。25、50和100 μmol/L Res作用24 h,其细胞活性分别为0.5789±0.1379、0.5287±0.0842和0.4944±0.0819(P<0.01)作用48 h后,其活性分别为0.3750±0.1006、0.3947±0.0587和0.3126±0.0571(P<0.01)。24 h与48 h比较差异有统计学意义(P<0.05)。
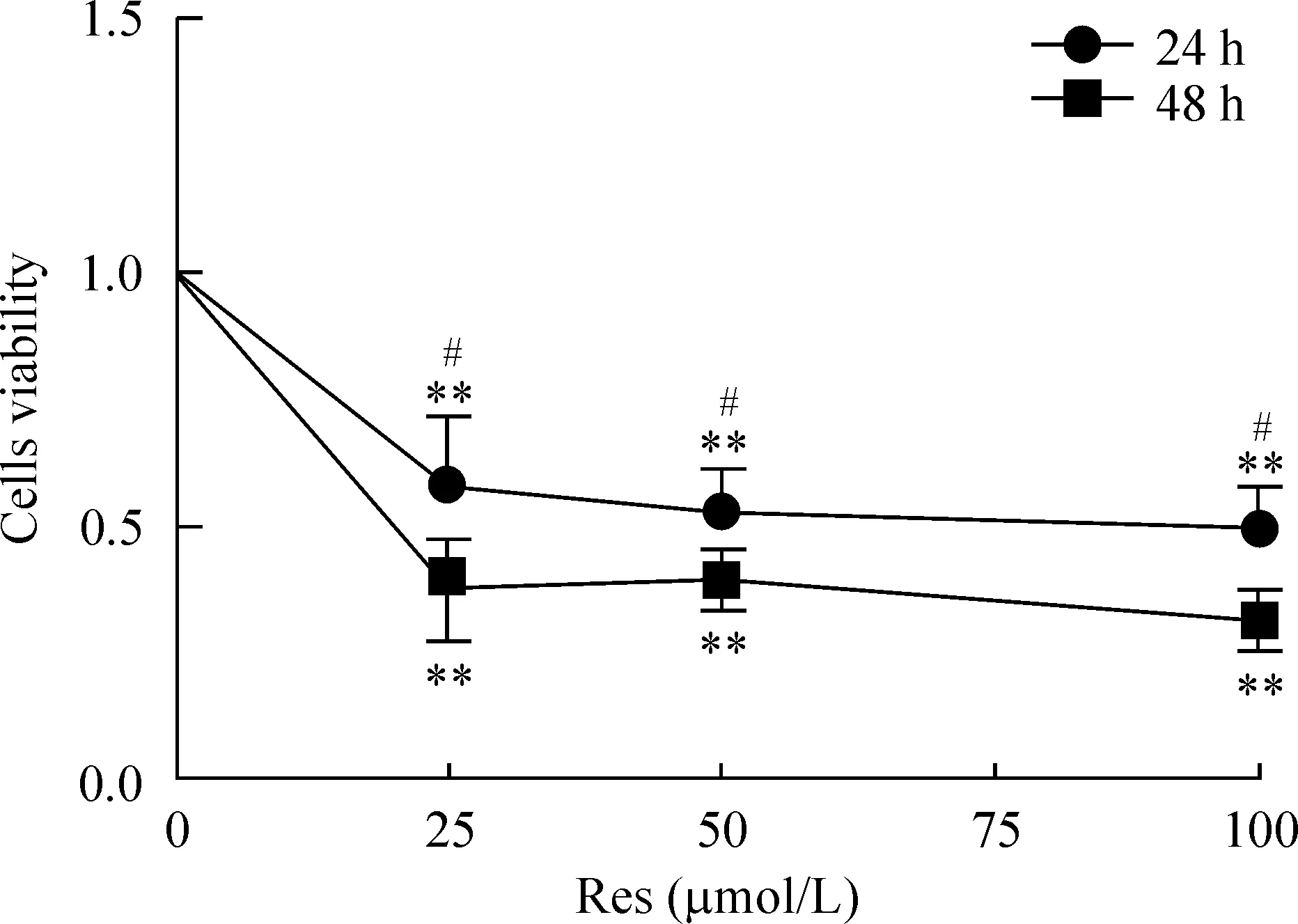
Figure 2. The effect of resveratrol (Res) on the viability of SW1353 cells. Mean±SD. n=6.**P<0.01 vs untreated cells (not shown); #P<0.05 vs 24 h.
3 Hoechst 33258染色观察细胞凋亡的情况
Hoechst 33258染色后凋亡的细胞出现核皱缩,荧光染料浓聚,呈亮蓝色,或呈致密浓染核碎裂,图3染色可见25、50和100 μmol/L白藜芦醇组细胞凋亡多于未加药的对照组。
4 白藜芦醇作用于线粒体途径促进细胞凋亡
25、50和100 μmol/L Res作用软骨肉瘤SW1353细胞24 h、48 h和72 h,Western blotting检测线粒体途径的凋亡蛋白表达情况,与对照组相比,加药组的activated caspase-3和Bax蛋白表达上调,而Bcl-2蛋白表达下调。100 μmol/L Res作用后activated caspase-3和Bax蛋白表达最高, Bcl-2表达最低。而24 h、48 h和72 h组间差异不明显,但与 0 h相比较,activated caspase-3和Bax蛋白表达增加, Bcl-2蛋白表达下降,见图4。
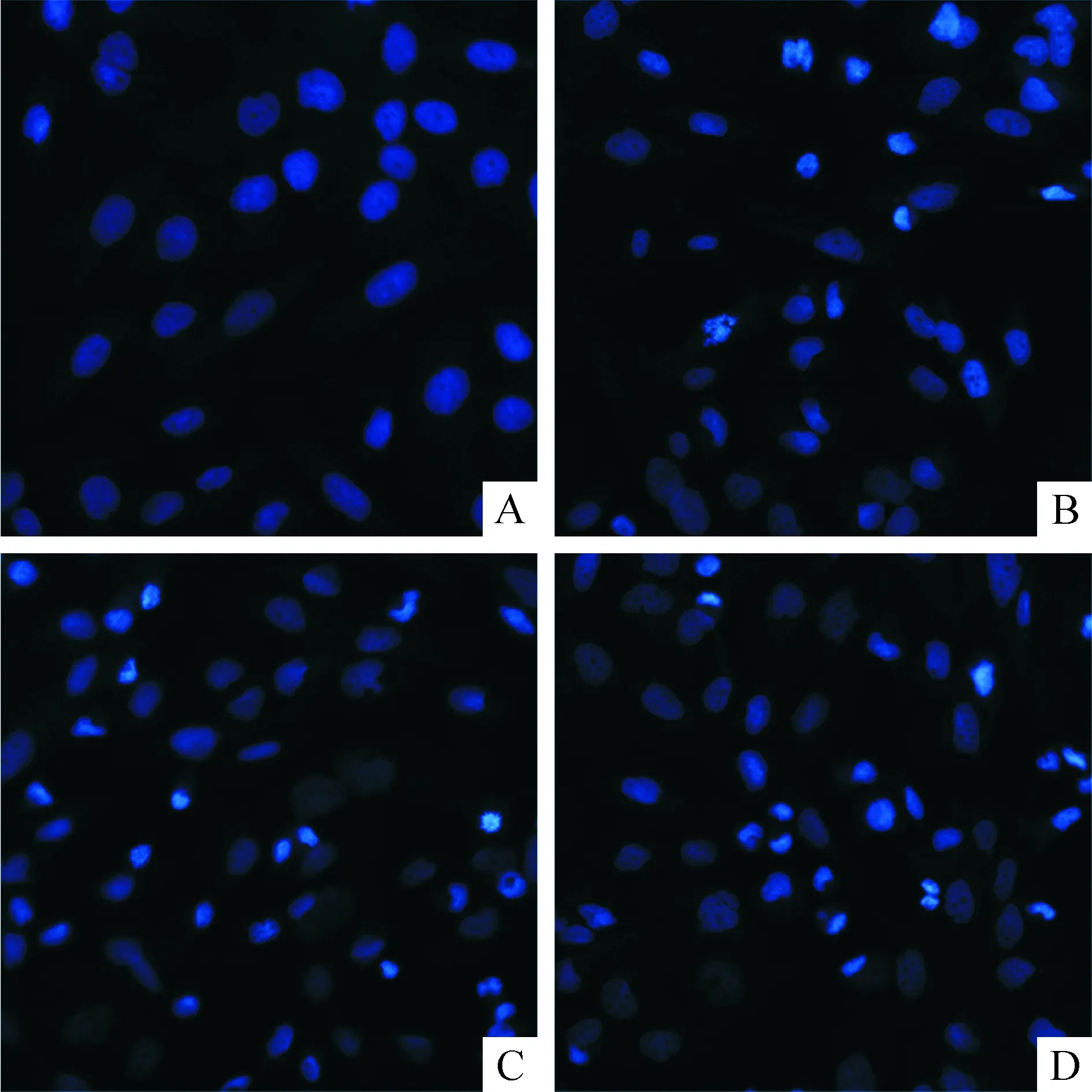
Figure 3. The apoptosis of SW1353 cells determined by Hoechst 33258 staining after resveratrol (Res) treatment (×200). A: control; B~D: 25, 50 and 100 μmol/L Res.

Figure 4. The effect of resveratrol (Res) on related mitochondrial protein expression in SW1353 cells. A,B: the protein levels of activated caspase-3, Bcl-2, Bax in the cells treated with different concentrations of Res; C, D: the protein levels of actived-caspase-3, Bcl-2, Bax in the cells exposed to 50 μmol/L Res in different time points.
5 白藜芦醇抑制PI3K/Akt信号通路
25、50和100 μmol/L Res作用软骨肉瘤SW1353细胞24 h、48 h和72 h,Western blotting结果显示(图5),p-Akt蛋白随着时间延长,表达呈减弱趋势,72 h其表达最弱。不同浓度的药物处理,p-Akt也出现不同程度的降低(100 μmol/L组最弱),但是总Akt蛋白表达在时间和剂量因素改变下均未见明显的变化。

Figure 5. The effect of resveratrol (Res) on PI3K/Akt signaling pathway in SW1353 cells. A: the protein levels of Akt and p-Akt in the cells treated with different concentrations of Res; B: the protein levels of Akt and p-Akt in the cells exposed to 50 μmol/L Res in different time points.
6 白藜芦醇能抑制软骨肉瘤SW1353细胞的迁移
0、50和100 μmol/L Res处理肉瘤细胞,图6可见药物处理后划痕区域细胞少见,而对照组可见许多细胞迁移到划痕区域。0、50和100 μmol/L Res 作用24 h后其相关的划痕宽度比率分别为0.8390±0.1151、0.9640±0.0816和1.0525±0.0919(P<0.01),而48 h后其划痕宽度比率分别为0.7890±0.1678、0.9404±0.1153和1.0317±0.1018。
讨 论
白藜芦醇最早是在1940年从毛叶黎芦根部获得的[6],现在从葡萄、花生、决明和虎杖中均能提取到白藜芦醇[7],其中新鲜的葡萄皮中含量最高,约达50~100 mg/g。从白藜芦醇发现至今,其在肿瘤领域研究较多,研究发现白藜芦醇能够诱导包括肺癌细胞、胃癌细胞、骨肉瘤细胞、肝癌细胞和白血病细胞等[2-5]癌细胞凋亡、抑制其增殖和转移,起到抗肿瘤作用,但是其抗肿瘤的作用机制有不同程度的差异。
国内外很多学者研究证实白藜芦醇能抑制肿瘤细胞的增殖,如Li等[8]用白藜芦醇处理肝癌细胞,能抑制高糖环境下肿瘤的增殖;Bhardwaj等[9]将白藜芦醇处理多发性骨髓瘤细胞,发现能抑制其增殖,下调Bcl-2、上调Bax,激活caspase-3诱导凋亡。由于国内外无文献报道白藜芦醇对软骨肉瘤的影响,因此本研究用不同浓度的白藜芦醇处理软骨肉瘤细胞12 h、24 h和48 h,发现能抑制软骨肉瘤细胞的增殖,同时发现activated caspase-3蛋白(17 kD)的表达增强。Activated caspase-3蛋白是procaspase-3在凋亡发生时裂解的2个小片段(17 和19 kD)。同时还发现凋亡的相关蛋白Bcl-2表达下降,Bax的表达增强。这些结果均与白藜芦醇对其它肿瘤的抑制效果相似。我们认为白藜芦醇能够诱导软骨肉瘤细胞的凋亡。Bcl-2和Bax是线粒体调节凋亡的重要分子,外界刺激因素使线粒体的通透性改变,引起细胞色素C等小分子的释放,Bcl-2、Bcl-xL等下调,Bax上调,进而使caspase家族出现级联反应,导致细胞凋亡[10-11]。上述研究结果表明白藜芦醇诱导软骨肉瘤细胞的凋亡是通过线粒体途径发挥作用的。
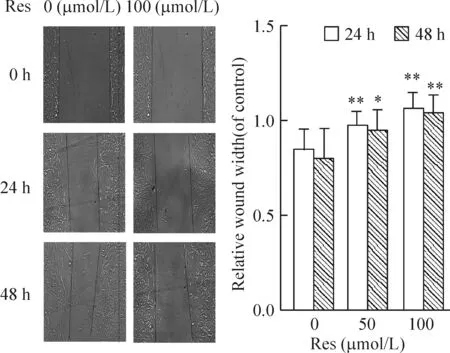
Figure 6. The cell migration determined by wound scratch assay (×100). Mean±SD. n=6.*P<0.05,**P<0.01 vs 0 μmol/L.
在信号通路研究领域,已经证实人类多种肿瘤如乳腺癌、非小细胞肺癌和胃癌等中,PI3K和Akt的过表达和异常激活参与肿瘤的发生发展[12-14],PI3K/Akt信号通路在肿瘤发生发展中扮演着重要角色。PI3K存在于细胞周期延续、细胞分化、生存、侵入及扩散,它的生物活性是通过调节下游靶分子Akt而体现出来的。Akt 的磷酸化水平可以作为衡量PI3K活性的指标,同时反映PI3K信号通路的活性。从本研究的结果(图5)我们看到不同浓度的白藜芦醇能够使Akt的磷酸化显著降低,而总Akt未见明显改变,可见白藜芦醇抑制软骨肉瘤作用,部分是通过抑制PI3K/Akt信号通路发挥效应。同时Akt信号通路又能影响其下游线粒体途径中Bcl-2和Bax的表达,表明PI3K/Akt信号通路和线粒体途径存在相互作用,共同促进软骨肉瘤细胞凋亡,抑制瘤细胞的增殖和生长。
综上所述,白藜芦醇诱导软骨肉瘤细胞的凋亡,抑制其增殖,部分是通过PI3K/Akt通路及线粒体途径,但其通路中的上下游分子参与凋亡调控或是否还影响其它通路途径,尚需进一步研究证实。目前认为白藜芦醇能激活Sirt1[15],但是其促进凋亡、影响这两条途径是否与Sirt1有关联?尚需更加深入探索。另外我们证实了白藜芦醇能够抑制瘤细胞的迁移(图6),具体机制有待进一步的深入研究。
[参 考 文 献]
[1] de la Lastra CA, Villegas I. Resveratrol as an antioxidant and pro-oxidant agent: mechanisms and clinical implications[J]. Biochem Soc Trans, 2007, 35(Pt 5): 1156-1160.
[2] Gusman J, Malonne H, Atassi G, et al. A reappraisal of the potential chemopreventive and chemotherapeutic properties of resveratrol[J]. Carcinogenesis, 2001, 22(8):1111-1117.
[3] Cal C, Garban H, Jazirehi A, et al. Resveratrol and cancer: chemoprevention, apoptosis, and chemoimmunosensitizing activities[J]. Curr Med Chem Anti-Cancer Agents, 2003, 3(2):77-93.
[4] Whitlock NC, Baek SJ. The anticancer effects of resveratrol: modulation of transcription factors[J]. Nutrition Cancer, 2012, 64(4):493-502.
[5] 王海燕, 邹正渝, 段 亮, 等. S100A6 通过 PI3K/Akt 信号通路促进人骨肉瘤细胞 143B 增殖和迁移[J]. 中国病理生理杂志, 2013, 29(11):1928-1933.
[6] Gupta SC, Kannappan R, Reuter S, et al. Chemosensitization of tumors by resveratrol[J]. Ann N Y Acad Sci, 2011, 1215:150-160.
[7] 赵克森. 白藜芦醇的生物学特性和效应[J]. 中国病理生理杂志, 2012, 28(9): 1709-1711.
[8] Li Y, Zhu W, Li J, et al. Resveratrol suppresses the STAT3 signaling pathway and inhibits proliferation of high glucose-exposed HepG2 cells partly through SIRT1[J]. Oncol Reports, 2013, 30(6):2820-2828.
[9] Bhardwaj A, Sethi G, Vadhan-Raj S, et al. Resveratrol inhibits proliferation, induces apoptosis, and overcomes chemoresistance through down-regulation of STAT3 and nuclear factor-κB-regulated antiapoptotic and cell survival gene products in human multiple myeloma cells[J]. Blood, 2007, 109(6):2293-2302.
[10] DÖrrie J, Gerauer H, Wachter Y, et al. Resveratrol induces extensive apoptosis by depolarizing mitochondrial membranes and activating caspase-9 in acute lymphoblastic leukemia cells[J]. Cancer Res, 2001, 61(12):4731-4739.
[11] Pozo-Guisado E, Merino JM, Mulero-Navarro S, et al. Resveratrol-induced apoptosis in MCF-7 human breast cancer cells involves a caspase-independent mechanism with downregulation of Bcl-2 and NF-κB[J]. Int J Cancer, 2005, 115(1):74-84.
[12] Almhanna K, Strosberg J, Malafa M, et al. Targeting Akt protein kinase in gastric cancer[J]. Anticancer Res, 2011, 31(12):4387-4392.
[13] Riggio M, Polo ML, Blaustein M, et al. PI3K/Akt pathway regulates phosphorylation of steroid receptors, hormone independence and tumor differentiation in breast cancer[J]. Carcinogenesis, 2012, 33(3):509-518.
[14] Papadimitrakopoulou V. Development of PI3K/Akt/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cancer[J]. J Thoracic Oncol, 2012, 7(8):1315-1326.
[15] Villalba JM, Francisco J. Sirtuin activators and inhibitors[J]. Biofactors, 2012, 38(5):349-359.
