麻风树叶水浸提液对大豆根细胞的化感效应
2014-08-08王亚男黄鹤平邹志艳马丹炜
王亚男,黄鹤平,邹志艳,马丹炜,罗 通,杨 欢,何 兵,张 红,李 群
(1.四川师范大学生命科学学院,四川成都610101; 2.昆明学院农学院,云南昆明650214;3.宜宾学院生物研究所,四川宜宾644007)
麻风树(Jatropha curcasLinn.)属于大戟科大戟属,原产于中美洲和南美洲,现广泛分布于中美洲、非洲和亚洲[1].麻风树种仁的含油量最高可达61.5%,是一种热带地区极为适宜的生物柴油原料植物[2],已在萨赫勒地区和撒哈拉以南的非洲国家以及亚洲国家(中国、泰国、印度尼西亚和印度大部分地区等)大力推广种植[3].2009年6月,中国国家发展和改革委员会批准了3个以麻风树籽油为原料的“油林”一体化生物柴油国家示范项目,标志着中国麻风树生物柴油正式走向了产业化应用[4].然而,C.E.Buddenhagen等[5]应用杂草评估系统评估了夏威夷岛的40种生物燃料作物的入侵特征,发现麻风树具有较高的归化性和入侵性特征.全球入侵物种编目已经把麻风树归为高入侵风险植物,虽然尚未对此进行科学论证,但是包括澳大利亚、南非、厄瓜多尔、关岛、新喀里多尼亚、印度的部分城市等国家和地区因此已将麻风树归为入侵植物而禁止种植[3].目前,麻风树已在中国云南、贵州、四川等地大面积种植,若上述假设成立,麻风树将对这些地区的生态系统形成威胁,因此,正确评价麻风树的生态风险迫在眉睫.
化感作用是外来植物主要的入侵机理之一[6-7].外来植物向周围释放化感物质,这些化感物质通过受体植物细胞膜上的受体将化感胁迫信号传入细胞内部,影响新陈代谢过程[8],抑制周围植物的生长发育.根尖细胞对外界环境胁迫十分敏感,根边缘细胞在根表面和土壤界面构建一个生物活性界面,是保护植物根尖免受生物和非生物胁迫的第一道防线[9].外来入侵植物通过雨雾淋溶、自然挥发、根系分泌和残株腐解等途径向周围环境释放的化感物质最终都将进入土壤[10],作用于受体植物的根边缘细胞和根尖细胞.近些年,麻风树的化感作用引起了国内外学者的关注[11-12],但麻风树对植物根尖细胞化感作用的研究较少.邓骛远等[13]研究表明麻风树水浸提液导致蚕豆根尖细胞的畸变率和微核率升高,具有一定的遗传毒性.本研究在此基础上,以中国旱地广泛种植的大豆为受体植物,进一步考察了麻风树叶水浸提液对其根边缘细胞、根尖细胞丙二醛(MDA)含量、抗氧化酶活性的影响以及由其诱导的遗传毒性,以期了解麻风树释放的化感物质对根尖及其保护屏障的影响,揭示麻风树的化感作用机制,为验证麻风树是否属于高入侵风险植物提供相关证据,并为生物柴油原料植物的可持续发展提供理论依据.
1 材料与方法
1.1 供试材料供体植物麻风树叶片采自四川省攀枝花市仁和区沙沟,采后置于阴凉处阴干;受体植物大豆种子(“铁丰29号”)购自成都市种子市场.
1.2 水浸提液的制备将阴干后的麻风树叶片剪成2 cm2左右碎片,装入锥形瓶中,按照1∶20的比例加入蒸馏水,混匀后在25℃下摇床振荡48 h,2层纱布过滤2次后,得0.05 g/mL的母液(其他处理质量浓度以此为基础配制),放入4℃冰箱备用.实验设置0.01、0.02、0.03、0.04 和0.05 g/mL 等 5个质量浓度处理水平,以蒸馏水作对照.
1.3 材料培养及处理选择饱满、健康无损伤的大豆种子,用蒸馏水漂洗2次,再用质量分数0.5%KMnO4浸泡消毒10 min,洗净后用蒸馏水浸种12 h.将充分吸胀的大豆均匀置于铺有湿润纱布的洁净瓷盘中,其上覆盖一层湿润纱布,然后放入(25±1)℃的培养箱中避光培养至种子露白.待根长约30 mm时,移至底部垫有滤纸的直径为12 cm的培养皿中,每个培养皿放置15粒种子,其上覆盖一层滤纸.分别喷入10 mL 0.01~0.05 g/mL麻风树叶片水浸提液,以蒸馏水作对照,然后盖上培养皿盖,置于(25±1)℃培养箱中分别暗培养6、12和24 h,每处理重复3次.培养结束后取样进行相关指标测定.
1.4 测定指标及方法
1.4.1 大豆根尖果胶甲基酯酶(PME)活性以及根边缘细胞数目 1)PME活性:随机挑选各处理组10个根,剪取2~3 mm的根尖,置于含200 μL的PME提取液(柠檬酸0.1 mol/L、Na3PO40.2 mol/L、NaCl 1 mol/L)的研钵中,冰浴下充分研磨后倒入1.5 mL离心管中,充分振荡,冰浴2 h,每隔30 min振荡1次,后置于4℃、15 000 r/min下离心10 min,收集上清液,-20℃保存.PME活性检测方法参照文献[14]的方法,PME活性用1 h每个根尖催化果胶释放1 μmol的H+为一个酶活力单位(用U表示),重复3次.2)边缘细胞数目:随机挑选各处理组5个根,分别切取5 mm左右的根尖,移至预先装有100 μL H2O的1.5 mL离心管中,振荡仪振荡数秒,使边缘细胞在水中充分展开,制成根边缘细胞悬液.取细胞悬浮液10 μL置于另一0.5 mL的离心管中,依次加入100 μg/mL的溴化乙锭和吖啶橙各2 μL,避光染色2 min,荧光显微镜下镜检(活细胞为绿色,死细胞为橘红色),记录观察根边缘细胞数目,参考文献[15]的方法计算细胞数,重复3次.
1.4.2 大豆根尖细胞抗氧化酶活性 1)粗酶液的提取:分别切取1.3中处理后的根尖0.5 g,加入5 mL pH 7.0的磷酸缓冲液(PBS)冰浴研磨,4℃、10 000 r/min离心10 min,取上清液即为粗酶液,低温贮藏备用.2)抗氧化酶活性的测定:超氧化酶歧化酶(SOD)活性采用氯化硝基四氮唑蓝法测定[16];过氧化物酶(POD)活性采用愈创木酚法测定[16];过氧化氢酶(CAT)活性采用H2O2分解法测定[17].
1.4.3 大豆根尖细胞MDA含量和微核率1)MDA含量:MDA含量测定采用硫代巴比妥酸法[18].称取一定量的大豆根尖,置于研钵中,加入质量分数5%三氯乙酸冰浴研磨,10 min后4 000 r/min离心10 min,取上清液备用.取上清液1 mL,加入2 mL质量分数0.5%硫代巴比妥酸溶液,100℃水浴20 min,迅速冷却后离心,分别测定上清液在532、600和450 nm处的吸光值.计算MDA的含量.2)微核率:选取根长萌发至0.5 cm左右的种子,置于底部垫有滤纸的直径为12 cm的培养皿中,每个培养皿放置15粒种子,其上覆盖一层滤纸.分别喷入10 mL 0.01~0.05 g/mL各设置质量浓度麻风树叶片水浸提液,盖上培养皿盖,于(25±1)℃培养箱中,暗培养6、12和24 h,然后用蒸馏水浸洗3次,每次3 min,移至(25±1)℃恒温箱中恢复培养24 h,然后切取长度为1 cm左右的根尖用Carnoy固定液固定24 h,质量分数70%乙醇于4℃保存备用.取固定根尖用1 mol/L HCl 60℃解离,Schiff试剂染色,压片后镜检,每个根尖计数1 000个细胞,每个处理组统计5个根尖.微核率用根尖分生区间期细胞出现微核的百分率表示.
1.5 数据处理应用SPSS 18.0软件进行方差分析(ANOVA)和多重比较(LSD法).
2 结果与分析
2.1 麻风树叶水浸提液对大豆根尖边缘细胞的影响
2.1.1 边缘细胞数目 边缘细胞是从根冠表皮游离出来并聚集在根尖周围的一群特殊细胞,是保护植物根尖的第一道防线[19].麻风树叶水浸提液对大豆根边缘细胞数目的影响见表1.与对照相比,各处理时间段大豆根边缘细胞的数量均表现出随着叶水浸提液质量浓度的升高而先增高后降低的趋势,且处理间存在显著性差异(P<0.05).其中,水浸提液处理6 h后,各剂量组根边缘细胞的数量均显著高于对照,并在0.01 g/mL处理组达到最高值,比对照显著提高107%;处理12和24 h时,细胞数目分别在0.01和0.02 g/mL质量浓度处理时达到最大值,此时分别比对照显著提高35%和27%.这表明大豆根尖在受到麻风树叶水浸提液胁迫时,可产生大量根边缘细胞;随着麻风树叶水浸提液质量浓度的增加,根边缘细胞总数降低;水提液质量浓度超过0.04 g/mL,12和24 h处理组细胞总数显著低于对照,同时通过溴化乙锭和吖啶橙染色观察到各处理组有大量边缘细胞死亡(数据未列).
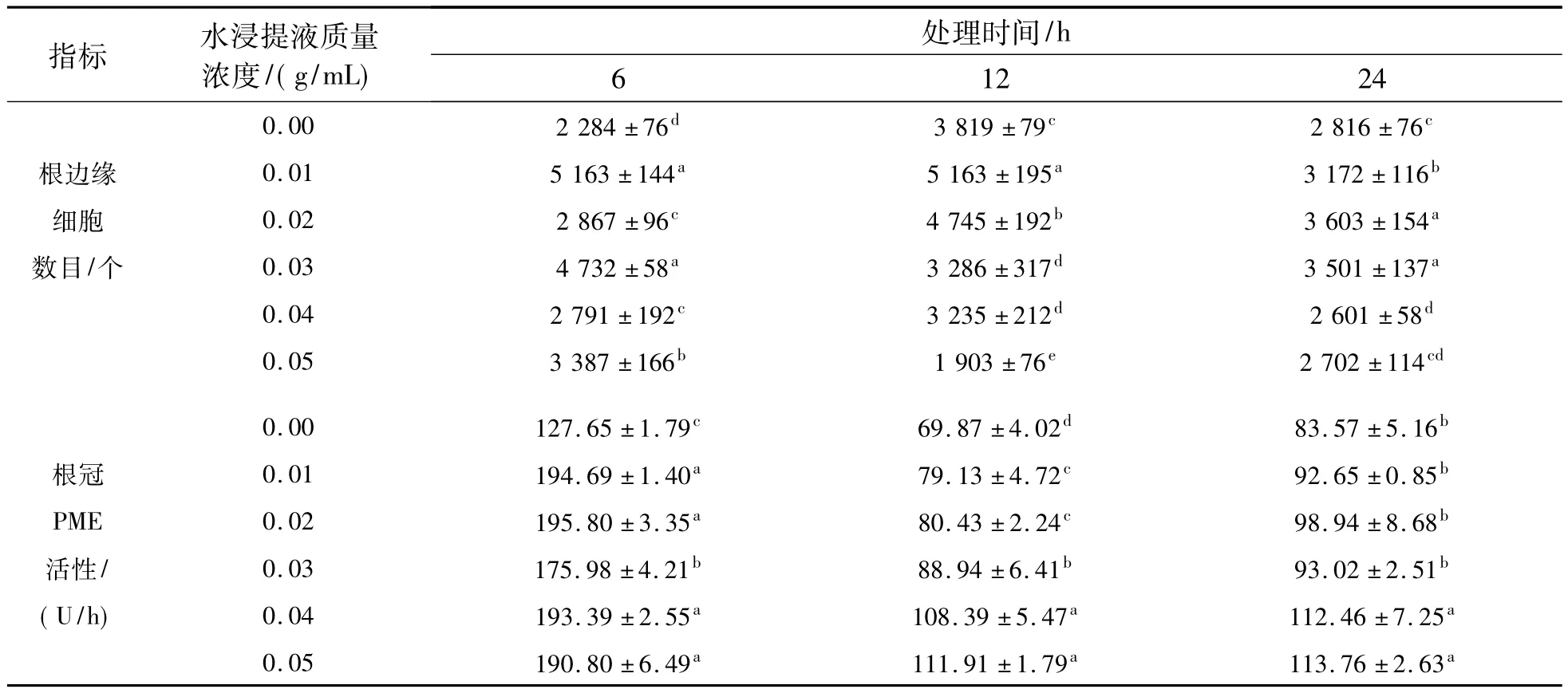
表1 麻风树叶水浸提液对大豆根尖边缘细胞数目和PME活性的影响Table 1 Effects of aqueous leaf extracts of Jatropha curcas on the number of root border cells and PME activity of soybean
2.1.2 根冠PME活性 根冠PME在根缘细胞的发育中有重要作用,其活性与根缘细胞的产生和诱导呈正相关[20].大豆根尖PME活性随麻风树叶水浸提液质量浓度的增加均表现为逐渐升高的趋势(表1),除处理24 h的0.01、0.02和0.03 g/mL处理组水浸提液对大豆根冠PME活性影响不显著外,其余处理质量浓度和处理时间下的大豆根冠PME活性均显著高于对照(P<0.05).通过比较发现,6 h处理组PME活性的上升幅度较大.
2.2 麻风树叶水浸提液对大豆根细胞抗氧化酶活性的影响细胞内的抗氧化酶系统主要包括SOD、CAT和POD等,能够将细胞内的氧自由基控制在0.2%左右,使机体免遭氧自由基的损伤[21].麻风树叶水浸提液对大豆根细胞抗氧化酶活性具有一定的影响(图1),其中,SOD和POD活性随质量浓度变化的趋势基本一致,均表现为随着麻风树叶水浸提液质量浓度的升高先降低后升高,而CAT活性的变化趋势较为复杂.在处理时间较短时(6 h),CAT活性随着叶水浸提液质量浓度的升高而表现出降低—升高—降低的趋势;随着处理时间延长(12和24 h),CAT活性则整体表现为下降的趋势.各处理时间下各处理质量浓度组的SOD活性均与对照无显著差异(P>0.05);除了6 h处理组的0.03和0.04 g/mL、12 h处理组的0.01和0.02 g/mL外,6 h处理组和12 h处理组各处理质量浓度,大豆根尖POD活性均与对照存在显著差异(P<0.05),而24 h处理组则无显著变化(P>0.05);除0.05 g/mL水浸提液处理24 h的大豆根尖CAT活性与对照差异显著(P<0.05)外,其余处理和时间均未达到显著性差异.
2.3 麻风树叶水浸提液诱导的膜脂过氧化和遗传损伤
2.3.1 MDA含量 MDA是机体受到氧化胁迫时,脂质过氧化的最终产物[22].在麻风树叶水浸提液作用下,大豆根尖细胞MDA含量的变化如图2所示.整体来看,在24 h处理组中,随着麻风树叶水浸提液质量浓度的升高,大豆根尖细胞中MDA含量先增加后减少;而6和12 h处理组变化趋势不明显,各处理组大豆根尖MDA含量的差异均未达到显著性差异(P>0.05).这些结果说明,麻风树水浸提液未引起大豆根尖细胞膜质过氧化.

图1 麻风树水浸提液对大豆根细胞抗氧化酶活性的影响Fig.1 Effects of leaf aquatic extracts from Jatropha curcas on the activities of antioxidant enzymes of soybean

图2 麻风树水浸提液对大豆根细胞MDA含量的影响Fig.2 Effects of leaf aquatic extracts from Jatropha curcas on MDA contents of soybean
2.3.2 微核率 微核是染色体畸变在间期细胞中的一种表现形式,通过观察微核的形成来检测遗传毒性[23].麻风树叶片水浸提液可诱导大豆根尖细胞出现微核(表2).3个处理时间中,不同处理质量浓度的大豆根细胞微核率均显著高于对照组(P<0.05).当水浸提液质量浓度为0.03 g/mL时,微核率达到最大,随着处理液质量浓度进一步升高,微核率有所下降,可能是由于水浸提液细胞毒性强,阻止根尖细胞有丝分裂的进行.
3 讨论
3.1 麻风树对根边缘细胞的化感效应根边缘细胞是当根尖浸入水中时能扩散到悬浮液中的那些细胞,由根冠细胞发育而来.根冠PME与根边缘细胞的释放具有密切的关系.根边缘细胞及其相关的黏液层在植物生长过程中起到多重功能,并在抵抗生物与非生物胁迫中起作用[9,24].进入土壤的化感物质需要先突破根边缘细胞这层保护屏障后,才能作用于根尖细胞并干扰其生命活动过程.在入侵植物反枝苋(Amaranthus retroflexusL.)[25]、加拿大蓬(Erigeron canadensisL.)[26]和土荆芥(Chenopodium AmbrosioidesL.)[27]化感胁迫下,随着处理质量浓度(剂量)升高,受体植物根边缘细胞存活率下降,根冠PME活性升高.本研究结果与此一致,在短时间(6 h)受到麻风树水浸提液作用时,大豆幼根通过提高PME活性加快释放根边缘细胞,由根边缘细胞及其黏液层中和化感物质,来缓解麻风树的化感胁迫.但是随着处理时间延长(12和24 h)和水浸提液质量浓度的增加,虽然根尖PME活性仍很高,但根边缘细胞数目有所降低,表明面对胁迫植物所接受的信号可能是对根边缘细胞的大量需求,因此通过反馈继续提高PME的表达,但由于其已大大超过根尖产生新根边缘细胞的能力,所以根边缘细胞数目降低,同时试验中观察到根边缘细胞大量死亡,表明麻风树水浸提液对根边缘细胞具有细胞毒性.
3.2 麻风树对根尖细胞的化感效应许多植物的化感物质具有遗传毒性和细胞毒性,影响细胞的有丝分裂过程[28-30].微核试验是检测染色体或有丝分裂器损伤的一种遗传毒性试验方法[23].无着丝粒的染色体片段或因纺锤体受损而丢失的整个染色体,在细胞分裂后期仍留在子细胞的胞质内成为微核.微核为游离于主核之外且和主核着色一致圆形或椭圆形的细胞内结构.胡琬君等[31]发现,经不同剂量土荆芥挥发油处理后,蚕豆根尖细胞出现多种类型的染色体畸变,微核率显著高于对照,在一定范围内呈现剂量效应和时间效应.本课题组前期研究表明[13],麻风树水溶性化感物质具有较强的遗传毒性.在麻风树叶水浸提液作用下,蚕豆根尖细胞出现染色体畸变现象,微核率和畸变率均明显高于对照.本研究进一步印证了这一结论,大豆根尖细胞的微核率随着麻风树水浸提液处理时间和处理质量浓度增加而升高.当质量浓度大于0.03 g/mL后,微核率虽然有所下降,由于水提液对大豆根尖细胞毒性较强,阻止其有丝分裂的进行,导致微核率有所下降,但仍然高于对照,表明麻风树水浸提液对大豆根尖细胞具有遗传毒性.同时本研究结果表明,麻风树水浸提液未诱导大豆根尖细胞的氧化损伤,提示其可能表现为直接的遗传毒性,引起DNA损伤或破坏了纺锤丝的结构与功能,由此形成的染色体断片或滞后染色体,在子核重建时形成了游离于主核的微核.

表2 麻风树叶水浸提液对大豆根尖细胞微核率的影响Table 2 Effect of the leaf aqueous extracts from Jatropha curcas on micronucleus rate of soybean root tip cells
综上所述,麻风树水浸提液对大豆根尖抗氧化系统的影响不大,但表现出较强的细胞毒性和遗传毒性.当麻风树的化感物质释放到环境以后,通过降低受体植物根边缘细胞的存活率,干扰根边缘细胞的保护功能,进而影响受体植物根尖细胞有丝分裂过程,最终导致受体植物生长发育受阻.因此,在大规模引种麻风树前,应对其潜在生态风险做预警分析.
[1]Basha S D,Francis G,Makkar H P S,et al.A comparative study of biochemical traits and molecular markers for assessment of genetic relationships betweenJatropha curcasL.germplasm from different countries[J].Plant Science,2009,176:812-823.
[2]Openshaw K.A review ofJatropha curcas:an oil plant of unfulfilled promise[J].Biomass and Bioenergy,2000,19(1):1-15.
[3]Negussie A,Achten W M J,Aerts R,et al.Invasiveness risk of the tropical biofuel cropJatropha curcasL.into adjacent land use systems:from the rumors to the experimental facts[J].GCB Bioenergy,2013,5(4):419-430.
[4]杜泽学,阳国军.木本油料生产生物柴油:麻疯树生物柴油产业的发展[J].化学进展,2009,21(11):2341-2348.
[5]Buddenhagen C E,Chimera C,Clifford P.Assessing biofuel crop invasiveness:a case study[J].Biofuel Invasiveness,2009,4(4):1-5.
[6]Cipollini K,Titus K,Wagner C.Allelopathic effects of invasive species(Alliaria petiolata,Lonicera maackii,Ranunculus ficaria)in the Midwestern United States[J].Allelopathy J,2012,29(1):63-76.
[7]缪丽华,王媛,高岩,等.再力花地下部水浸提液对几种水生植物幼苗的化感作用[J].生态学报,2012,32(14):4488-4495.
[8]Li Z H,Wang Q,Ruan X,et al.Phenolics and plant allelopathy[J].Molecules,2010,15:8933-8952.
[9]王亚男,姜华,王煜,等.不同状态绿豆根边缘细胞对Cd2+的响应[J].土壤学报,2013,50(1):168-173.
[10]王朋,王莹,孔垂华.植物挥发性单萜经土壤载体的化感作用:以三裂叶豚草(Ambrosia trifidaL.)为例[J].生态学报,2008,28(1):62-68.
[11]Zhang H,Wang J C.Allelopathic effects ofJatropha curcasleaf leachates on seedling growth and antioxidative enzymes inTagetes erectaL.[J].Agricultural Science & Technology,2011,12(10):1468-1471.
[12]马沅,陈放,王胜华,等.麻疯树水浸液对两种经济作物的化感作用研究[J].北方园艺,2009,8:19-23.
[13]邓骛远,王亚男,罗通,等.麻风树叶水浸提液对蚕豆根尖细胞的遗传毒性[J].西南农业学报,2012,25(6):2396-2398.
[14]Richard L,Qin L X,Gadal P,et al.Molecular cloning and characterization of a putative pectin methylesterase cDNA inArabiodopsis thalianaL.[J].FEBS Lett,1994,355:133-139.
[15]侯岁稳,贾敬芬.一种简易的植物原生质体计数方法[J].植物生理学通报,2002,38(1):57.
[16]Gechev T S,Breusegem F V,Stone J M,et al.Reactive oxygen species as signals that modulate plant stress responses and programmed cell death[J].BioEssays,2006,28:1091-1101.
[17]赵福庚,何龙飞,罗庆云.植物逆境生理生态学[M].北京:化学工业出版社,2004:5.
[18]Bogatek R,Gniazdowska A.ROS and phytohormones in plant-plant allelopathic interaction[J].Plant Signaling & Behavior,2007,2(4):317-318.
[19]姜华,王亚男,何兵,等.绿豆根边缘细胞发育特性[J].西北植物学报,2012,32(4):0704-0708.
[20]Wen F,Zhu Y,Hawes M C.Effect of pectin methylesterase gene expression on pea root development[J].Plant Cell,1999,11:1129-1140.
[21]郑荣梁,黄中洋.自由基生物[M].3版.北京:高等教育出版社,2007.
[22]李安奇,王亚男,张红,等.土荆芥残渣腐解液对大豆根尖抗氧化系统的影响[J].四川师范大学学报:自然科学版,2012,35(2):270-274.
[23]李宏.微核试验的研究进展[J].安徽农业科学,2009,37(7):2846-2866.
[24]蔡妙珍,刘 鹏,徐根娣,等.大豆根缘细胞对Al3+毒害的响应[J].中国农业科学,2007,40(2):271-276.
[25]刘爽,马丹炜.不同发育期反枝苋对黄瓜根缘细胞的化感作用[J].生态学报,2009,29(8):4392-4396.
[26]张红,贾贵芳,王亚男,等.蚕豆根缘细胞对加拿大蓬挥发油的响应[J].四川师范大学学报:自然科学版,2011,34(3):398-400.
[27]李安奇,王亚男,张红,等.大豆根边缘细胞对土荆芥组培根分泌物的响应[J].生态环境学报,2012,21(1):84-87.
[28]Bais H P,Vepachedu R,Gilroy S,et al.Allelopathy and exotic plant invasion:from molecules and genes to species interactions[J].Science,2003,301:1377-1380.
[29]Raoof K M A,Siddiqui M B.Allelotoxic effect of parthenin on cytomorphology of broad bean(Vicia fabaL.)[J].J Saudi Society Agricultural Sciences,2013,12:143-146.
[30]Nishida N,Tamotsu S,Nagata N,et al.Allelopathic effects of volatile monoterpenoids produced by Salvia leucophylla:inhibition of cell proliferation and DNA synthesis in the root apical meristem of Brassica campestris seedlings[J].J Chem Ecology,2005,31(5):1187-1202.
[31]胡琬君,马丹炜,王亚男,等.土荆芥挥发油对蚕豆根尖细胞的化感潜力[J].生态学报,2011,31(13):3684-3690.
