人附睾分泌蛋白4对卵巢癌复发的临床诊断价值
2014-08-08马潇潇任瑞锋张素萍赵海英
马潇潇 任瑞锋 张素萍 李 俊 赵海英 管 燕
人附睾分泌蛋白4对卵巢癌复发的临床诊断价值
马潇潇 任瑞锋 张素萍 李 俊 赵海英 管 燕
目的 评估人附睾分泌蛋白4(HE4)对判断卵巢癌复发的敏感性和特异性。方法 42例可疑卵巢癌复发患者和42例良性附件病变患者,在二次手术前24 h内留取血清样品集中检测HE4和CA125水平。结果 CA125诊断卵巢癌复发的敏感性和特异性分别为38.09%和57.14%。HE4以70 pmol/L 和150 pmol/L作为诊断界点,诊断卵巢癌复发的敏感度分别为76.19%和28.57%。特异性均为100.00%。结论 HE4判断卵巢癌复发优于CA125,以70 pmol/L作为诊断界点可以获得绝对的特异性。
人附睾分泌蛋白4;糖类抗原-125;卵巢癌复发
(ThePracticalJournalofCancer,2014,29:1544~1547)
晚期卵巢癌即使经过手术和几个月的化疗,总体2年无复发生存率为33.6至95.8%之间[1]。监测肿瘤复发的策略目前仍未统一。目前多数妇科肿瘤医师在完成初次治疗后的第一年里对患者每3个月进行一次CA125联合CT或MRI成像加体格检查的组合评价[2]。
由于CA125经常在非恶性肿瘤疾病升高所以其具有很高的假阳性率[3]。
因此,近年来为了提高检测卵巢癌的特异性和灵敏性,有许多对新型生物标志物,如人附睾蛋白4(HE4)单独或联合CA125的组合的研究[4-6]。HE4是近年来用于诊断早期卵巢癌一个新标记物,比CA125具有更高的灵敏度(76.9%)[7]。近期美国食品和药物管理局(FDA)批准HE4与CA125检测相结合用于监测上皮性卵巢癌复发或疾病进展[8]。然而,目前为止只有两个关于HE4应用于监测卵巢癌复发[4,9]的研究。这两项研究均未单独计算HE4监测复发卵巢癌的敏感度和特异性。本研究为首个前瞻、对照比较CA125和HE4在卵巢癌复发组(研究组)与良性附件病变组(对照组)患者中表达的敏感性和特异性的研究。
1 资料与方法
1.1 资料来源
本研究自2010年11月至2013年6月,前瞻性入选华北石油管理局总医院妇科可疑卵巢癌复发的患者(研究组)和良性附件病变组(对照组),本研究经医院伦理委员会批准。入选标准如下:①年龄18~80岁;②符合2009年国际妇产科联盟(FIGO)标准;③获得了患者的知情同意。排除标准包括:①严重肝肾功能不全,严重心力衰竭,血液疾病;心脏异常、血液、肾脏、呼吸和(或)肝功能异常;②存在其他的恶性肿瘤。
1.2 主要仪器和试剂
DENLEY DRAGON Wellscan MK 3 全自动酶标仪:芬兰Thermo 公司生产;Alisei 全自动酶免疫分析仪:意大利 SEAC 公司生产;HE4试剂盒和质控品由瑞典CanAg公司提供;CA125试剂盒和质控品由瑞士Roche公司提供。HE4 水平检测采用ELISA 双抗体夹心法;CA125水平的测定采用电化学发光免疫分析法。CA125参考值为 0~35 U/ml,CA125>35 U/ml 判断为CA125阳性。血清HE4 参考值为 0~150 pmol/L,设定两个界值HE4>70 pmol/L和 HE4>150 pmol/L 判断为 HE4 阳性。
所有可疑复发的卵巢癌患者均行盆腔超声检查、CT或MRI检查中的至少一个。所有患者于手术前一天获取用于肿瘤标志物分析的血液样品。
研究组中入选的卵巢癌复发患者均行二次手术,由妇科肿瘤病理学家进行病理检查。
1.3 统计学方法
应用统计软件SPSS 18.0进行统计学分析,首先进行正态分布检验。经检验CA125和HE4数据均不符合正态分布,HE4和CA125水平以中位数(四分位数间距)表示;以病理诊断为“金标准”进行四格表分析,计算敏感度和特异度。应用受试者工作特征(ROC)曲线得到诊断卵巢癌复发的诊断界值,并由ROC曲线下面积综合评价CA125和HE4的诊断准确性。
2 结果
2.1 两组患者一般情况(表1)
2.2 两组患者HE4和CA125水平
研究组CA125中位数为68 (23~133)U/ml;HE4中位数为103.6 pmol/L(58~187)。研究组中CA125水平高于诊断界点16例(38.09%),HE4水平高于诊断界点(70 pmol/L)32例(76.19%),而HE4水平高于诊断界点150 pmol/L 12例(28.57%)。
对照组CA125中位数为25 U/ml(13~162);HE4中位数为19 pmol/L(10~42)。对照组患者中CA125水平高于诊断界点18例(42.9%),HE4水平高于诊断界点70和150 pmol/L未检测到。
研究组中CA125单独检测对判断卵巢癌复发的灵敏度38.09%,而HE4以70和150 pmol/L作为诊断界点的敏感性分别是76.19%和28.57%。在这两种情况下,HE4的特异性是绝对的(100.00%),而CA125的特异性仅为57.14%,阳性预测值47.06%,见表2。

表1 两组患者一般情况(例,%)

表2 HE4和CA125诊断准确性/%
CA125和HE4诊断卵巢癌复发的ROC分析:HE4的阳性预测值(PPV)是100%,诊断界点定为70和150 pmol/L时阴性预测值(NPV)是80.77%和58.33%。CA125诊断卵巢癌复发的ROC曲线:ROC曲线下面积为0.558(95%,CI 0.417-0.699)(图1)。HE4诊断卵巢癌复发的ROC曲线:ROC曲线下面积为0.901(95%,CI 0.813-0.980)(图2)。

图1 CA125诊断卵巢癌复发的ROC曲线
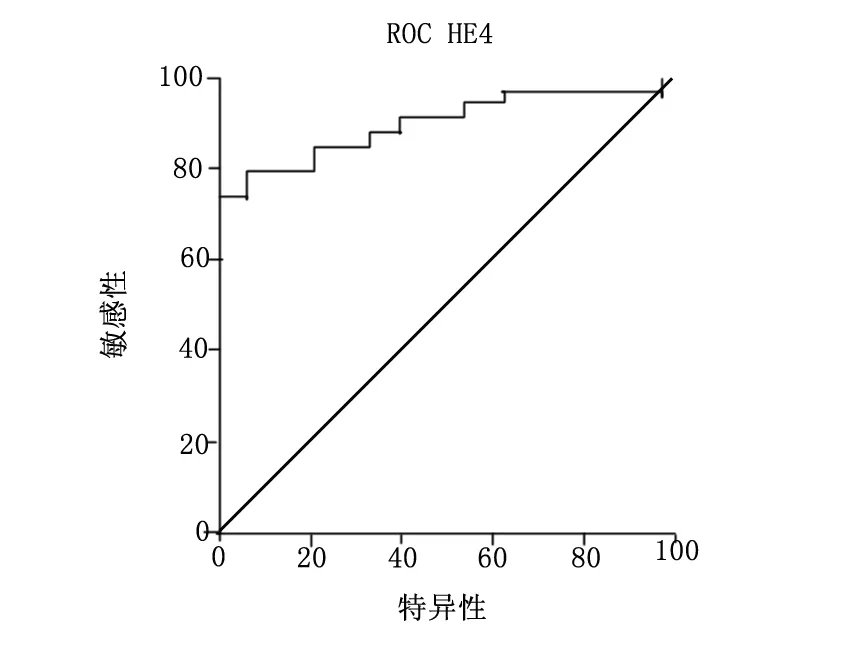
图2 HE4诊断卵巢癌复发的ROC曲线
3 讨论
目前监测卵巢癌复发的策略尚未统一。Rustin等发现,高达70%的患者在卵巢癌复发的症状和体征出现之前5个月血清CA125水平已经升高,其预测疾病进展的敏感性为80%~90%[10-11]。虽然串联数个指标监测可早期发现卵巢癌术后复发,但却增加漏诊率。唯一对比根据CA125水平同传统的临床指标监测卵巢癌复发的随机、对照、多中心试验的结果显示两种治疗方案在总体生存率方面未见明显统计学差异[12]。此外还有一些关于CA125作为肿瘤血清标志物监测卵巢癌复发的文献报道。CA125抗原不仅在卵巢癌患者血清中高表达,也在非恶性疾病升高从而导致其特异性降低[13]。因而急需新的监测卵巢癌复发或疾病进展的标志物应用于临床。
作为单个肿瘤标记物,HE4与CA125相比在检测早期阶段的恶性肿瘤方面具有更高的灵敏度(76.9%)[7]。HE4在浆液性和子宫内膜样卵巢癌中高表达,提示其可用于区分不同的肿瘤类型[14]。有研究证实 HE4在非恶性妇科疾病中与CA125 具有相似的敏感性,且假阳性率更低[5,15]。
目前仅有两个关于HE4监测卵巢癌的研究。Havrilesky等[4]入选卵巢癌复发患者27例,使用生物标志物组合(包括HE4,MMP7和Glycodelin)预测复发的敏感性为100%,单独使用CA125的敏感性为 96%。生物标志物组合中至少有一种在患者出现临床症状、体征之前升高(提前时间范围6~69周),其中CA125升高的占 14/27例(52%)[4]。Anastasi等入选卵巢癌复发患者5例,HE4在CA125升高前5~8个月已经升高[9]。尽管这两个研究未对单独使用HE4作为监测指标的敏感性和特异性进行研究。仍提示HE4可能是卵巢癌复发的早期重要指标。
本研究为首个前瞻、对照比较CA125和HE4在卵巢癌复发患者中表达敏感性和特异性的研究。结果显示CA125灵敏度35.29%低于Havrilesky等的研究结果(96%)。但是,回顾分析文献资料中CA125的敏感性,根据38篇文献采用35 U / ml的作为诊断界点敏感性为65%,前置时间中位数为3个月(1~7个月)[16]。
本研究结果显示HE4在鉴别恶性疾病方面比CA125更有效。此外,特异性和阳性预测值均为100%。文献中未见关于HE4诊断复发性卵巢癌的敏感性和特异性的数据同本研究比较。Havrilesky等[4]使用生物标志物组合(包括HE4)研究其预测卵巢癌复发的敏感性,但该研究未考虑单个标记物的敏感性。
既往有许多研究都试图确定HE4的诊断界点但是结果不一致[17-18]。本研究中HE4设置两个诊断界点:150 pmol/L(按照制造商的指示),和70 pmol/L( Moore等所建议的)[6]。使用HE4>1.8 ng/ mL作为诊断界点检测早期敏感性达到82.7%,而检测恶性程度高的敏感性为92.5%。Anastasi等HE4使用150 pmol/L作为诊断界点诊断卵巢癌有96.9%的敏感性[9]。另一方面,Moore等的使用70 pmol/L作为HE4诊断界点用于检测早期卵巢癌,可以获得95%的特异性和72.9%的灵敏度[17]。与此相反,Montagnana等使用30 pmol/L作为早期卵巢癌的诊断界点,发现灵敏度和特异度分别是98%和100%[18]。本研究结果显示,HE4在诊断卵巢癌复发方面较CA125具有更高的敏感性和特异性。根据本研究中ROC曲线,最佳HE4检测卵巢癌复发诊断界点是67.1 pmol/L。
总之,HE4的绝对特异性可能是至关重要的,可以避免不必要的探查性手术和(或)影像学检查,并可选择卵巢癌复发的高危患者转院至到高度专业化的肿瘤中心。HE4尤其适用于监测CA125阴性的卵巢癌患者。
[1] Heintz AP,Odicino F,Maisonneuve P,et al.Carcinoma of the ovary.FIGO 26th annual report on the results of treatment in gynecological cancer〔J〕.Int J Gynaecol Obstet,2006,95(Suppl1):S161-S192.
[2] Bast Jr RC.CA125 and the detection of recurrent ovarian cancer:a reasonably accurate biomarker for a difficult disease〔J〕.Cancer,2010,116(12):2850-2853.
[3] Grover S,Quinn MA,Weideman P,et al.Factors influencing serum CA125 levels in normal women〔J〕.Obstet Gynecol,1992,79 (4):511-514.
[4] Havrilesky LJ,Whitehead CM,Rubatt JM,et al.Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence〔J〕.Gynecol Oncol,2008,110(3):374-382.
[5] Hellstrom I,Raycraft J,Hayden-Ledbetter M,et al.The HE4〔WFDC2〕protein is a biomarker for ovarian carcinoma〔J〕.Cancer Res,2003,63(13):3695-3700.
[6] Moore RG,Brown AK,Miller MC,et al.The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass〔J〕.Gynecol Oncol,2008,108(2):402-408.
[7] Abdel-Azeez HA,Labib HA,Sharaf SM,et al.HE4 and mesothelin:novel biomarkers of ovarian carcinoma in patients with pelvic masses〔J〕.Asian Pac J Cancer Prev,2010,11(1):111-116.
[8] Fleming ND,Cass I,Walsh CS,et al.CA125 surveillance increases optimal resectability at secondary cytoreductive surgery for recurrent epithelial ovarian cancer〔J〕.Gynecol Oncol,2011,121(2):249-252.
[9] Anastasi E,Marchei GG,Viggiani V,et al.HE4:a new potential early biomarker for the recurrence of ovarian cancer〔J〕.Tumor Biol,2010,31(2):113-119.
[10] Rustin GJ,Nelstrop AE,Tuxen MK,et al.Defining progression of ovarian carcinoma during follow-up according to CA125:a North Thames Ovary Group Study〔J〕.Ann Oncol,1996,7(4):361-364.
[11] Rustin GJ,Marples M,Nelstrop AE,et al.Use of CA125 to define progression of ovarian cancer in patients with persistently elevated levels〔J〕.J Clin Oncol,2001,19(20):4054-4057.
[12] Rustin GJ,van der Burg ME,Griffin CL,et al.Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955):a randomised trial〔J〕.Lancet,2010,376(9747):1155-1163.
[13] Jacobs I,Bast Jr RC.The CA125 tumour-associated antigen:a review of the literature〔J〕.Hum Reprod,1989,4(1):1-12.
[14] Scholler N,Crawford M,Sato A,et al.Bead-based ELISA for validation of ovarian cancer early detection markers〔J〕.Clin Cancer Res,2006,12(7):2117-2124.
[15] Hellstrom I,Hellstrom KE.SMRP and HE4 as biomarkers for ovarian carcinoma when used alone and in combination with CA125 and/or each other〔J〕.Adv Exp Med Biol,2008,622:15-21.
[16] Geurts SM,de Vegt F,van Altena AM,et al.Considering early detection of relapsed ovarian cancer:a review of the literature〔J〕.Int J Gynecol Cancer,2011,21(5):837-845.
[17] Moore RG,Jabre-Raughley M,Brown AK,et al.Comparison of a novel multiple marker assay vs the Risk of Malignancy Index for the prediction of epithelial ovarian cancer in patients with a pelvic mass〔J〕.Am J Obstet Gynecol,2010,203(3):228.e1-6.
[18] Jacob F,Meier M,Caduff R,et al.No benefit from combining HE4 and CA125 as ovarian tumor markers in a clinical setting〔J〕.Gynecol Oncol,2011,121(3):487-491.
(编辑:吴小红)
Clinical Diagnostic Value of Human Epididymal Secretory Protein 4 in the Recurrence of Ovarian Cancer
MAXiaoxiao,RENRuifeng,ZHANGSuping,etal.
GeneralHospitalofNorthChinaPetroleumAdministrationBureau,Renqiu,062552
Objective To evaluate the sensitivity and specificity of human epididymal secretory protein 4(HE4)in detecting recurrent ovarian cancer.Methods Serum samples were obtained 24 h before surgery from 42 cases of suspicious recurrent ovarian cancer and 42 patients with benign adnexal leison.HE4 and carbohydrate antigen 125(CA125) levels were detected.Results Sensitivity and specificity of CA125 in detecting recurrent ovarian cancer were 38.09 and 57.14 %,respectively.Two HE4 cut-off value were 70 pmol/L and 150 pmol/L.The HE4 sensitivity were 76.19 and 25.87 %,respectively.The HE4 specificity was 100 %.Conclusion HE4 is superior to CA125 in detecting ovarian cancer recurrence,70 pmol/L cut-off of HE4 can achieve absolute specificity.
Human epididymis protein 4(HE4);Carbohydrate antigen 125(CA125);Recurrent ovarian cancer
华北油田矿区临床医学研究课题(编号:2013-HB-G-19-3)
062552 华北石油管理局总医院妇产科
管 燕
10.3969/j.issn.1001-5930.2014.12.011
R737.31
A
1001-5930(2014)12-1544-04
2014-10-09
2014-10-29)
