苦参碱体外促进肿瘤细胞凋亡的实验研究
2014-08-08李国慧张剑霄黄慧王会茹王倩徐茜茹刘新光
李国慧,张剑霄,黄慧,王会茹,王倩,徐茜茹,刘新光
论著·基础
苦参碱体外促进肿瘤细胞凋亡的实验研究
李国慧,张剑霄,黄慧,王会茹,王倩,徐茜茹,刘新光
目的探讨苦参碱体外促进肿瘤细胞凋亡及其作用机制。方法将浓度为0.2 mg/ml、0.4 mg/ml、0.6 mg/ml的苦参碱作用于卵巢癌细胞株A21-2和骨肉瘤细胞株MG63,利用倒置相差显微镜观察不同浓度苦参碱作用后细胞的形态变化;流式细胞术(FCM)检测细胞凋亡周期、Caspase-3蛋白的表达。结果倒置相差显微镜观察表明,苦参碱能抑制MG63细胞和A21-2细胞的增殖;FCM分析发现,苦参碱与细胞作用72h后,G0/G1期前出现凋亡峰,与对照组比较,观察组不同浓度下凋亡率升高(P<0.01),且随浓度升高,凋亡率亦增高,差异有统计学意义(P<0.05),FCM分析显示,与对照组比较,观察组不同浓度下Caspase-3蛋白表达升高(P<0.01),且随浓度升高,Caspase-3蛋白表达亦升高,差异有统计学意义(P<0.05)。结论苦参碱能明显抑制A21-2细胞和MG63细胞的增殖,诱导细胞凋亡,其机制可能与促进Caspase-3蛋白的表达有关。
苦参碱;A21-2;MG63;细胞凋亡;Caspase-3蛋白
世界卫生组织曾预测恶性肿瘤将成为21世纪人类的第一杀手[1],恶性肿瘤已成为我国居民的首要死因。女性生殖系统常见肿瘤之一——卵巢癌,是妇科恶性肿瘤中病死率最高的肿瘤,近年来虽然卵巢恶性肿瘤在基础研究、临床诊治方面均取得很大的进展,但遗憾的是其5年生存率仍提高不明显,仍在30%左右。骨肉瘤是常见的骨原发性恶性肿瘤,以其恶性程度高、发生转移早等特点成为骨科领域的一大难题。在对卵巢癌和骨肉瘤的临床治疗过程中,常采用手术后辅以放化疗等治疗手段以期提高患者的生存期,但是由于放化疗不良反应较大,很多患者无法完成全部放化疗过程,因此研发高效低毒的抗肿瘤药物成为目前医学研究的热点。随着研究的不断深入,中药的抗肿瘤作用越来越为人们所认知,以其高效低毒的优势在治疗恶性肿瘤的过程中发挥着不可替代的作用。苦参碱作为药用植物,据文字记载在我国已有2000年的历史,具有抗炎、杀菌、清热、解毒等功效;同时还具有抗病毒、抗过敏等多种作用。本实验将苦参碱体外作用于卵巢癌细胞株A21-2及骨肉瘤细胞株MG63,通过倒置相差显微镜、流式细胞术等检测手段,观察苦参碱作用后肿瘤细胞形态学变化,检测苦参碱对肿瘤细胞的促凋亡作用及Caspase-3蛋白的表达情况, 以期从凋亡角度研究苦参碱的抗肿瘤作用,进一步丰富苦参碱抗肿瘤作用的基础研究,为苦参碱早日应用于临床提供相应的实验依据。
1 材料与方法
1.1 材料 (1)A21-2细胞株和MG63细胞株由河北医科大学第三附属医院实验中心提供,A21-2细胞株培养于含10%胎牛血清(fetal bovine serum,FBS)的RPMI1640培养基中,MG63细胞株培养于含10% FBS、100 U/ml青霉素、100 U/ml链霉素的DMEM培养基中。(2)药品及试剂:二甲基亚枫(DMSO)、乙二胺四乙酸(EDTA)购自北京化工厂;FBS购自杭州四季青公司,胰酶(trypsin)为石家庄拜昂生物技术有限公司产品, RPMI1640培养基及DMEM培养基为GIBCO公司产品;苦参碱为山西泰盛药业集团产品,鼠抗人Caspase-3单克隆抗体,异硫氰酸荧光素(FITC)标记的羊抗鼠二抗购自Santa Cruz生物技术公司。(3)主要仪器:超净工作台(苏净集团安泰公司,中国苏州);Epic XL IV型流式细胞仪(Beckman-Coulter公司,美国);CO2培养箱(Heraeus BB6220,德国);W2-2型微量振荡器(北京朝阳区电子电子仪器一厂,中国);倒置相差显微镜(Olympus,CK-40 32PH,日本);台式高速离心机(EPPENDORF 5415D 德国);UV-2550型分光光度计(岛津公司,日本)。
1.2 细胞复苏及培养 将保存有A21-2细胞株和MG63细胞株的冷冻管自液氮罐中取出,迅速放入39~40℃温水中不停晃动1 min以上,完全溶解后直接离心,弃上清以去掉冻存液,D-Hanks液洗涤1次后,分别在A21-2细胞株和MG63细胞株中加入RPMI1640培养基和DMEM培养基1 ml使其成为悬浮细胞,将细胞接种于培养瓶中,加入新鲜培养基,放入37℃,5%CO2培养箱中培养。待细胞生长至对数生长期时收集细胞用于实验。
1.3 检测项目
1.3.1 细胞形态变化: 在放有盖玻片的培养皿中培养A21-2细胞、MG63细胞,待细胞生长至对数生长期时,将肿瘤细胞分为4组,每组10例,分别加入终浓度为0.2 mg/ml、0.4 mg/ml、0.6 mg/ml的含苦参碱培养基作为观察组,对照组中加入不含药物的新鲜培养基,应用倒置相差显微镜定时观察并照相。
1.3.2 细胞凋亡检测: 收集经不同浓度苦参碱作用72 h的A21-2细胞、MG63细胞及其各自对照组细胞,经PBS漂洗数次。用体积分数为70%、预冷的乙醇4℃固定过夜, 检测前加入生理盐水10 ml,1 000 r/min离心3 min去除固定液。加入0.5%胃蛋白酶消化细胞使其成为单细胞混悬液,加入碘化丙锭(PI,50 mg/L Trinton X-100 1.0%)1 ml室温避光染色30 min,应用流式细胞仪进行细胞凋亡和细胞周期分布检测,应用软件进行分析。
1.3.3 Caspase-3蛋白表达: 收集经0.2 mg/ml、0.4 mg/ml、0.6 mg/ml苦参碱作用72 h的A21-2细胞、MG63细胞及其各自对照组细胞,按要求进行荧光标记,应用流式细胞仪检测被测细胞荧光强度,蛋白表达情况以荧光指数(FI)表示。
2 结 果
2.1 肿瘤细胞变化 倒置相差显微镜下可见对照组细胞贴壁状态良好(图1、2见封3)。观察组细胞胞体变圆,附壁能力明显减弱,部分细胞脱落,悬浮于培养基中成为悬浮细胞,经0.2、0.4、0.6 mg/ml的苦参碱处理A21-2和MG63细胞72 h后,细胞生长缓慢甚至停止,G0/G1期细胞明显增多,贴壁细胞数量明显减少,并伴有大量细胞死亡(图3、4见封3)。A21-2和MG63细胞的凋亡率随着药物浓度的增加逐渐上升,与对照组比较,观察组细胞的凋亡率显著升高(P<0.01)。见表1。
2.2 Caspase-3蛋白表达 FCM分析发现,0.2、0.4、0.6 mg/ml的苦参碱处理A21-23和MG6细胞72 h后,Caspase-3蛋白表达升高。与对照组比较,随着苦参碱浓度增加,肿瘤细胞Caspase-3蛋白表达也明显升高(P<0.01)。见表2。

表1 A21-2和MG63细胞经不同浓度苦参碱作用后各细胞周期百分率及凋亡率变化
注:与对照组比较,*P<0.01;与0.2 mg/ml比较,#P<0.05;与0.4 mg/ml比较,△P<0.05
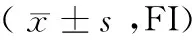
表2 A21-2和MG63细胞经苦参碱作用后对Caspase-3蛋白表达的影响
注:与对照组比较,*P<0.01;与0.2 mg/ml比较,#P<0.05;与0.4 mg/ml比较,△P<0.05
3 讨 论
恶性肿瘤目前在世界范围内是常见病、多发病,是严重危害人类健康的一大杀手。虽然手术治疗是恶性肿瘤治疗的首选,但术后的复发和转移仍是威胁患者生存的重要原因之一,此时内科治疗就成为了治疗肿瘤的重要手段。虽然化疗和其他辅助治疗随着研究的不断深入取得了一些喜人的成果,但仍未明显提高目前的治疗水平,因此寻找疗效高、不良反应小的抗肿瘤药物已成为当前重要的研究内容。
作为我国传统中药,苦参碱在临床中应用较为广泛,如抗炎、抗病毒、保肝及调节机体免疫力等功效[2~5]。近年来关于苦参碱的抗肿瘤作用也为研究者所关注,结果显示,苦参碱具有广谱抗肿瘤作用,且在抗肿瘤同时能够提高机体免疫力,对正常细胞不产生破坏作用[6,7]。
细胞凋亡是一种细胞死亡方式,是细胞的一种基本生物学现象,在机体生长发育过程中,有机体通过细胞凋亡清除无用细胞及病变细胞,发挥着调控机体发育、维持内环境稳定的重要功能。有研究表明肿瘤的发生、发展及恶化不仅与细胞的增殖分化异常有关,还与其凋亡障碍有关[8,9]。在本实验中,将苦参碱作用于卵巢癌细胞株A21-2和骨肉瘤细胞株MG63,用倒置相差显微镜观察药物作用后细胞的形态变化,发现A21-2细胞和MG63细胞生长均受到明显抑制,培养液中出现大量死亡细胞。流式细胞术显示,A21-2细胞和MG63细胞在细胞周期G0/G1期所占比例逐步增加,G2/M期比例逐步下降,同时在观察组细胞G1期发现凋亡峰。通过以上实验我们发现,苦参碱能明显抑制卵巢癌A21-2细胞和骨肉瘤MG63细胞的增殖,干扰细胞周期进程,诱导肿瘤细胞发生凋亡。
尽管凋亡机制目前尚未完全清楚,但在凋亡过程中Caspase即半胱天冬蛋白酶在凋亡过程中的作用是勿庸置疑的,细胞凋亡的过程实际上是Caspase不可逆有限水解底物的级联放大反应过程,其中Caspase-3是细胞凋亡的启动者和执行者,是细胞凋亡中的关键蛋白[10~12]。在无异常情况下,Caspase-3以酶原的形式存在于细胞中,机体一旦启动凋亡程序,则Caspase-3被活化,进而促进凋亡的发生。在本实验中通过流式细胞术发现,0.2、0.4、0.6 mg/ml的苦参碱处理A21-2和MG6细胞72h后,随着药物浓度增加,Caspase-3蛋白的表达也逐渐增加。
通过本实验可发现肿瘤细胞A21-2和MG63经苦参碱作用后,细胞生长受到明显抑制,细胞周期发生阻滞,多数细胞分裂被阻滞于DNA合成前期即G1,阻止了肿瘤细胞向S期转化,从而减少细胞DNA的合成和有丝分裂,同时促进了肿瘤细胞的分化,使细胞出现明显的凋亡形态,并伴有细胞凋亡效应期中心分子Caspase-3蛋白表达升高,表明苦参碱诱导肿瘤细胞凋亡且促凋亡机制可能与促进Caspase-3蛋白表达有关。
1 谢文琴,金少华,贾尚春,等. 安徽省1996—2005年恶性肿瘤病死率分析[J]. 安徽预防医学杂志,2007,13(2):96-98.
2 张丽华,陈邦恩,潘明佳.苦参碱药理作用研究进展[J].中草药,2009, 40(6):1000.
3 Zhang F, Wang X, Tong L, et al. Matrine attenuates endotoxininduced acute liver injury after hepatic ischemia/reperfusion in rats[J]. Surg Today,2011,41(8):1075-1084.
4 周粼, 张家骅, 甘平.苦参碱预处理对预防大鼠肝脏缺血再灌注损伤的作用观察[J].中国现代普通外科进展,2009,12(7):557-560.
5 王君明,崔瑛.山豆根化学成分药理作用及毒性研究进展[J]. 中国实验方剂学杂志,2011,17(4):229.
6 Zhang JQ, Li YM, Liu T, et al. Antitumor effect of matrine in human hepatoma G2 cells by inducing apoptosis and autophagy[J].World J Gastmenterol, 2010,16(34):4281-4290.
7 Qin XG, Hua Z, Shuang W, et al. Effects of matrine on hepG2 cell proliferation and expression of tumor relevant proteins in vitro[J]. Pharmaceutical Biology, 2010,48(3):275-281.
8 Ostuki T, Kanno T, Fujita Y, et al. Adenosine receptor-mediated p53-dependent apoptosis in lu-65 human lung cancer cells[J]. Cell Phsiol Biochem, 2012, 30(1):210.
9 刘粉霞,徐玉芳,孙宁.氧化苦参碱诱导人胃癌细胞凋亡的实验研究[J].中国医药导报, 2011,8(31):27-28,32.
10 Cho BB,Toledo-Pereyra LH.Caspase-independent programmed cell death following ischemic stroke[J].J Invest Surg, 2008,21(3):141-147.
11 Fuchs Y, Steller H. Programmed cell death in animal development and disease[J]. Cell,2011,147(4):742-758.
12 Huang Q, Li F, Liu X, et al. Caspase3-mediated stimulation of tumor cell repopulation during cancer radiotherapy[J]. Nat Med, 2011, 17(7):860-866.
Experimentalstudyofmatrineoninductionoftumorcellsapoptosisinvitro
LIGuohui,ZHANGJianxiao,HUANGHui,WANGHuiru,WANGQian,XUQianru,LIUXinguang.
DepartmentfoLaboratory,Children'sHospitalofHebeiProvince,Shijia-zhuang050031,China
ZHANGJianxiao.E-mail:liguohui0611@126.com
ObjectiveTo investigate the effect of matrine on induction of tumor cells apoptosis and its molecular mechanisms.MethodsA21-2 and MG63 cells were treated with matrine at different concentration:0.2 mg/ml,0.4 mg/ml,0.6 mg/ml. Using light microscope to observe the change of morphology; flow cytometry (FMC)method was used to detect the apoptosis cycles of cells and expression of Caspase-3 protein.ResultsAfter matrine treatment, inverted microscope observation showed that the growth of cells was inhibited significantly. Flow cytometry method showed that there was a sub-G0/G1apo-ptosis peak in the graph of drug-treated groups after 72h. Compared with control group, the apoptosis rate increased in observation group(P<0.01),and the more the concentration was ,the higher the apoptosis rate was(P<0.01).FCM analysis showed Caspase-3 increased in observation group than control group(P<0.01),and alone with the increase of the concentration,the expression of Caspase-3 increased(P<0.05).ConclusionMatrine can inhibit proliferation of A21-2 and MG63 cells. It's molecular mechanism might be related to modulating the expression of Caspase-3 protein.
Matrine; A21-2 cells;MG63 cells; Cell apoptosis; Caspase-3
河北省卫生厅重点科技研究计划(No.20120016)
050031 石家庄,河北省儿童医院检验科
张剑霄,E-mail:liguohui0611@126.com
10.3969/j.issn.1671-6450.2014.06.023
2013-10-09)
