非编码小RNA T64对伤寒沙门菌基因表达的影响
2014-08-07王哲鑫吉滢赵昕徐顺高黄新祥
王哲鑫,吉滢,赵昕,徐顺高,黄新祥
(江苏大学医学院,江苏镇江212013)
非编码小RNA T64对伤寒沙门菌基因表达的影响
王哲鑫,吉滢,赵昕,徐顺高,黄新祥
(江苏大学医学院,江苏镇江212013)
目的:对由转录组测序获得的伤寒沙门菌(Salmonella enterica serovar Typhi,S.Typhi)非编码小RNA(small non-coding RNA,snRNA)T64的表达进行验证,并对其功能进行初步探讨。方法:选取特异性引物采用反转录PCR(RT-PCR)和普通PCR确认T64在S.Typhi中的表达;将含有T64 snRNA序列的重组质粒导入S.Typhi野生株构建T64高表达株;结合应用S.Typhi全基因组芯片分析技术,比较S.Typhi T64高表达株和空载体对照株在对数期基因表达谱差异,并对部分基因芯片结果进行实时荧光定量PCR(qRT-PCR)验证。结果:RT-PCR结果显示,snRNA T64在S.Typhi确有表达;基因芯片分析结果显示,与空载体对照株比,snRNA T64高表达株在对数期有20个基因表达上调,7个下调;4个被选基因表达的qRT-PCR结果与芯片分析结果相符。结论:snRNA T64在S.Typhi中表达,可能在基因的表达调节中发挥重要作用。
伤寒沙门菌;非编码小RNA;基因芯片分析;实时荧光定量PCR;基因表达调节
近年来,人们对生物体内非编码小RNA(small non-coding RNA,snRNA)的研究日益增多。snRNA作为新的基因表达调控因子的作用也引起了重视[1]。转录组测序是发现细菌中snRNA的强有力手段,结合生物信息学学者们发现和证实了150余种snRNA,主要存在于大肠埃希菌(Escherichia coli,E.coli)、铜绿假单胞菌、霍乱弧菌等细菌中[2]。这些snRNA大多通过不完全配对方式与一个或多个靶基因的mRNA碱基形成互补配对[3-5],于转录后水平影响基因的表达[6],在细菌生长、代谢、应激等生命过程中发挥重要作用[7-8]。
借助前期对转录组测序数据和生物信息学分析,我们预测伤寒沙门菌(Salmonella enterica serovar Typhi,S.Typhi)中存在一个新的snRNA,命名为T64。本文将对T64 snRNA的表达进行验证,并应用S.Typhi全基因组DNA芯片[5]和实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术,分析其对S.Typhi基因表达的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 S.Typhi野生株GIFU10007由日本岐阜大学医学院微生物系馈赠;E.coli TOP-10、E.coli DH5α由本实验室保存;snRNA高表达所用质粒pBAD/Myc-His A为Promega公司产品。
1.1.2 主要材料与试剂 NcoⅠ和Hin dⅢ限制性内切酶、T4DNA连接酶、DNA酶Ⅰ、r Taq酶、Ex Taq DNA聚合酶、TA克隆试剂盒均购自大连TaKaRa公司;质粒提取试剂盒购自Axygen公司;总RNA提取试剂盒、cDNA纯化试剂盒购自Qiagen公司;反转录试剂盒购自Invitrogen公司;荧光标记染料Cy3/Cy5-dCTP购自Amersham公司;qRT-PCR 96孔板购自Bio-Rad公司;S.Typhi基因组芯片为本实验室自制[9]。
1.1.3 主要仪器 PCR扩增仪(ABI公司);凝胶成像分析系统(Syngene公司);ND-100核酸检测仪(NanoDrop公司);CFX96TM实时荧光定量系统(Bio-Rad公司);Gene PulseroⅡ电转化仪(Bio-Rad公司);Genepix personal 4100A基因芯片扫描仪(Axon公司)。
1.2 方法
1.2.1 PCR引物设计 使用Oligo 6.0软件设计引物,根据转录组分析和生物信息学分析得到snRNA T64的上下游序列,分别设计带有NcoⅠ和Hin dⅢ酶切位点的特异性引物64FP/64RP。根据S.Typhi基因组序列,分别设计lctD、invF、sopE和rbsB基因的特异性引物,用于qRT-PCR。引物均由上海生工生物工程有限公司合成,序列详见表1。

表1 引物的序列及用途
1.2.2 RT-PCR验证T64表达 选取LB平板培养的S.Typhi野生株,溶于双蒸水后煮沸10 min,12 000 r/min离心10 min,取上清作为细菌基因组的DNA模板,作为PCR对照。提取野生株总RNA,利用snRNA T64特异性引物PB反转录合成cDNA。接着以特异性引物T64 PA/T64 PB作为PCR引物,分别以水,总RNA,基因组DNA,cDNA为模板进行PCR扩增,将得到的产物进行凝胶电泳。
1.2.3 S.Typhi T64高表达株构建 以S.Typhi野生株基因组DNA为模板,用64FA/64FB引物进行PCR扩增,得到带有NcoⅠ和Hin dⅢ双酶切位点的产物片段。用NcoⅠ和Hin dⅢ对扩增产物片段和质粒pBAD/Myc-His A进行双酶切,然后用T4连接酶将片段和质粒连接,并导入E.coli DH5α。用Axygen试剂盒提取质粒,作酶切和PCR初步验证,最后经上海生工生物工程有限公司基因测序确证T64高表达株制备成功。同样用pBAD空质粒导入野生株作为对照。
1.2.4 总RNA提取 取T64高表达株和空载体对照株的单菌落各1个,分别接种于2 mL LB培养液中,37℃,250 r/min培养18 h;再取300μL过夜菌液转接入30 mL LB培养液(1∶100),以相同条件培养至对数生长期[D(600 nm)=0.4];每管中加入L-阿拉伯糖(终质量浓度为0.5 mg/mL),继续培养30 min,诱导T64表达;4℃,10 000 r/mm,离心2 min收集菌体;提取两株细菌总RNA,加DNA酶Ⅰ于37℃孵育30 min,以去除残留基因组DNA;再于80℃孵育3 min以灭活DNA酶Ⅰ;最后用核酸检测仪测RNA的浓度以及D(260 nm)/D(230 nm)比值。取3~5μg样品,进行琼脂糖凝胶电泳,检测RNA质量和基因组DNA残留情况[9]。
1.2.5 RNA反转录及基因组芯片分析 RNA反转录及基因组芯片分析方法参考文献[9]进行,各取高表达株和空载体对照株RNA 30μg进行反转录,并用Cy3/Cy5配对互标cDNA;纯化标记好的cDNA,于42℃与S.Typhi基因组芯片杂交12 h;基因芯片扫描仪扫描后,通过软件GenePix Pro 6.0将荧光信号数据化和标准化,最后用Excel进行比对分析。
高表达株的基因表达荧光信号值/对照株的基因表达荧光信号值,取log2表示这两株中基因表达差异的程度。log2为正值,表示基因表达在高表达株中上调;反之,负值则为下调。以数据log2绝对值≥1为筛选阈值。
1.2.6 qRT-PCR分析 细菌RNA提取方法同上,取总RNA 4μg,各基因的特异性下游引物进行反转录,再用基因上下游特异性引物进行qRT-PCR[9]。实验重复3次,每次各做3个平行。
1.3 统计分析
数据分析采用SPSS 11.0统计软件。两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 S.Typhi snRNA T64表达验证
见图1,第4泳道扩增产物长度为155 bp,与设计的T64特异性片段长度一致,且与第3泳道结果一致;第1、2泳道无特异片段产物。结果提示,S.Typhi确实有snRNA T64的表达。
2.2 S.Typhi snRNA T64高表达株的制备
PCR扩增得到带有NcoⅠ和Hin dⅢ双酶切位点的产物片段P1,长度为150 bp。酶切和PCR初步验证显示,在疑似阳性质粒中有目的酶切片段。最后经测序分析证实,重组质粒制备成功。将重组质粒导入S.Typhi野生株,获得snRNA T64高表达株。见图2。
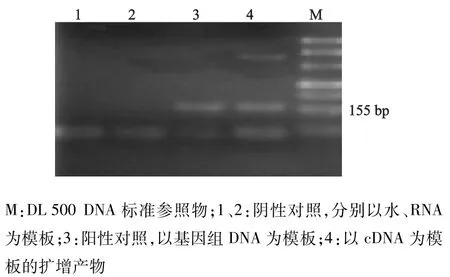
图1 RT-PCR验证S.Typhi snRNA T64表达
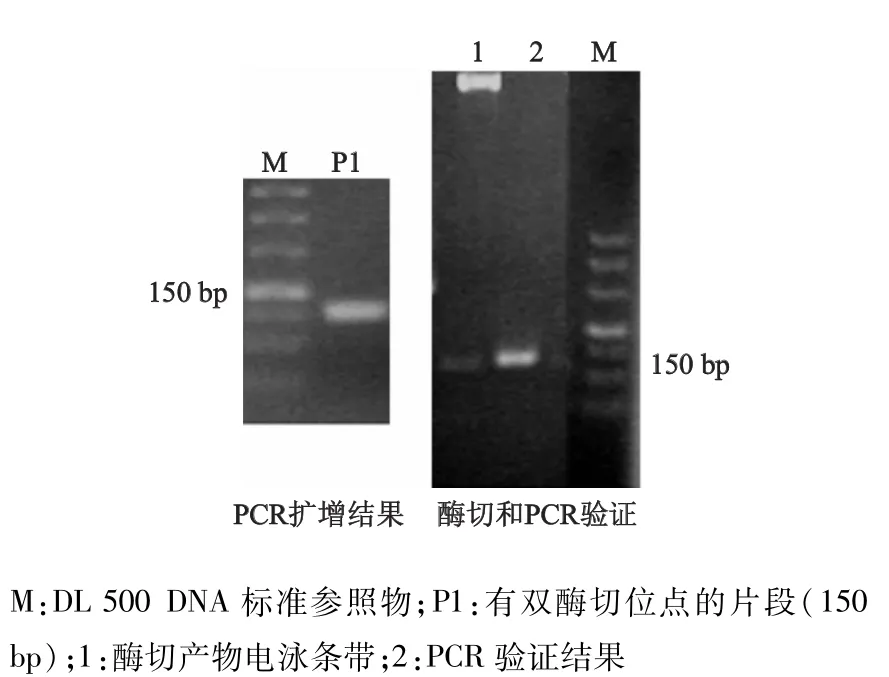
图2 S.Typhi snRNA T64高表达株的制备结果
2.3 S.Typhi snRNA T64高表达株和pBAD/Myc-His A对照株基因表达谱差异
结果显示,与空载体对照株相比,snRNA T64高表达株有20个基因表达上调,7个基因表达下调。具体基因功能及表达变化见表2。
2.4 qRT-PCR验证基因表达差异
挑选芯片分析有表达差异的4个基因进行qRT-PCR验证。结果显示,高表达T64后,invF、sopE和rbsB基因表达均明显上调,lctD基因表达明显下调,提示qRT-PCR分析结果与芯片分析获得的结果基本一致。见图3。
3 讨论
随着RNA测序技术的发展和应用,越来越多的细菌snRNA被发现,其相应的功能研究也已成为热点。在我们的前期工作中,通过转录组和生物信息学分析,在S.Typhi发现了一个新的snRNA,命名为T64。本研究采用RT-PCR的方法第1次初步证实了其在S.Typhi中存在表达。我们通过构建高表达株和空载体对照株,利用本实验室建立的基因芯片平台,观察snRNA T64高表达后对细菌整体基因表达的影响。结果显示,27个基因表达有明显变化,其中,20个基因表达上调,7个下调。采取qRTPCR对其中4个基因进行验证,验证结果与基因芯片结果基本相一致。
基因芯片分析结果显示,表达差异的基因集中在与细菌毒力和代谢相关的基因,例如invF,一个重要的沙门菌致病岛Ⅰ的毒力调节基因[10-12],对sip家族基因的表达具有促进作用[13]。此外,还观察到sipC基因表达上调,提示snRNA T64可能通过调控invF来参与细菌其他毒力基因的调节。另外,一些核糖体蛋白基因及酶基因的表达下调提示该snRNA T64在对数期参与S.Typhi的生长和代谢相关基因的调控。S.Typhi snRNAT64对invF和另外基因具体的作用机制目前尚不清楚,还需要深入研究。
总之,本研究进一步验证了S.Typhi存在snRNA T64表达;对其可能发生作用的靶基因进行初步筛选,发现snRNA T64可能参与调节invF和其他基因的表达,在S.Typhi致病基因的表达调节中发挥重要作用。
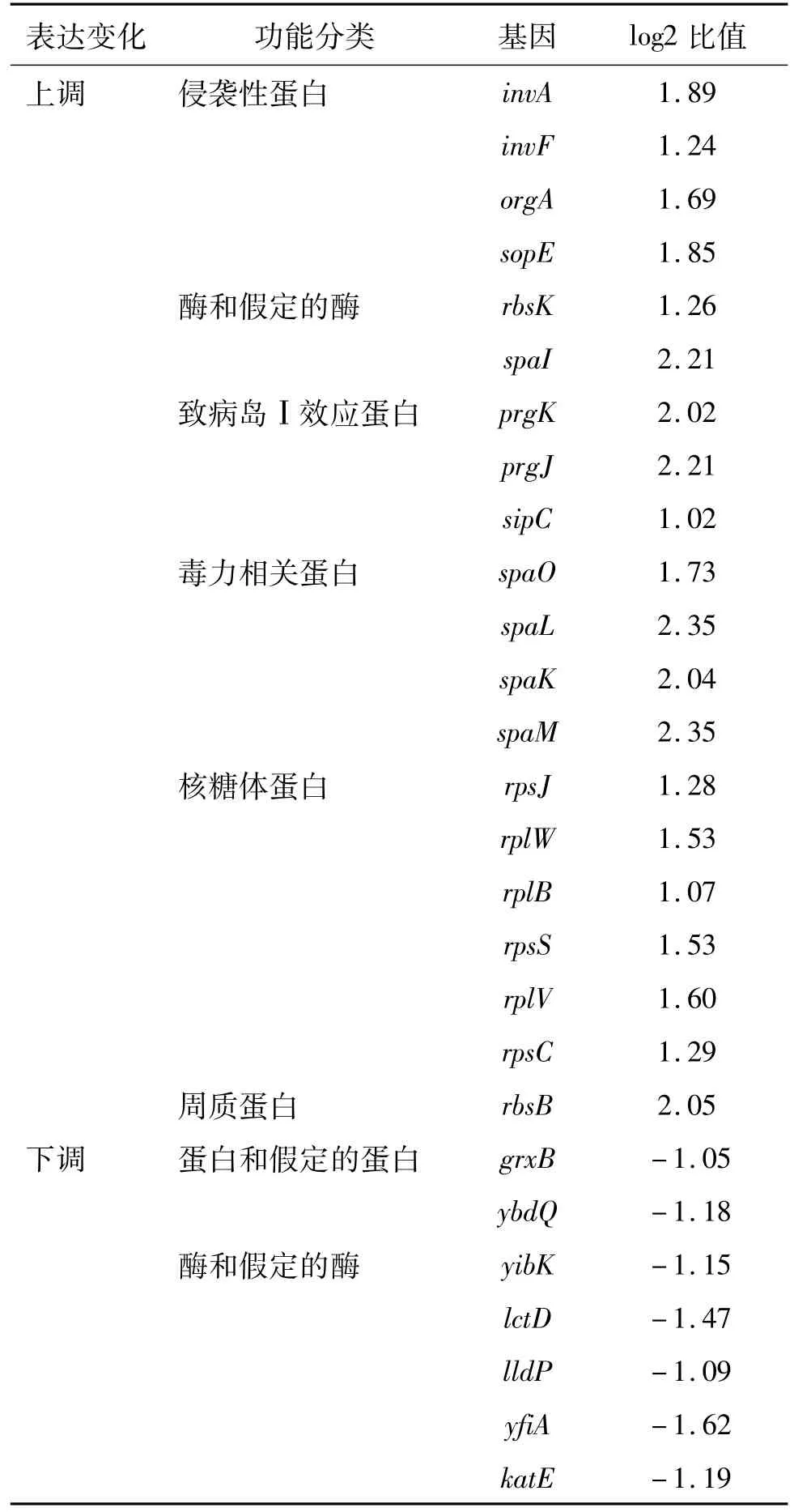
表2 基因芯片分析snRNA T64高表达株与对照株基因表达差异结果
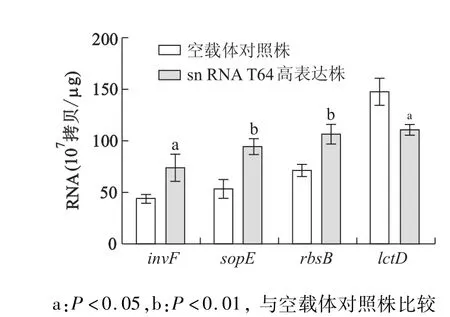
图3 qRT-PCR验证基因芯片分株结果
[1]Vogel J,Sharma CM.How to find small non-coding RNAs in bacteria[J].Biol Chem,2005,386(12):1219-1238.
[2]Sharma CM,Vogel J.Experimental approaches for the discovery and characterization of regulatory small RNA[J].Curr Opin in Microbiol,2009,12(5):536-546.
[3]Gottesman S.The small RNA regulators of Escherichia coli:roles and mechanisms[J].Annu Rev Microbiol,2004,58:303-328.
[4]Wassarman KM.Small RNAs in bacteria:diverse regulators of gene expression in response to environmental changes[J].Cell,2002,109(2):141-144.
[5]Guillier M,Gottesman S.Remodelling of the Escherichia coli outer membrane by two small regulatory RNAs[J].Mol Microbiol,2006,59(1):231-247.
[6]Argaman L,Hershberg R,Vogel J.Novel small RNA-encoding genes in the intergenic regions of Escherichia coli[J].Current Biology,2001,11(12):941-950.
[7]Lenz DH,Mok KC,Lilley BN,et al.The small RNA chaperone Hfq and multiple small RNAs control quorum sensing in Vibrio harveyi and Vibrio cholerae[J].Cell,2004,118(1):69-82.
[8]Vogel J.A rough guide to the non-coding RNA world of Salmonella[J].Mol Microbiol,2009,71(1):1-11.
[9]Storz G,Opdyke JA,Zhang A.ControllingmRNA stability and translation with small non-coding RNAs[J].Curr Opin Microbiol,2004,7(2):140-144.
[10]生秀梅,黄新祥,茅凌翔,等.伤寒沙门菌基因组DNA芯片的制备与基因表达谱分析应用[J].生物化学与生物物理进展,2009,36(2):206-212.
[11]Darwin KH,Miller VL.Molecular basis of the interaction of Salmonella with the intestinal mucosa[J].Clin Microbiol Rev,1999,12(3):405-428.
[12]Daly RA,Lostroh CP.Genetic analysis of the Salmonella transcription factor HilA[J].Can JMicrobiol,2008, 54(10):854-860.
[13]Darwin KH,Miller VL.TypeⅢsecretion chaperone-dependent regulation:activation of virulence genes by SicA and InvF in Salmonella typhimurium[J].EMBO J,2001,20(8):1850-1862.
Influence of snRNA T64 on gene expression in Salmonella enterica serovar Typhi
WANG Zhe-xin,JIYing,ZHAO Xin,XU Shun-gao,HUANG Xin-xiang
(School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To identify the expression of samll non-coding RNA(snRNA)T64 detected by transcriptome sequencing in Salmonella enterica serovar Typhi(S.Typhi)and explore its functions preliminarily.M ethods:The native expression of snRNA T64 in S.Typhi was confirmed by reverse transcription PCR(RT-PCR)and PCR with specific primers.Overexpression strain of snRNA was constructed by transforming a recombinant plasmid containing sequence of snRNA T64 to the wild type strain of S.Typhi.Microarray was used to analyse the gene expression difference between overexpression strain and control strain in logarithmic growth phase.Some microarray results were confirmed by quantitative real-time PCR(qRTPCR).Results:The expression of snRNA T64 was confirmed by the RT-PCR.The results ofmicroarray assay revealed that there were 20 genes expression upregulated in the overexpression strain of snRNA T64,while 7 genes expression downregulated,compared with the control strain in logarithmic growth phase.qRTPCR results of expressions of4 selected genesmatched themicroarray results.Conclusion:There were expression of snRNA T64 in S.Typhi,which might play important roles in gene expression regulation.
Salmonella enterica serovar Typhi;small non-coding RNA;microarray assay;quantitative real-time PCR;gene expression regulation
R516.3
A
1671-7783(2014)04-0298-04
10.13312/j.issn.1671-7783.y140092
王哲鑫(1986—),男,硕士研究生;黄新祥(通讯作者),教授,博士生导师,E-mail:huxinx@yahoo.com.hk
2014-04-08 [编辑]刘星星
