基质细胞衍生因子-1α对间充质干细胞迁移的影响
2014-08-07谢桂琴徐晓静张焕相
谢桂琴,徐晓静,张焕相
(苏州大学基础医学与生物科学学院细胞生物学系,江苏苏州215123)
基质细胞衍生因子-1α对间充质干细胞迁移的影响
谢桂琴,徐晓静,张焕相
(苏州大学基础医学与生物科学学院细胞生物学系,江苏苏州215123)
目的:研究基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)对间充质干细胞(mesenchymal stem cells,MSCs)迁移的影响及可能的机制。方法:采用全骨髓法体外分离培养并扩增大鼠骨髓来源的MSCs,应用Boyden趋化小室实验观察不同质量浓度(0,5,25,50和100 ng/mL)的SDF-1α对MSCs定向迁移的影响,通过蛋白质印迹法和Boyden趋化小室实验观察细胞内PI3K/Akt和MAPKs信号通路在MSCs向SDF-1α迁移过程中的变化。结果:不同质量浓度的SDF-1α通过调节PI3K/Akt和MAPKs信号通路,不同程度上影响MSCs的趋化性迁移,低质量浓度的SDF-1α促进细胞迁移,而高质量浓度对细胞迁移起到抑制作用;阻断MSCs中基底水平PI3K/Akt和MAPKs信号通路在不同程度上抑制了MSCs趋向SDF-1α迁移作用。结论:MSCs向SDF-1α迁移能力随着PI3K/Akt信号的强弱而增减;JNK/SAPK信号的减弱显著抑制了SDF-1α诱导的MSCs定向迁移;SDF-1α可以促进细胞内ERK1/2和p38MAPK两条信号通路,而ERK1/2和p38MAPK信号对SDF-1α促进的细胞迁移影响并不显著。
间充质干细胞;基质细胞衍生因子-1α;细胞迁移;PI3K/Akt和MAPKs信号通路
间充质干细胞(mesenchymal stem cells,MSCs)因来源广泛,体外培养增殖快,生长稳定,无免疫排斥及多向分化潜能,在细胞治疗及组织工程学中成为了一种颇具前景的种子细胞[1-2],广泛应用于临床治疗。在细胞介导的治疗中,需诱导足够数量的自体或外源移植的MSCs到所需部位[3],要求这些细胞能够正常生存及更新,并可迁移至特定部位。大量研究发现移植的MSCs对于机体的病灶部位会产生明显的趋化迁移效应,该趋化性迁移是由受损部位所分泌的如肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)等生长因子及炎症信号分子所诱导引起的[4-5]。
基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)是由骨髓基质细胞及其他相关的间质细胞和上皮细胞分泌的一种趋化蛋白,可以诱导多种类型细胞迁移[6-8]。CXC族趋化因子受体-4(CXCR4)是目前已知SDF-1α的唯一受体,SDF-1α的趋化作用由其受体CXCR4介导,两者结合并通过相互作用启动下游信号通路。PI3K/Akt和MAPKs信号通路参与调节细胞增殖、分化、凋亡、迁移等多种细胞行为,尤其在趋化因子诱导的细胞定向迁移中起着至关重要的作用[9-11]。大量研究表明,抑制PI3K/Akt或MAPKs信号通路影响多种类型细胞迁移[12-13]。在本实验中,我们主要利用Boyden趋化小室实验和蛋白质印迹技术观察PI3K/Akt和MAPKs信号通路对SDF-1α诱导的MSCs定向迁移的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 100~150 g Sprague Dawley(SD)大鼠,由苏州大学实验动物中心提供。动物实验依照《中华人民共和国实验动物管理条例》和《苏州大学实验动物管理办法》实施。
1.1.2 主要试剂 L-DMEM培养基(Gibco公司)、胎牛血清(Gibco公司)、胰蛋白酶(Sigma公司)、EDTA(Bio Basic公司)、SDF-1α(PeproTech公司)。羊抗兔p-Akt(Ser473)、Akt、p-JNK/SAPK(Thr183/Tyr185)、JNK/SAPK、p-ERK1/2(Thr202/Tyr204)、ERK1/2、p-p38MAPK(Thr180/Tyr182)、p38MAPK抗体(Santa Cruz公司),羊抗鼠β-肌动蛋白(Cell Signaling Technology公司),HRP-山羊抗兔、山羊抗鼠二抗(PTGLAB公司)。
1.2 方法
1.2.1 MSCs的分离与培养
SD大鼠乙醚麻醉后颈椎脱臼法处死,75%乙醇浸泡消毒5 min,取出股骨、胫骨,放置在预冷的75%乙醇中。移入超净台在无菌环境中操作,剔除肌肉组织,剪断股骨、胫骨两端,用2mL注射器吸取含10%胎牛血清的L-DMEM完全培养基,吹打骨髓腔至发白,细胞悬液吹打均匀,计数,细胞以2× 106/mL的密度接种于60mm培养皿中,置于37℃、饱和湿度、5%CO2的细胞培养箱中培养。24 h后细胞第1次换液,之后每3 d换液。2周左右,细胞汇合度达80%~90%,吸出培养皿中的培养基,加入2 mL PBS以清洗死细胞及残留培养基。加入1 mL预热的0.25%的胰酶消化,显微镜下观察细胞回缩成圆形时,弃去胰酶。加入2 mL完全培养基终止消化,利用移液枪轻柔吹打皿底,使所有细胞完全悬浮,按1∶2比例传代接种细胞。实验所用的MSCs均是第3-10代细胞。
1.2.2 Boyden趋化小室实验 待MSCs汇合度达到80%时,用无血清的L-DMEM预处理细胞,30 min后弃去处理液,0.25%胰酶消化,收集细胞并计数,调整细胞密度为8×105/mL待用。Boyden小室装置的下室每孔加入30μL不同质量浓度的SDF-1α(0,5,25,50和100 ng/mL),每组9个重复,用不含聚乙烯吡咯的聚碳酸酯膜(左上角剪一缺口)盖住下室48孔,分别盖上软塑片和硬塑片,拧紧螺帽。上室每孔加入L-DMEM悬液的MSCs 50μL(含4× 104个细胞/室)。将Boyden小室置于一洁净的湿盒中,37℃细胞培养箱内静置4 h。取出小室,松开螺帽,取出膜。夹子夹住膜的两端,刀片刮去上室膜面细胞,于PBS中轻洗。将下室膜面细胞置于4%低聚甲醛中固定30min,再置于5%结晶紫中染色10min,自来水漂洗,倒置相差显微镜拍照。各实验组随机抽取4~6个视野,使用Image J软件计数通过微孔迁移至膜下方的细胞。每组实验重复3次。
研究PI3K/Akt、MAPKs信号通路对MSCs向SDF-1α迁移影响的实验中,分别采用特异性小分子化学抑制剂30μmol/L的LY294002、50μmol/L的PD98059、30μmol/L的SB203580、10μmol/L的SP600125预处理细胞,L-DMEM预处理作为对照组,30 min后消化收集细胞。Boyden小室装置的下室加入25 ng/mL SDF-1α30μL,上、下室分别含有相对应的L-DMEM或抑制剂进行细胞迁移检测。
1.2.3 蛋白质免疫印迹 待MSCs汇合度达到80%左右,用无血清的L-DMEM预处理细胞30 min,弃去培养基,分别加入不同质量浓度的SDF-1α(0,5,25,50和100 ng/mL)30 min或加入25 ng/mL SDF-1α不同时间(0,5,15,30和60 min)后,用预冷的PBS清洗1遍,将细胞置于冰上,向培养皿中加入200μL含磷酸酶和蛋白酶抑制剂的细胞裂解液,用细胞刮将贴壁细胞刮下,2 mL注射器反复抽吸,直至黏稠液体变得清亮。12 000×g,4℃离心10 min。取上清,记录上清体积。利用BCA试剂盒测定蛋白的浓度。向上清液中按比例加入4×上样缓冲液,95℃煮10 min,冰上快速冷却,分装每管20 μL,-20℃保存。用SDS-PAGE 80 V恒压电泳,半干法恒流转膜。取出NC膜,5%脱脂奶粉室温封闭1 h,室温孵育一抗1.5 h或4℃过夜,室温孵育二抗1 h。ECL反应,检测MSCs中Akt、JNK/SAPK、ERK1/2及p38MAPK蛋白的磷酸化变化情况。
1.3 统计学处理
采用SPSS 16.0统计学软件对实验数据进行统计处理,计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MSCs的形态特征
体外培养的间充质干细胞,待细胞汇合度达到80%~90%,倒置显微镜下呈现两种不同的形态:长梭形和纤维样(图1)。实验室前期检验证明该种方法分离、培养的MSCs,表达间充质干细胞表面标志CD29、CD90和CD106,而造血干细胞表面标志CD34和CD45并不表达。

图1 MSCs的形态
2.2 不同质量浓度的SDF-1α对MSCs迁移的影响
如图2A和图2B所示,不同质量浓度的SDF-1α对MSCs迁移的影响不同。低质量浓度的SDF-1α促进MSCs定向迁移,而高质量浓度的SDF-1α抑制了细胞迁移,25 ng/mL的SDF-1α诱导了最大的迁移数量。我们在上下室均加入(机动组)或不加入(对照组)25 ng/mL SDF-1α,发现两组细胞迁移数目无明显差异,均明显低于仅下室加25 ng/mL SDF-1α的趋化组,这表明SDF-1α诱导的MSCs迁移是通过化学趋化性而非化学机动性引起的(图2C)。
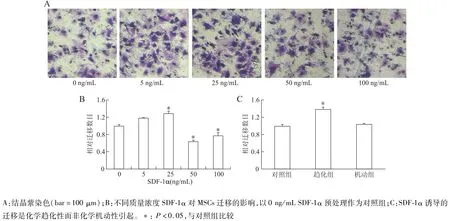
图2 不同质量浓度的SDF-1α对MSCs迁移的影响
2.3 SDF-1α调节MSCs中PI3K/Akt和MAPKs信号通路
采用蛋白质印迹法检测经不同浓度SDF-1α刺激的MSCs中Akt、ERK1/2、JNK/SAPK和p38MAPK磷酸化水平,结果表明,SDF-1α诱导的PI3K/Akt和MAPKs磷酸化呈现浓度依赖性效应。见图3。5 ng/mL SDF-1α作用MSCs后,细胞中Akt、ERK1/2及p38MAPK磷酸化水平略有升高,25 ng/mL SDF-1α明显地促进了细胞中这3种蛋白的磷酸化(P均<0.05)。而不同质量浓度SDF-1α作用导致MSCs中SAPK/JNK磷酸化水平下降,但差异无统计学意义。
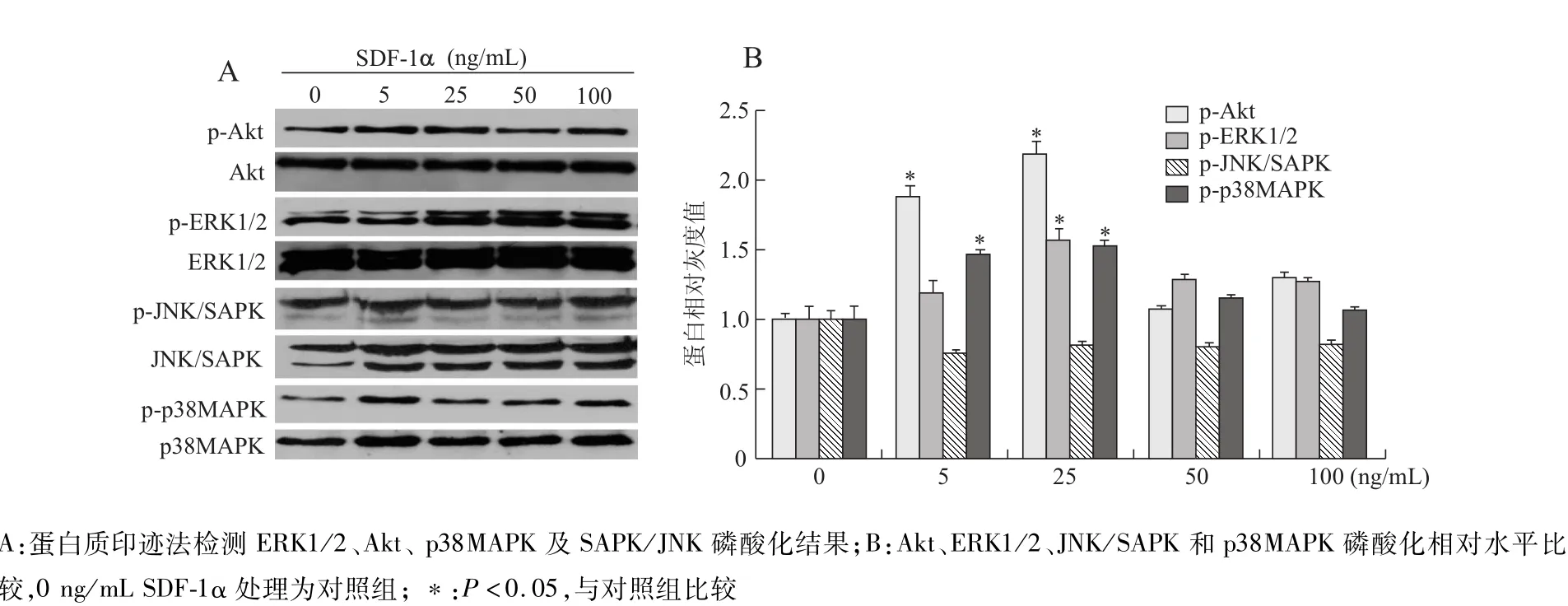
图3 不同质量浓度的SDF-1α调节MSCs中MAPKs和PI3K/Ak t的磷酸化
选用25 ng/mL SDF-1α处理MSCs不同时间(0,5,15,30及60 min),蛋白质印迹检测细胞中Akt、ERK1/2、JNK/SAPK和p38MAPK磷酸化水平变化。结果表明,MSCs中磷酸化的Akt、ERK1/2、JNK/SAPK及p38MAPK均有一个基底水平的表达。SDF-1α处理MSCs后,细胞中p-Akt水平5 min开始显著升高,一直持续到60 min;p-ERK1/2水平5 min显著升高,15 min时达到峰值,30 min后恢复到基底状态;p-p38MAPK水平先上升后下降,然后再次升高,整个过程中该蛋白的磷酸化水平均高于基底水平;而p-JNK/SAPK水平并没有发生显著性变化。见图4。
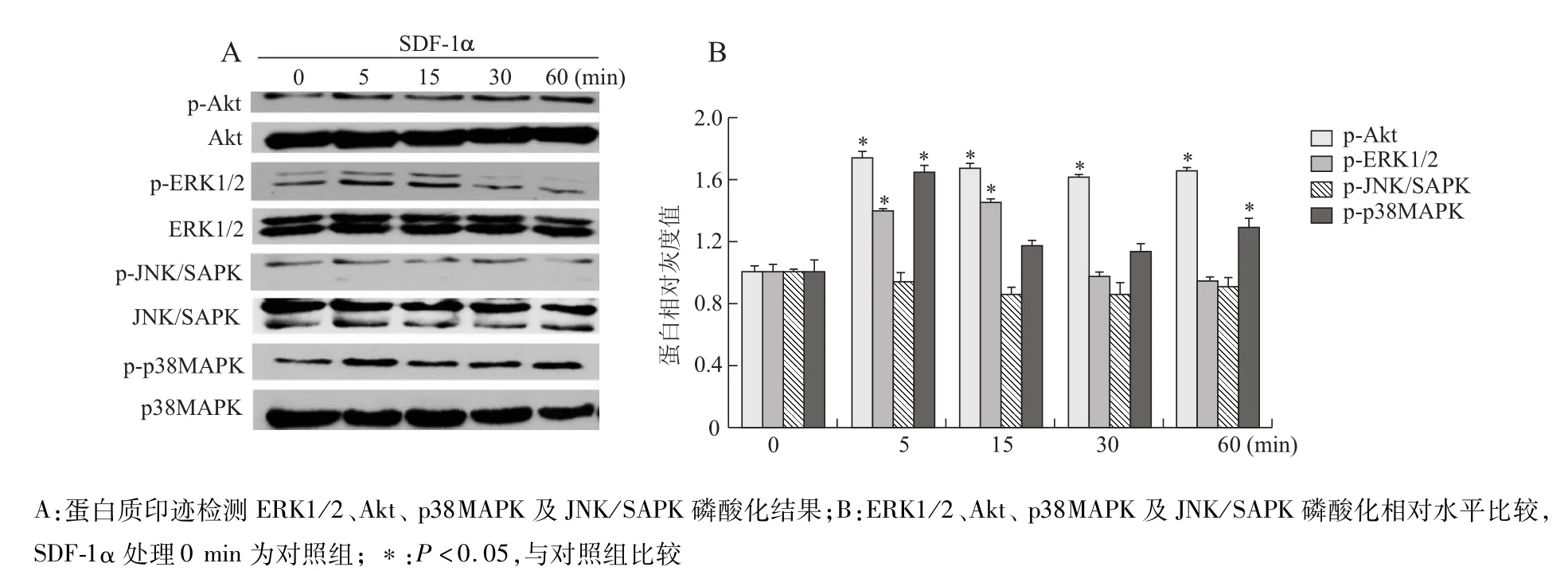
图4 25 ng/m L SDF-1α刺激MSCs不同时间MAPKs和PI3K/Akt的磷酸化
2.4 抑制PI3K/Akt或MAPKs信号通路影响SDF-1α促进的MSCs迁移
抑制剂LY294002、PD98059、SP600125和SB203580预处理MSCs30 min后,应用Boyden趋化小室实验检测细胞向25 ng/mL SDF-1α迁移的变化。结果表明,抑制PI3K/Akt和MAPKs信号通路均在不同程度上减弱了MSCs向SDF-1α迁移。见图5。
3 讨论
大量研究表明MSCs可以迁移至受损、炎症及肿瘤部位[14-16],从而治疗炎症并且减弱肝、肾脏及心肌的损伤。目前认为MSCs保护损伤组织的机制并非是细胞迁移至受损部位通过分化为损伤区域的细胞进行组织修复[17-18],而主要是通过旁分泌机制,特别是细胞因子对MSCs的趋化效应进行修复的[19-21]。SDF-1α蛋白作为一种分泌蛋白通过与细胞表面受体CXCR4结合,激活细胞内多条信号通路如PI3K/Akt和MAPKs通路,导致细胞内骨架相关蛋白的重排,进而影响细胞的定向迁移[22-23]。PI3K/Akt和MAPKs信号通路参与调节细胞增殖、分化、凋亡、迁移等多种细胞行为,尤其在趋化因子诱导的细胞定向迁移中起着至关重要的作用[9-11]。
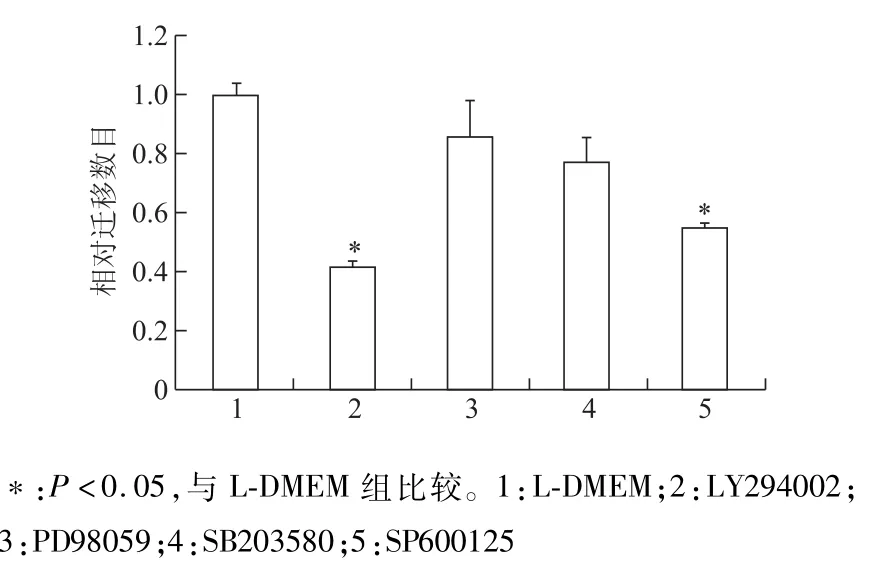
图5 抑制PI3K/Akt或MAPKs信号通路对SDF-1α促进MSCs迁移的影响
本实验以全骨髓法体外分离培养的MSCs为研究对象,观察了SDF-1α刺激下的细胞中PI3K/Akt和MAPKs信号通路变化情况以及抑制这些信号通路对MSCs趋向SDF-1α迁移的影响。我们发现不同质量浓度的SDF-1α在不同程度上影响MSCs的趋化性迁移,低浓度的SDF-1α促进细胞迁移,而高浓度对细胞迁移起到抑制作用。研究表明,生长因子对细胞迁移的调节具有二重性作用,低浓度利于细胞迁移,而高浓度的因子不利于细胞迁移[24-25]。梁光波等[25]在研究ECV304细胞向SDF-1α迁移的过程中发现高浓度的因子导致细胞内腱糖蛋白表达减弱,增强细胞黏连,进而抑制细胞迁移。早期研究显示[26-27],SDF-1α通过激活细胞内PI3K/Akt和MAPKs信号通路促进细胞迁移,我们的结果显示SDF-1α作用后,MSCs中Akt、ERK1/2及p38MAPKs磷酸化水平均显著升高,而JNK/SAPK磷酸化程度无明显变化。干扰PI3K/Akt或JNK/SAPK信号抑制了SDF-1α促进的MSCs迁移,而阻断ERK1/2和P38MAPK信号对细胞迁移并未产生显著性影响。我们的实验结果表明SDF-1α通过激活细胞内PI3K/Akt信号促进MSCs迁移,与此同时,基底水平的JNK/SAPK信号在MSCs向SDF-1α趋化性迁移中起着不可或缺的作用。
本研究主要集中于SDF-1α对MSCs迁移的影响,以及在这个过程中PI3K/Akt和MAPKs信号对这个过程的调节。结果表明,MSCs向SDF-1α迁移能力随着PI3K/Akt信号的强弱而增减;JNK/SAPK信号的减弱显著抑制了SDF-1α诱导的MSCs定向迁移;SDF-1α可以促进细胞内ERK1/2和p38MAPK两条信号通路,而ERK1/2和p38MAPK信号对SDF-1α促进的细胞迁移影响并不显著。本研究结果为进一步研究细胞迁移提供方向,同时也为临床应用MSCs治疗组织损伤、机体创伤等提供了理论依据。
[1]Black IB,Woodbury D.Adult rat and human bonemarrow stromal stem cells differentiate into neurons[J].Blood Cells Mol Dis,2001,27(3):632-636.
[2]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].JNeurosci Res,2000,61(4):364-370.
[3]Harting MT,Jimenez F,Xue H,et al.Intravenous mesenchymal stem cell therapy for traumatic brain injury[J].JNeurosurg,2009,110(6):1189-1197.
[4]Forte G,MinieriM,Cossa P,et al.Hepatocyte growth factor effects on mesenchymal stem cells:proliferation,migration,and differentiation[J].Stem Cells,2006,24(1):23-33.
[5]Sordi V,Malosio ML,Marchesi F,et al.Bonemarrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets[J].Blood,2005,106(2):419-427.
[6]Ghadge SK,Muhlstedt S,Ozcelik C,et al.SDF-1αas a therapeutic stem cell homing factor in myocardial infarction[J].Pharmacol Ther,2011,129(1):97-108.
[7]Imitola J,Raddassi K,Park KI,et al.Directed migration of neural stem cells to sites of CNS injury by the stromal cell-derived factor 1α/CXC chemokine receptor 4 pathway[J].Proc Natl Acad Sci U S A,2004,101(52):18117-18122.
[8]Vandervelde S,van Luyn MJ,Tio RA,et al.Signaling factors in stem cell-mediated repair of infarcted myocardium[J].JMol Cell Cardiol,2005,39(2):363-376.
[9]Veit C,Genze F,Menke A,et al.Activation of phosphatidylinositol 3-kinase and extracellular signal-regulated kinase is required for glial cell line-derived neurotrophic factor-induced migration and invasion of pancreatic carcinoma cells[J].Cancer Res,2004,64(15):5291-5300.
[10]Wang JF,Park IW,Groopman JE.Stromal cell-derived factor-1αstimulates tyrosine phosphorylation ofmultiple focal adhesion proteins and inducesmigration of hematopoietic progenitor cells:roles of phosphoinositide-3 kinase and protein kinase C[J].Blood,2000,95(8):2505-2513.
[11]Segarra J,Balenci L,Drenth T,etal.Combined signaling through ERK,PI3K/AKT,and RAC1/p38 is required formet-triggered cortical neuron migration[J].J Biol Chem,2006,281(8):4771-4778.
[12]Liu ZL,Mao JH,Peng AF,et al.Inhibition of fatty acid synthase suppresses osteosarcoma cell invasion and migration via downregulation of the PI3K/Akt signaling pathway in vitro[J].Mol Med Rep,2013,7(2):608-612.
[13]Bullone M,Moran K,Lavoie-Lamoureux A,etal.PI3K and MAPKs regulate neutrophilmigration toward the airways in heaves[J].JVet Intern Med,2013,27(1):164-170.
[14]Ji JF,He BP,Dheen ST,et al.Interactions of chemokines and chemokine receptorsmediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossalnerve injury[J].Stem Cells,2004,22(3):415-427.
[15]Coffelt SB,Marini FC,Watson K,et al.The pro-inflammatory peptide LL-37 promotes ovarian tumor progression through recruitment ofmultipotentmesenchymal stromal cells[J].Proc Natl Acad SciU SA,2009,106(10):3806-3811.
[16]Spaeth E,Klopp A,Dembinski J,et al.Inflammation and tumor microenvironments:defining the migratory itinerary of mesenchymal stem cells[J].Gene Ther,2008,15(10):730-738.
[17]Alexanian AR,Maiman DJ,Kurpad SN,et al.In vitro and in vivo characterization of neurally modified mesenchymal stem cells induced by epigenetic modifiers and neural stem cell environment[J].Stem Cells Dev,2008,17(6):1123-1130.
[18]Croitoru-Lamoury J,Williams KR,Lamoury FM,et al.Neural transplantation of human MSC and NT2 cells in the twitcher mouse model[J].Cytotherapy,2006,8(5):445-458.
[19]di Bonzo LV,Ferrero I,Cravanzola C,et al.Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine:engraftment and hepatocyte differentiation versus profibrogenic potential[J].Gut,2008,57(2):223-231.
[20]Psaltis PJ,Zannettino AC,Worthley SG,etal.Concise review:mesenchymal stromal cells:potential for cardiovascular repair[J].Stem Cells,2008,26(9):2201-2210.
[21]van Poll D,Parekkadan B,Cho CH,et al.Mesenchymal stem cell-derived molecules directlymodulate hepatocellular death and regeneration in vitro and in vivo[J].Hepatology,2008,47(5):1634-1643.
[22]Zheng H,Dai T,Zhou B,et al.SDF-1α/CXCR4 decreases endothelial progenitor cells apoptosis under serum deprivation by PI3K/Akt/eNOSpathway[J].Atherosclerosis,2008,201(1):36-42.
[23]Liu N,Tian J,Cheng J,et al.Migration of CXCR4 gene-modified bone marrow-derived mesenchymal stem cells to the acute injured kidney[J].JCell Biochem,2013,114(12):2677-2689.
[24]Chen Y,Wei Y,Liu J,et al.Chemotactic responses of neural stem cells to SDF-1αcorrelate closely with their differentiation status[J].JMol Neurosci,2014.[Epub ahead of print]
[25]梁光波,张国平,金惠铭.碱性成纤维细胞成长因子对ECV304细胞迁移的影响[J].中国病理生理杂志,2005,21(1):16-20.
[26]Yin Q,Jin P,Liu X,et al.SDF-1αinhibits hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells through PI3K/Akt and ERK1/2 signaling pathways[J].Mol Biol Rep,2011,38(1):9-16.
[27]Pan F,Ma S,Cao W,et al.SDF-1αupregulation of MMP-2 ismediated by p38 MAPK signaling in pancreatic cancer cell lines[J].Mol Biol Rep,2013,40(7):4139-4146.
Effect of SDF-1αon them igration ofmesenchymal stem cells
XIE Gui-qin,XU Xiao-jing,ZHANG Huan-xiang
(Department of Cell Biology,Basic Medical and Biological College of Soochow University,Suzhou Jiangsu 215123,China)
Objective:To investigate the effect of stromal cell-derived factor-1α(SDF-1α)on themigration ofmesenchymal stem cells(MSCs)and themechanism involved in cellmigration.M ethods:MSCs were isolated from rat bonemarrow in vitro.Boyden chamber was used to study the behavior of cellmigration toward SDF-1αat different concentrations(0,5,25,50,and 100 ng/mL).Then,we detected the phosphorylation of PI3K/Akt and MAPKs by addition of SDF-1αby Western blot.Finally,pretreatment with specific chemical inhibitors to block PI3K/Akt or MAPKs signaling,we analyzed the influence of these signaling on SDF-1α-induced cellmigration by Boyden chamber.Results:SDF-1αat different concentrations influenced MSCsmigration by the regulation of PI3K/Akt and MAPKs signaling,and low concentrations of SDF-1αwere positive related to cellmigration,while high concentrations played converse effect.Interference with basal PI3K/Akt or MAPKs signaling decreased SDF-1α-induced MSCsmigration to a variable extent.Conclusion:SDF-1α-induced MSCs migration was positively regulated to the changing of PI3K/Akt signaling.Meanwhile,blocking JNK/SAPK signaling significantly decreased SDF-1α-induced directed migration of MSCs.Treatment with SDF-1αcould promote ERK1/2 and p38MAPK signaling pathways in MSCs,yet interference with the two signaling had no significant inhibition of cellmigration.
mesenchymal stem cells;SDF-1α;cellmigration;PI3K/Akt and MAPKs signaling
R393
A
1671-7783(2014)04-0277-06
10.13312/j.issn.1671-7783.y140164
国家自然科学基金资助项目(31371407,31071220);苏州市科技计划项目(SYS201203)
谢桂琴(1989—),女,硕士研究生;张焕相(通讯作者),教授,博士生导师,E-mail:hzhang@suda.edu.cn
2014-06-03 [编辑]何承志
