脐带间质干细胞来源的外切体对顺铂诱导的人肾小管上皮细胞损伤的修复作用
2014-08-07蒋留留贾浩源祝源尹磊李里明叶惠慧薛建国许文荣钱晖
蒋留留,贾浩源,祝源,尹磊,李里明,叶惠慧,薛建国,许文荣,钱晖
(江苏大学医学院,江苏镇江212013)
脐带间质干细胞来源的外切体对顺铂诱导的人肾小管上皮细胞损伤的修复作用
蒋留留,贾浩源,祝源,尹磊,李里明,叶惠慧,薛建国,许文荣,钱晖
(江苏大学医学院,江苏镇江212013)
目的:研究人脐带间质干细胞来源的外切体(hucMSC-Ex)对顺铂诱导的人肾小管上皮HK-2细胞损伤的修复作用,并探讨可能的作用机制。方法:体外建立顺铂诱导的HK-2细胞损伤模型,实验组以16μmol/L浓度的顺铂作用HK-2细胞16 h,再加入hucMSC-Ex共培养,同时选择人肺成纤维细胞的外切体(HFL1-Ex)为对照,8 h后采用蛋白质印迹法和FITC-Tunel技术检测hucMSC-Ex对损伤HK-2细胞的抗凋亡和促增殖情况。未经任何处理的HK-2细胞作为正常对照组,单纯顺铂损伤并加等量PBS为PBS对照组。结果:成功建立了顺铂诱导的HK-2细胞损伤体外模型,蛋白质印迹分析显示hucMSC-Ex处理改善了顺铂对HK-2细胞的损伤,凋亡蛋白Bax表达降低,抗凋亡蛋白Bcl-2表达相应升高。FITC-Tunel检测也显示HK-2细胞的凋亡明显减弱。而MTT分析显示hucMSC-Ex处理后,HK-2细胞的增殖能力显著增强。结论:HucMSC-Ex对顺铂诱导的HK-2细胞损伤有一定的修复效果,可能是通过促进HK-2细胞的增殖和抑制其凋亡来实现的。
外切体;顺铂;人肾小管上皮细胞;增殖;凋亡
外切体(exosome)是一种可由多种细胞分泌的直径40~100 nm的膜性小囊泡,是细胞与细胞,器官与器官之间信息传递的重要载体[1]。近年来间质干细胞(mesenchymal stem cells,MSC)分泌的外切体(MSC-Ex)成为组织再生修复的新研究热点[2]。多个研究证实MSC-Ex在肾[3]、心[4]、神经[5]、肺[6]等损伤中具有明确的修复作用。本课题组前期研究也揭示脐带MSC来源的外切体(hucMSC-Ex)可减缓CCL4诱导的小鼠肝纤维化并促进其肝功能恢复[7],对顺铂诱导的急性肾损伤大鼠模型也有明显的修复效果[8]。本研究在前期工作的基础上,构建顺铂诱导的人肾近曲小管上皮细胞HK-2损伤模型,探讨hucMSC-Ex对损伤肾小管上皮细胞的修复作用,并进一步探究其可能的作用机制。
1 材料与方法
1.1 材料
人近曲小管上皮细胞HK-2(美国菌种保存中心),人肺成纤维细胞HFL-1(中国科学院典藏培养物保藏委员会细胞库)。顺铂(中国德州制药有限公司),胎牛血清(美国Gibco公司),DMEM/F-12培养基(HyClone,美国Thermol Fisher公司);兔抗人Bax(美国Bioworld公司),兔抗人Bcl-2(美国Bioworld公司),抗GAPDH鼠单克隆抗体(北京康为世纪公司),Tunel-FITC试剂盒(美国Vazyme公司),DAPI(瑞士Roche公司)。倒置荧光显微镜(Ti-S,日本Nikon公司),高速冷冻离心机(德国Eppendorf公司),高内涵成像系统(美国Molecular Devices公司)。CO2培养箱(美国Thermo公司),超净工作台(苏州净化设备厂),全自动灭菌锅(日本Tomy公司),超低温冰箱(美国Forma公司),凝胶成像分析系统(ImageQuantLAS4000mini,美国GE公司),荧光酶标仪(FLX800TM,美国Bio-Tek公司)。
1.2 方法
1.2.1 外切体的分离鉴定 收集本实验室原代培养的人脐带间质干细胞的无血清培养上清,采用改进的超滤及梯度离心法分离并纯化培养上清中的外切体。以人肺成纤维细胞HFL-1为细胞对照,同样收集培养上清并分离外切体。分离的外切体经电镜表面标记分析鉴定[7-8]。
1.2.2 顺铂损伤HK-2细胞模型的构建及hucMSCEx处理 HK-2细胞在含10%胎牛血清的DMEM/F-12培养基37℃5%CO2培养箱中培养,每2天换液1次,消化传代后种于6孔培养板,每孔50 000个细胞。常规培养24 h后,进行实验分组。①正常对照组:未经任何处理的HK-2细胞;②顺铂+PBS组:16μmol/L顺铂作用HK-2细胞16 h,撤去药物加入20μL PBS(作为hucMSC-Ex同体积对照)再培养8 h;③顺铂+hucMSC-Ex组:16μmol/L顺铂处理16 h,撤去药物再加入hucMSC-Ex(100μg/mL,20μL)共培养8 h;④顺铂+HFL1-Ex组:顺铂处理16 h后,撤药加入HFL1-Ex(100μg/mL,20μL)8 h。
1.2.3 蛋白质印迹法检测Bax、Bcl-2蛋白 胰酶消化上述各组的HK-2细胞,离心收集后加入细胞组织裂解液充分裂解,然后加入1/4体积的5×SDS上样缓冲液于蛋白裂解上清液中,沸水煮10 min。聚丙烯酰胺电泳,每孔上样等量的总蛋白。分离后的蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭1 h后,加入Bax(1∶500)、Bcl-2(1∶500)和GAPDH(1∶5 000)抗体稀释液,4℃过夜。TBS/0.5% Tween20洗膜3次后,再加入1∶5 000抗HRP抗体稀释液37℃孵育1 h,TBS、0.5%Tween20充分洗膜3次后,预混HRP化学发光底物(Luminata crescendo western HRP substrate)凝胶成像分析。
1.2.4 Tunel-FITC检测细胞的凋亡率 收集对数期的HK-2细胞,调整悬液密度,每200μL营养液中含4 000个细胞,种植于96孔板上。常规培养24 h后,各组分别加入顺铂16μmol/L诱导处理16 h,撤除药物与hucMSC-Ex共培养8 h。按照FITCTunel试剂盒说明书进行下一步实验。最后以DAPI避光染细胞核10 min,使用高内涵成像系统进行细胞凋亡率检测。
1.2.5 MTT法测定细胞增殖 实验前期处理同FITC-Tunel法,每组设置5个重复孔。到达作用时间后,每孔加MTT溶液(5 mg/mL,用PBS配制,pH=7.4)20μL。继续避光孵育2 h,终止培养,小心吸弃孔内培养上清液。每孔加100μL DMSO,脱色摇床振荡10 min,使结晶物质充分融解。选择490 nm波长,在酶标仪上测定各孔的光密度值,记录结果。
1.3 数据处理与统计
实验数据采用Graphpad Prism 5软件进行统计分析,正态分布数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HK-2细胞顺铂诱导前后的形态学变化
常规培养的HK-2细胞形态为鹅卵石状的上皮样细胞,经顺铂诱导16 h后,镜下观察细胞形态由卵圆形变为梭形或不规则形,胞质内颗粒增多,并伴有较明显的空泡形成。见图1。
2.2 HucMSC-Ex降低了细胞凋亡蛋白的表达
蛋白质印迹结果显示,hucMSC-Ex处理8 h后,顺铂诱导损伤的HK-2细胞Bax的表达下调(P<0.001),而Bcl-2表达上调(P<0.01),在一定程度上减缓了顺铂所导致的细胞损伤。见图2。
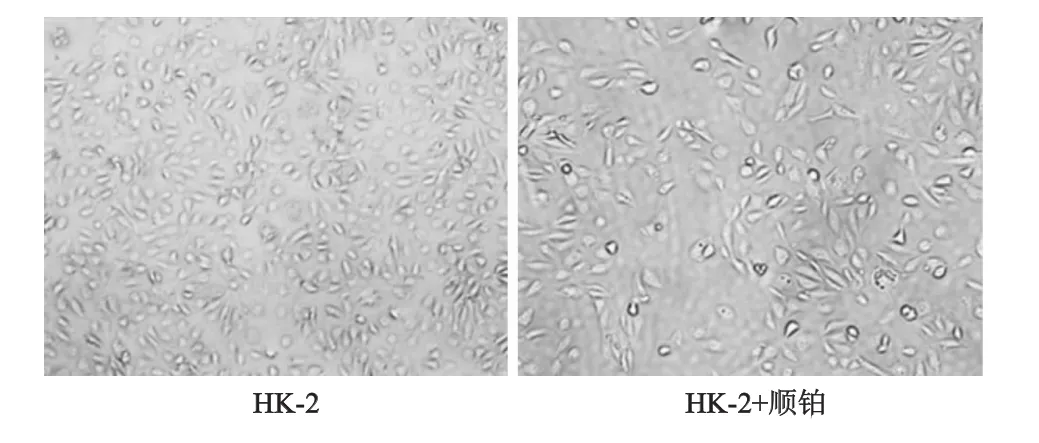
图1 顺铂处理前后HK-2细胞形态变化(×100)
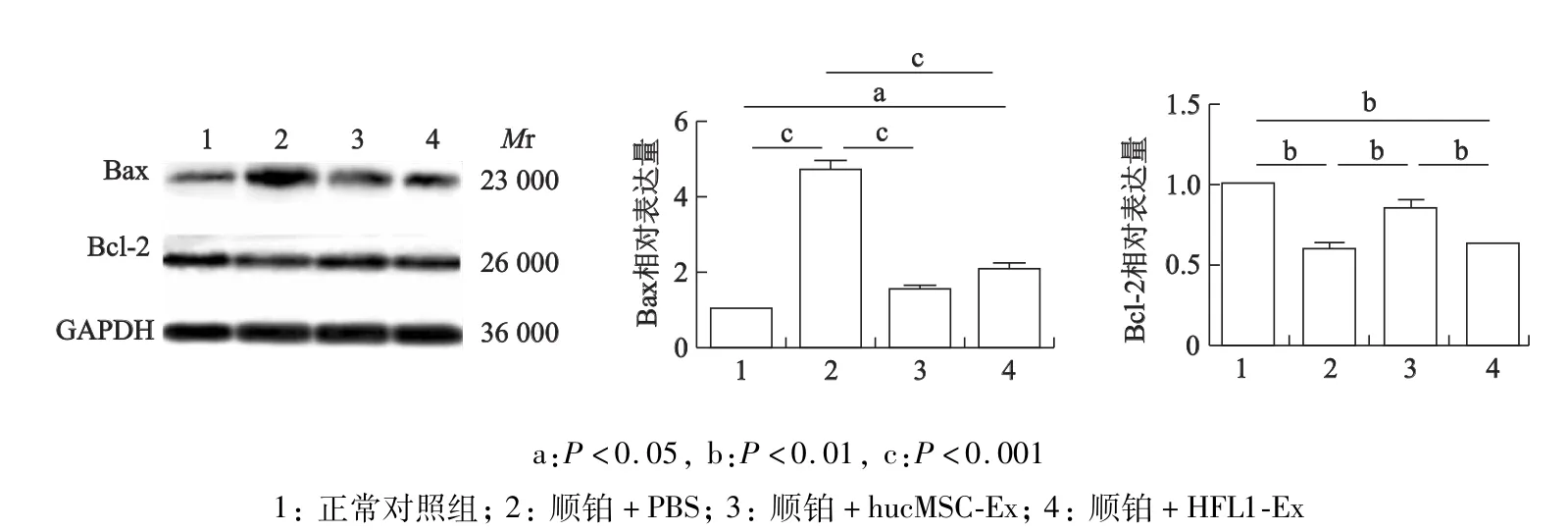
图2 HucMSC-Ex处理后HK-2细胞凋亡蛋白的表达
此外,FITC-Tunel检测后通过高内涵成像系统分析发现,和正常对照组相比,顺铂+PBS组绿色荧光强度明显增加(P<0.001),而经hucMSC-Ex处理8 h后,其绿色荧光强度显著下降(P<0.01)。见图3、图4。结果说明husMSC-Ex可明显提高HK-2细胞的凋亡率。

图3 Tunel-FITC检测细胞凋亡结果
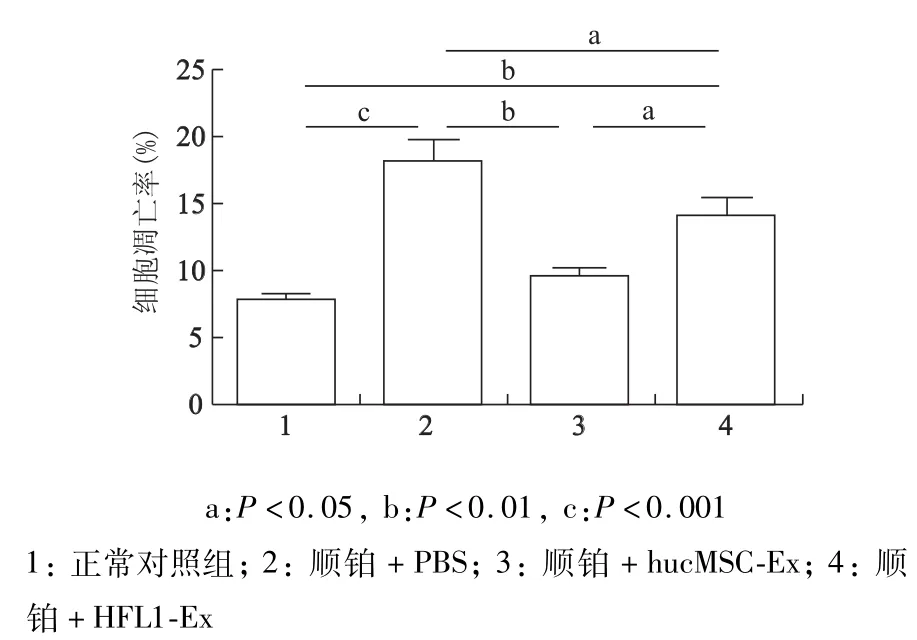
图4 HucM SC-Ex处理后HK-2细胞的凋亡率
2.3 hucMSC-Ex处理后HK-2细胞增殖结果
荧光酶标仪检测发现,顺铂处理后,HK-2细胞增殖能力下降(P<0.01)。而经hucMSC-Ex处理8 h后,细胞增殖能力则明显增强(P<0.05)。见图5。

图5 HucM SC-Ex处理后HK-2细胞的增殖能力
3 讨论
顺铂的抗癌效果因不良反应而受限,有1/3患者表现为肾毒性或急性肾损伤。本研究观察hucMSCEx对顺铂诱导的人源肾上皮细胞损伤的修复作用。通过预实验,确定以16μmol/L顺铂处理HK-2细胞,结果发现细胞形态由椭圆形变为梭形;凋亡蛋白Bax的表达呈上调状态,抗凋亡蛋白Bcl-2的表达和细胞增殖能力均下降。加入hucMSC-Ex后,HK-2细胞增殖能力和凋亡率发生了逆转,相对于损伤对照组,细胞增殖能力明显增强,细胞凋亡显著减弱。
外切体是由细胞分泌的并带有细胞表面抗原的囊性小泡[1],小泡中包含大量的蛋白质、脂类和RNA等生物活性物质[5],能与靶细胞特异性融合并将其包含的大量生物因子直接转移入细胞内部,更直接有效地作用于细胞,在细胞间信息传递方面发挥重要作用[1,9-10]。本研究的结果显示,hucMSC-Ex通过抗凋亡和促增殖发挥了对顺铂诱导的HK-2细胞损伤的修复作用。然而,hucMSC-Ex中何种生物活性成分发挥作用,又是如何作用的确切机制还有待阐明。也有研究提示,外切体可能通过转运miRNAs修复受损细胞[5],这为我们进一步的研究提供了思路与借鉴。总之,hucMSC来源的外切体可减缓顺铂诱导的HK-2细胞损伤。本研究结果为临床应用hucMSC-Ex治疗肾损伤提供了新的实验依据。
[1]Schorey JS,Bhatnagar S.Exosome function:from tumor immunology to pathogen biology[J].Traffic,2008,9(6):871-881.
[2]Lai RC,Chen TS,Lim SK.Mesenchymal stem cell exosome:a novel stem cell-based therapy for cardiovascular disease[J].Regen Med,2011,6(4):481-492.
[3]Bruno S,Grange C,Deregibus MC,et al.Mesenchymal stem cell-derivedmicrovesicles protectagainstacute tubular injury[J].JAm Soc Nephrol,2009,20(5):1053-1067.
[4]Lai RC,Arslan F,Lee MM,et al.Exosome secreted by MSC reducesmyocardial ischemia/reperfusion injury[J].Stem Cell Res,2010,4(3):214-222.
[5]Xin H,Li Y,Buller B,et al.Exosome-mediated transfer ofmiR-133b from multipotentmesenchymal stromal cells to neural cells contributes to neurite outgrowth[J].Stem Cells,2012,30(7):1556-1564.
[6]Lee C,Mitsialis SA,Aslam M,et al.Exosomesmediate the cytoprotective action ofmesenchymal stromal cells on hypoxia-induced pulmonary hypertension[J].Circulation,2012,126(22):2601-2611.
[7]Li T,Yan Y,Wang B,et al.Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis[J].Stem Cells Dev,2013,22(6):845-854.
[8]Zhou Y,Xu H,Xu W,et al.Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro[J].Stem Cell Res Ther,2013,4(2):34.
[9]Camussi G,Deregibus MC,Bruno S,et al.Exosomes/microvesicles as a mechanism of cell-to-cell communication[J].Kidney Int,2010,78(9):838-848.
[10]van Balkom BW,Pisitkun T,Verhaar MC,et al.Exosomes and the kidney:prospects for diagnosis and therapy of renal diseases[J].Kidney Int,2011,80(11):1138-1145.
Exosomes derived from human umbilical cord mesenchymal stem cells repair cisplatin induced human renal proximal tubular epithelial cells injury
JIANG Liu-liu,JIAHao-yuan,ZHU Yuan,YIN Lei,LILi-ming,YE Hui-hui,XUE Jian-guo,XUWen-rong,QIAN Hui
(School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To investigate the effects of exosomes derived from human umbilical cord mesenchymal stem cells(hucMSCs-Ex)on cisplatin induced injury in human renal proximal tubular epithelial(HK-2)cells.M ethods:HK-2 cells injury were induced with cisplatin at a concentration of 16μmol/L for 16 h.Then injured HK-2 cellswere co-cultured with hucMSC-Ex for another 8 h.The apoptosis and proliferation of HK-2 cellswere tested byWestern blot,and FITC-Tunel assay and MTT respectively.At the same time,healthy HK-2 cells and injured HK-2 cells co-cultured with human lung fibroblasts-derived exosomes(HFL1-Ex)and PBSwere used as control.Results:Cisplatin-induced HK-2 injury was confirmed in vitro.Western blot results showed thatexpression of pro-apoptosis protein Bax was decreased and anti-apoptotic protein Bcl-2 was increased accordingly.FITC-Tunel results also showed HK-2 cells apoptosiswas reduced obviously in hucMSCs-Ex group.Furthermore,the MTT assay indicated that hucMSCs-Ex treatment promoted the proliferation of HK-2 cell.Conclusion:hucMSCs-Ex could alleviate cisplatin-induced HK-2 cell injury via promoting cell proliferation and inhibiting apoptosis.
exosomes;cisplatin;human renal proximal tubular epithelial(HK-2)cells;prolification;apoptosis
蒋留留(1987—),男,硕士研究生;钱晖(通讯作者),教授,博士生导师,博士生导师,E-mail:lstmmmlst@163.com
R692.6
A
1671-7783(2014)04-0294-04
10.13312/j.issn.1671-7783.y140088
国家自然科学基金资助项目(81272481,31340040);江苏省高校优秀科技创新团队项目[苏教科(2013)10号];江苏省医学领军人才与创新团队项目(LJ201117)
2014-04-03 [编辑]何承志
