制药废水中头孢类抗生素残留检测方法及环境风险评估
2014-08-07汤薪瑶左剑恶王凯军清华大学环境学院环境模拟与污染控制国家重点联合实验室北京100084
汤薪瑶,左剑恶,余 忻,杨 波,王凯军 (清华大学环境学院,环境模拟与污染控制国家重点联合实验室,北京100084)
制药废水中头孢类抗生素残留检测方法及环境风险评估
汤薪瑶,左剑恶*,余 忻,杨 波,王凯军 (清华大学环境学院,环境模拟与污染控制国家重点联合实验室,北京100084)
基于固相萃取-超高效液相色谱-两级串联质谱(SPE-UPLC/MS/MS)技术,建立了制药废水中头孢克洛、头孢曲松、头孢氨苄、头孢噻肟、头孢唑啉、头孢呋辛、头孢西丁、头孢噻吩和头孢拉定共9种头孢类抗生素的测试方法,定量限为27.5~131.8ng/L,目标物回收率为72.8%~102.2%;利用该技术,检测某采用两级生物氧化工艺的制药废水处理厂各级单元出水,共检测出头孢曲松、头孢唑啉、头孢噻肟和头孢呋辛4种头孢类抗生素,其在进水中平均浓度分别为7.6,12.9,5.6,91.6µg/L,在一级氧化出水中平均浓度分别为4.2,5.2,2.2,37.4µg/L,在二级氧化出水中平均浓度分别为 2.0,2.7,0.6,24.4µg/L;风险商值法评估制药废水出水中残留的头孢曲松、头孢唑啉、头孢噻肟和头孢呋辛的环境风险均为高风险等级.
头孢类抗生素;SPE-UPLC/MS/MS;制药废水;环境风险评价
头孢类抗生素抗菌谱广、杀菌力强,是国内外临床应用最多的一类抗感染药物[1].大量的市场需求导致我国头孢类药物生产量逐年增加[1],生产过程中所产生的制药废水量也逐年增加.实际生产中,制药废水的处理多采用以生物处理为主、结合物化处理工艺的常规废水处理工艺,然而,传统废水处理方法不能将废水中残留的抗生素完全去除[2-5],导致近年来制药废水的排放成为自然环境中药品和个人护理品(PPCPs)的重要来源之一[5].
研究表明,自然环境中PPCPs能以一定浓度长期稳定地存在于自然环境中,为“假持久性”污染物[6].痕量 PPCPs便可能引发生物毒性[7]和耐药性[8-11]等生物安全性问题,已引起国内外学者的广泛关注.
液相色谱-两级串联质谱法(LC-MS/MS)由于灵敏度高、检出限低,以及所需固相萃取(SPE)前处理技术成熟,被广泛应用于地下水[12,16]、地表水[9,11-13,15]、再生水[10,16]和生活污水及城市污水厂出水[12,14-15]中痕量抗生素的浓度检测.但目前关于制药废水中头孢类抗生素的残留水平及其环境风险的研究还较少.本文拟建立制药废水中头孢类抗生素浓度检测方法(SPE-UPLC/MS/ MS,固相萃取-超高效液相色谱串联两级质谱法),以探明制药废水处理厂不同处理单元和最终出水中的头孢类抗生素残留情况,并评估制药废水出水中残留头孢类抗生素的环境风险等级.
1 材料与方法
1.1 试剂与仪器
头孢克洛、头孢曲松、头孢氨苄、头孢噻肟、头孢唑啉、头孢呋辛、头孢西丁和头孢噻吩标准品均为美国药典(USP)标准品,头孢拉定标准品购自德国Dr. Ehrenstorfer公司.头孢呋辛标准品纯度为 91.8%,头孢曲松标准品纯度为 92.4%,头孢噻肟标准品纯度为 93.7%,头孢噻吩标准品纯度为94.7%,其余标准品纯度均大于98%.甲醇和乙腈为色谱纯,购自美国J. T. Baker公司;甲酸为色谱纯,购自中国DikmaPure公司;其余试剂为分析纯.试验用水为美国Millipore公司Mili-Q纯水器制得的超纯水.试验前,分别配置9种头孢类标准品单标甲醇储备液(50mg/L)和混合标准品甲醇储备液(50mg/L),贮存于洁净棕色玻璃瓶内,-20℃冷藏.
采用美国 Supelco-24孔固相萃取装置和Waters公司Oasis HLB固相萃取柱(6cc/500mg)对样品进行洗涤(5mL高纯水),真空干燥,洗脱(5mL甲醇)预处理,采用美国Waters公司超高效液相色谱-三重四级杆串联质谱仪(Quattro Premier XE)检测样品,采用MassLynx V4.1软件分析目标抗生素浓度.
1.2 仪器条件
设定 UPLC-MS/MS仪器参数如下:毛细管电压 2.5kV,源温度 120℃,去溶剂化温度 400℃,脱溶剂气流量900L/h,锥孔反吹气流量50L/h,碰撞气流速0.1mL/min,取样量10μL;采用电喷雾离子源正离子模式(ESI+)和多反应监测模式(MRM);以氮气(≥99.99%)作为脱溶剂气,以氩气(≥99.99%)作为碰撞气.
质谱条件的优化主要包括离子源模式、锥孔电压和母离子,以及碰撞能和子离子的选择,优化结果最终影响目标物质的信号强度和仪器灵敏度.选用ESI(+)离子源[14,17],以乙腈为流动相,借助蠕动泵和进样针,将 9种头孢类抗生素单标标准液(头孢呋辛和头孢噻吩标准液浓度为1000μg/L,其余为500μg/L)以20μL/min的流速注入到质谱样品室内.找到母离子后,调节锥孔电压值至母离子信号最强;开启氩气,对母离子进行轰击,找到信号较强的子离子为定量子离子,信号较弱的子离子为定性子离子,分别调节碰撞能值至两个子离子信号最强.由此得到的目标物特征定量、定性离子对和最佳仪器参数值见表1.
色谱柱为ACQUITY UPLC Waters ® BEH C181.7μm(2.1×50mm Column);柱温为35℃.流动相为 0.1%甲酸的乙腈溶液(A)和 0.1%甲酸的水溶液(B);流动相以0.4mL/min的流速进行梯度洗脱,任意时刻A与B百分比之和为100%;洗脱步骤为 0~1.90min,A由 5.0%线性变化至 14.5%; 1.90~4.40min,A 由 14.5%线性增长至 20.0%; 4.40~5.54min,A 由 20.0%线性变化至 30.0%; 5.54~5.541min,A由30.0%骤降到5.0%,稳定2min后开始测定下一个样品.
1.3 采样方法
废水水样取自某头孢制药废水处理厂,如图1所示,共设置3个采样点(1、2、3).采样在2013年7月1、9、18、26日进行,每天采样3次,每8h采样1次;每次从采样点1取样100mL,从采样点2和3各取样300mL.全部水样盛装于棕色玻璃采样瓶内,4℃保存,48h内完成抗生素残留浓度测试.
抗生素残留浓度较高(10μg/L以上)的水样经 0.22μm水系滤膜过滤后,直接上机测试;抗生素残留浓度较低(低于 10μg/L)的水样通过固相萃取技术净化、浓缩后,再上机测试.
1.4 环境风险评价方法
采用风险商值法(RQ)评估制药废水处理厂出水中残留头孢类抗生素的环境风险等级.RQ值为预测环境浓度(PEC)或实测环境浓度(MEC)与预测无效应浓度(PNEC)的比值.根据 RQ值大小,将环境风险等级分为3级,即RQ值在0.01~0.1间为低环境风险,在0.1~1.0间为中等环境风险,大于1为高环境风险[6].基于SPE-UPLC/MS/MS测试技术,可试验测得制药废水处理厂出水中头孢类抗生素的MEC值,查询文献可获得相应头孢类抗生素的PNEC值,即可依据RQ法判断环境风险等级.
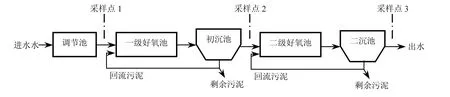
图1 制药废水处理厂工艺流程示意Fig.1 Process of the pharmaceutical wastewater treatment plant
2 结果与讨论
2.1 流动相种类选择
选用乙腈和高纯水作为流动相主体.在流动相中添加适量甲酸,可有效提高信号响应,改善色谱峰拖尾现象,增强分离效果[17].因此,分别设计了高纯水+乙腈、0.01%甲酸高纯水溶液+0.01%甲酸乙腈溶液和 0.1%甲酸高纯水溶液+0.1%甲酸乙腈溶液 3种流动相组合.试验采用 500μg/L混合物质标准液,流动相流速为0.4mL/min.
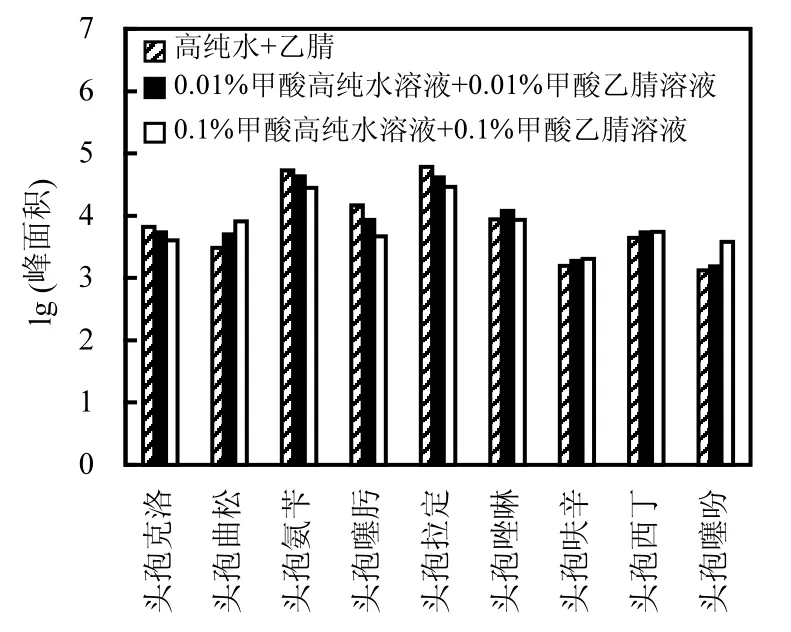
图2 流动相组合对目标物色谱峰面积的影响Fig.2 Mobile phase’s effect on targets’peak area
如图 2所示,随着甲酸浓度的增加,头孢克洛、头孢氨苄、头孢噻肟、头孢拉定和头孢唑啉5种目标抗生素的色谱峰面积(Peak Area)变化幅度不大,但头孢曲松、头孢呋辛、头孢西丁和头孢噻吩 4种目标抗生素的色谱峰面积得到有效提升.同时,当甲酸添加量为 0.1%时,9种目标物在 8min内实现色谱峰分离,色谱峰形状美观,无拖尾现象,分离效果好(图 3).因此,为实现同时连续测定,综合考虑9种目标抗生素信号强度和整体分离效果,确定选用 0.1%甲酸高纯水溶液和0.1%甲酸乙腈溶液作为流动相.
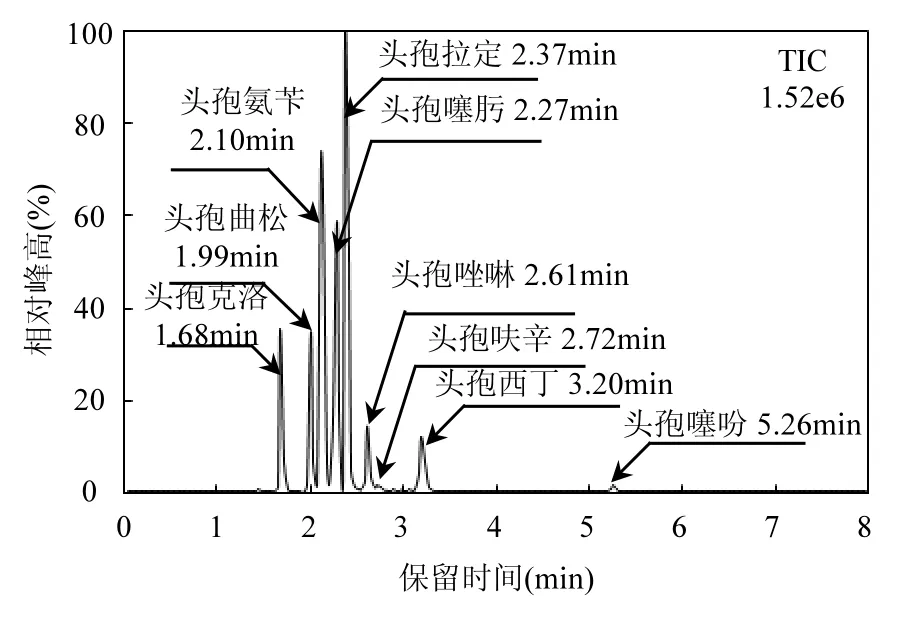
图3 9种头孢类抗生素标准物质(500µg/L)色谱Fig.3 Chromatogram of the 9 cephalosporin standards (500µg/L)
2.2 固相萃取条件选择与方法评价
制药废水中含有少量蛋白质,易与目标物竞争固相萃取柱上吸附位点,随着水样富集倍数的增加还可能引起固相萃取小柱堵塞[18],导致回收率降低,干扰测试结果.因此,在固相萃取前,需对制药废水进行蛋白沉淀净化处理.采用 30%硫酸锌+20%亚铁氰化钾溶液作为蛋白沉淀剂;为避免目标物与沉淀剂中金属离子络合而影响回收率,采用 Na2EDTA作为稳定剂[4].该步骤的目标物回收率均在80%以上.
水样pH值是影响固相萃取回收率的主要原因[18].对于Oasis HLB固相萃取柱,合适的pH值可使目标化合物成分子状态而被固相萃取小柱吸附,同时使杂质成离子形态而不被吸附,从而保证了目标物质的高回收率.本文以硫酸氢二钠-柠檬酸为pH缓冲溶液,采用Oasis HLB固相萃取柱,经HLB柱活化(5mL甲醇和5mL高纯水)、上样(流速为5mL/min)、洗涤(5mL高纯水)、真空干燥(2h)、洗脱(5mL甲醇)、氮吹(37℃)和复溶(1mL高纯水)固相萃取步骤,分别考察水样pH值为3、4、5、6、7、8时的目标物回收率.结果表明,pH=5时,目标物回收率最高,在72.8%~102.2%之间,相对标准偏差均小于9.51%.
SPE-UPLC/MS/MS测试方法定量限(LOQ)公式为:
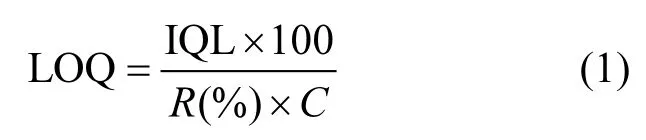
试中:IQL为仪器定量限,即色谱峰信噪比S/N等于10:1时对应的目标物浓度,μg/L;R为SPE回收率,是目标物实测浓度值与外加浓度值的百分比;C为样品浓缩倍数.试验可得各目标物IQL值,结果列于表 1中;C为 100(添加目标物浓度为500ng/L).在各物质IQL至1000μg/L范围内,9种目标物色谱峰面积与浓度均表现出良好的线性相关性(R2>0.99).因此,本文所建立测试方法的定量限为27.5~ 131.8ng/L.
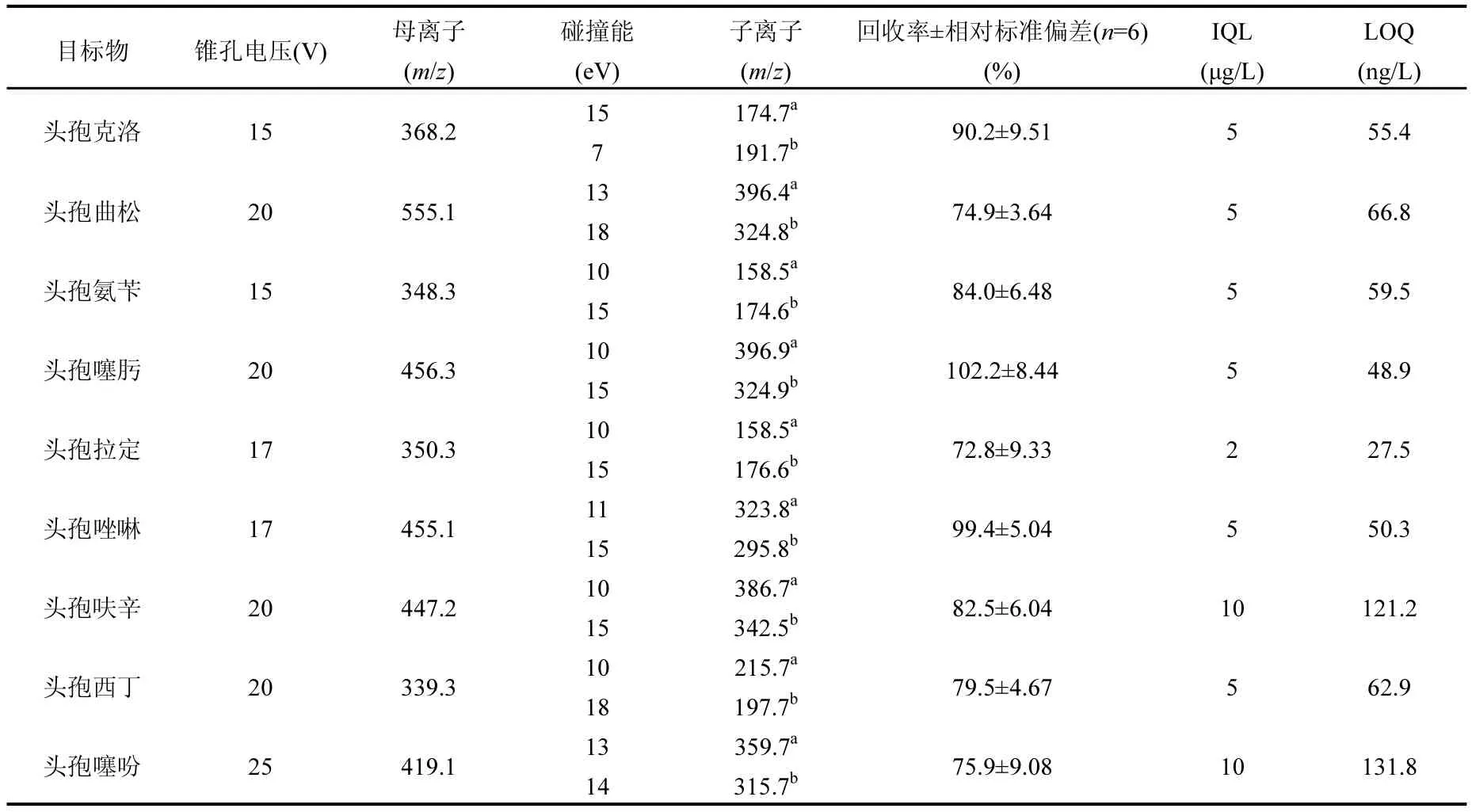
表1 质谱条件选择与方法评价Table 1 Optimized parameters for MS/MS and method assessment
2.3 制药废水中头孢类抗生素浓度检测
利用本文建立的测试方法,分析制药废水处理厂所得残留浓度时空分布.如图4所示,共检测出头孢曲松、头孢唑啉、头孢噻肟和头孢呋 4种头孢类抗生素.进水中浓度最高的为头孢呋辛(42.4~119.0μg/L),其 次 为 头 孢 唑 啉 (10.6~14.5μg/L)、头孢曲松(5.1~10.0μg/L)和头孢噻肟(5.0~6.3μg/L).残留浓度随采样时间不同而有较大变化,这与制药厂的实际生产情况有关.
头孢呋辛在调节池出水、一级氧化出水和二级氧化出水中残留的平均浓度分别为 91.6,37.4, 24.4μg/L;头孢唑林在3个处理单元出水中残留的平均浓度依次为12.9,5.2,2.7μg/L;头孢曲松在3个处理单元出水中残留的平均浓度依次为7.6,4.2,2.0μg/L;头孢噻肟在3个处理单元出水中残留的平均浓度依次为5.6,2.2,0.6μg/L.计算可得,一级氧化处理单元对头孢呋辛、头孢唑林、头孢曲松和头孢噻肟的平均去除率分别59.2%、59.8%、44.8%和60%;二级氧化处理单元对4种头孢类抗生素的平均去除率平均为34.8%、47.0%、52.5%和75.1%;两级氧化处理单元对 4种头孢类抗生素的平均去除率为 73.4%、78.7%、73.8%和 90.0%.由此可见,常规好氧污水处理工艺对制药废水中头孢类抗生素具有较好的去除能力,但无法实现完全去除.

图4 各制药废水处理单元中4种头孢类抗生素残留浓度分布Fig.4 The 4kinds of cephalosporin residue concentration in pharmaceutical wastewater
2.4 头孢制药废水环境风险评价
常规两级好氧污水工艺对进水中各头孢类抗生素的去除率达到 73.0%以上,但总出水中仍残留了较高浓度的抗生素,最高的为头孢呋辛(10.6~35.1μg/L),其次为头孢唑啉(0.8~4.2μg/L)、头孢曲松1.0~3.8μg/L)和头孢噻肟(n.d.~1.5μg/L).该浓度水平远远高于生活污水出水中头孢类抗生素的残留水平[14,19].
采用“最大值”原则来评价实测制药废水出水中4种残留头孢类抗生素的环境风险.根据风险商值法计算制药废水中残留抗生素的 RQ值,结果如表2所示,计算所得RQ值均大于1.因此,可评估出制药废水出水中残留抗生素的环境风险等级均为高.
本研究中的制药废水处理厂出水不直接进入自然水体,而是被排入下游城镇污水处理厂或工业园区污水处理厂进一步处理.本研究将进一步优化测试方法、降低方法定量限,以开展制药废水厂下游受纳污水处理厂中头孢类抗生素的残留分析,评价其对自然水体的最终环境风险.
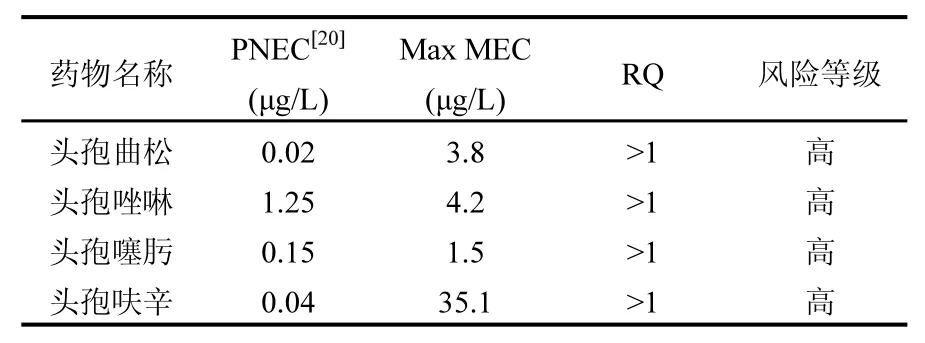
表2 制药废水中残留头孢类抗生素环境风险评价Table 2 Environmental risk assessment of cephalosporin residues in pharmaceutical wastewater
3 结论
3.1 建立了同时测定制药废水中9种头孢类抗生素残留浓度的SPE-UPLC/MS/MS快速测试方法,方法稳定可靠,能满足制药废水中9种头孢类抗生素浓度的检测分析.
3.2 常规两级好氧废水处理工艺能够有效去除制药废水进水中残留的较高浓度头孢类抗生素,去除率在73%以上.
3.3 在头孢类制药废水出水中,检测出头孢曲松、头孢唑啉、头孢噻肟和头孢呋辛4种头孢类药物,其浓度水平在ppb量级,环境风险等级为高.
[1]薛 雨,陈宇瑛.头孢菌素类抗生素的最新研究进展 [J]. 中国抗生素杂质, 2011,36(2):86-92.
[2]Sui Q, Huang J, Deng S, et al. Occurrence and removal of pharmaceuticals, caffeine and DEET in wastewater treatment plants of Beijing, China [J]. Water Research, 2010,44(2):417-426.
[3]Kim J W, Yoon S M, Lee S J, et al. Occurrence and fate of PPCPs wastewater treatment plants in Korea [C]//TheSecond International Conference on Environment and Industrial Innovation, IPCBEE, Singapore, LACSIT Press, 2012,35:57-61.
[4]李再兴,张非非,左剑恶,等.SPE-UPLC-MS/MS法测定制药废水中四环素类抗生素 [J]. 环境科学与技术, 2013,36(7):139-142.
[5]Kummerer K. Antibiotics in the aquatic environment-A review-Part I [J]. Chemosphere, 2009,75(4):417-434.
[6]Hernando M D, Mezcua M, Fernandez-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments [J]. Talanta, 2006,69(2):334-342.
[7]Yu X, ZuoJ, Tang X, et al. Toxicity evaluation of pharmaceutical wastewaters using the alga Scenedesmusobliquus and the bacterium Vibrio fischeri [J]. J. Hazard. Mat., 2014,266:68-74.
[8]欧丹云,陈 彬,陈灿祥,等.九龙江下游河口水域抗生素及抗性细菌的分布 [J]. 中国环境科学, 2013,33(12):2243-2250.
[9]杨弯弯,武氏秋贤,吴亦潇,等.恩诺沙星和硫氰酸红霉素对铜绿微囊藻的毒性研究 [J]. 中国环境科学, 2013,33(10):1829-1834.
[10]Wang F, Qiao M, Lv Z, et al. Impact of reclaimed water irrigation on antibiotic resistance in publi parks, Beijing, China [J]. Environmental Pollution, 2014,184:247-253.
[11]施嘉琛,胡建英,常 红,等.北京温榆河流域耐药大肠杆菌的调查研究 [J]. 中国环境科学, 2008,28(1):39-42.
[12]Petrovic M, Skrbic B, Zivancev J, et al. Determination of 81pharmaceutical drugs by high performance liquid chromatography coupled to mass spectrometry with hybrid triple quadrupole-linear ion trap in different types of water in Serbia [J]. Sci. Tot. Environ., 2014,468-469:415-428.
[13]Zhang R, Tang J, Li J, et al. Antibiotics in the offshore waters of the Bohai Sea and the Yellow Sea in China: Occurrence, distribution and ecological risks [J]. Environmental Pollution, 2013,174:71-77.
[14]Li B, Zhang T, Xu Z, et al. Rapid analysis of 21 antibiotics of multiple classes in municipal wastewater using ultra performance liquid chromatography-tandem mass spectrometry [J]. Analytica Chimica Acta, 2009,645(1/2):64-72.
[15]Al Aukidy M, Verlicchi P, Jelic A, et al. Monitoring release of pharmaceutical compounds-occurrence and environmental risk assessment of two WWTP effluents and their receiving bodies in the Po Valley, Italy [J]. Sci. Tot. Environ., 2012,438:15-25.
[16]Estevez E, Cabrera M C, Molina-Diaz A, et al. Screening of emerging contaminants and priority substances (2008/105/EC) in reclaimed water for irrigation and groundwater in a volcanic aquifer (Gran Canaria, Canary Islands, Spain) [J]. Sci. Tot. Environ., 2012,433:538-546.
[17]Becker M, Zittlau E, Petz M. Residue analysis of 15 penicillins and cephalosporins in bovine muscle, kidney and milk by liquild chromatography-tandem mass spectrometry [J]. Anlytica Chimica Acta, 2004,520(1/2):19-32.
[18]陈小华,汪群杰.固相萃取技术与应用 [M]. 北京:科学出版社, 2010,29-30,324-325.
[19]Sim W J, Lee J W, E. Lee S, et al. Rapid analysis of multiclass antibiotic residues and some of their metabolites in hospital, urban wastewater and river water by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry [J]. J. Chromatography A, 2013,1292:173-188.
[20]Kummerer K, Henninger A. Promoting resistance by the emission of antibiotics from hospitals and households into effluent [J]. Clinical Microbiology and Infection, 2003, 9(12): 1203-1214.
致谢:感谢制药废水处理厂对于样品采集的大力支持.
Residue analysis method and environmental risk assessment of cephalosporin antibiotics in pharmaceutical wastewater.
TANG Xin-yao, ZUO Jian-e*, YU Xin, YANG Bo, WANG Kai-jun (State Key Joint Laboratory of
Environment Simulation and Pollution Control, School of Environment, Tsinghua University, Beijing 100084, China). China Environmental Science, 2014,34(9):2273~2278
Based on solid phase extraction (SPE) and ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS), a testing method for 9 cephalosporin antibiotics, i.e., cefaclor, ceftriaxone, cephalexin, cefotaxime, cefazolin, cefuroxime, cefoxitin, cefalotin and cefradine, in pharmaceutical wastewater was established. The limit of quantitation was from 27.5 to 131.8ng/L, and the recovery efficiencies for different analytes ranged from 72.8% to 102.2%. With this method, cephalosporin antibiotics in the effluent of each processing unit of a pharmaceutical wastewater treatment plant (P-WWTP), which adopted two-stage biological oxidation processes, were tested. Ceftriaxone, cefazolin, cefotaxime and cefuroxime were found in the pharmaceutical wastewater. Their average concentrations in influents were 7.6, 12.9, 5.6 and 91.6µg/L, in effluents of first-stage oxidation unit were 4.2, 5.2, 2.2 and 37.4µg/L, and in effluents of second-stage oxidation unit were 2.0, 2.7, 0.6 and 24.4µg/L, respectively. Risk quotient method was utilized to evaluate the environmental risks of these four antibiotics in the effluents, and all the results were high risk levels.
cephalosporin antibiotics;SPE-UPLC/MS/MS;pharmaceutical wastewater;environmental risk assessment
X832;X820.4
A
1000-6923(2014)09-2273-06
汤薪瑶(1989-),女,辽宁省台安县人,清华大学环境学院硕士研究生,主要从事制药废水水质分析与处理研究.
2014-01-12
水体污染控制与治理科技重大专项(2009ZX07529-006, 2012ZX07205-001)
* 责任作者, 教授, jiane.zuo@tsinghua.edu.cn
