胰泌素增强磁共振评估慢性胰腺炎研究进展
2014-08-04边云王莉
边云 王莉
慢性胰腺炎(chronic pancreatitis, CP)是指各种已知或未知的致病因素作用下胰腺发生的炎性损害。此损害为一个进行性、持续性的病理过程,最终引起胰腺形态和功能发生不可逆改变,胰腺组织逐渐为纤维化组织所替代,内、外分泌功能降低直至消失。CP早期确诊一直很困难,临床上的诊断主要依据影像学检查和功能检查。内镜下逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)目前被认为是诊断CP的金标准[1]。最近,文献报道内镜超声(endoscopic ultrasonography, EUS)对早期CP的诊断能力几乎与ERCP一致[2]。但是,这两种检查都是有创检查。随着影像技术的发展,MRI在提高对CP诊断准确率的同时,对该病早期或轻型病例诊断的优势也日益突显,胰泌素结合MR以其无创、敏感的优点在临床得到广泛运用。本文主要就胰泌素增强磁共振成像对CP的诊断进展作一综述。
一、胰泌素
胰泌素(secretin)又称促胰液素、胰液素,为一碱性多肽类激素,是由十二指肠黏膜S细胞和分散在空肠(主要是近端)的S细胞释放的消化道激素,主要通过肾脏代谢[3]。胃酸是刺激胰泌素释放的最强因素,另外胆汁、胆酸钠、脂肪、钙离子、乙醇等均可刺激胰泌素分泌。胰泌素的生理作用主要是刺激胰腺分泌富含碳酸氢盐的胰液,并可在最初的5 min内一过性增加Oddis括约肌的收缩功能[4-5];增强胆囊收缩,刺激胆汁分泌,抑制胃肠蠕动,抑制胃泌素、生长抑素、胃酸的释放和分泌。
临床上胰泌素增加内镜功能试验(secretin endoscopic pancreatic function test, ePET)、ERCP和磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)时均用到胰泌素。胰泌素需要冷藏(2~8℃),用于外分泌功能检查时推荐剂量为1 CU/kg,1~2 min静脉内注射完成。它的主要不良反应为恶心、呕吐、潮红、腹部疼痛,但发生率极低。在急性胰腺炎时要慎用。目前运用于临床的胰泌素主要有两大品牌,美国ChiRhoStim公司生产的SecreFlo和德国Sanochemia公司生产的Secrelux。
二、胰泌素增强磁共振胰胆管造影(secretin-magnetic resonance cholangiopancreatography, S-MRCP)对胰腺外分泌功能的评估
胰腺外分泌功能检查是从生理功能的角度研究和诊断疾病的一种方法。到目前为止,胰腺外分泌功能的评价一直很困难[6-8],最准确的方法是十二指肠置管收集胰液的直接胰腺功能试验,但它较难操作及标准化,且为有创检查,患者耐受性差,目前已基本不用。间接外分泌功能试验具有非创伤性、操作简单的优点,但总体来说敏感性、特异性都较低,大多数在胰腺外分泌功能严重不足时才呈阳性[9]。临床上常用的主要有粪弹力蛋白酶(fecal elastase-1, FE-1)测定和尿BT-PABA测定。而S-MRCP却是一种可以量化评估胰腺外分泌功能的无创检查方法,其原理是在胰泌素的刺激下,胰腺分泌含有大量碳酸氢盐的胰液,引起小肠内液体逐渐增加[10-11],根据小肠内单位时间液体的改变情况来判断胰腺的外分泌功能。
1.检查前的准备:受检者禁食、禁水4~6 h。为了排除存留在胃和小肠内液体对图像的影响,部分文献报道[12-14]在检查前给患者服用超顺磁性氧化铁造影剂,如枸橼酸铁铵制剂(ferric ammonium citrate, FAC)和氯化锰制剂(lumen hance, LH)等。还可服用如柠檬汁、橘子汁、蓝莓汁、菠萝汁等果汁或黑茶[15-18],能起到超顺磁性氧化铁造影剂的效果。口服少许钆喷酸葡胺(Gd-DTPA)也可达到类似效果[19-23]。此外,为了减少胃肠道的蠕动,Gillams等[24]在检查前给受检者静脉注射Buscopan 20~40 mg。
2.磁共振序列:扫描序列通常选择单次激发FSE T2WI序列和厚层二维MRCP,线圈通常选用体线圈,因为体线圈产生的信号较均匀[25]。首先进行MRCP基线扫描,然后给患者静脉注射胰泌素(1 CU/kg体质量),1 min后进行MRCP扫描,以后以2 min为间隔重复MRCP扫描至11 min,这样可得到胰液分泌的一组动态图像,最后对图像进行量化处理来评估胰腺外分泌功能,具体扫描参数和步骤如表1。
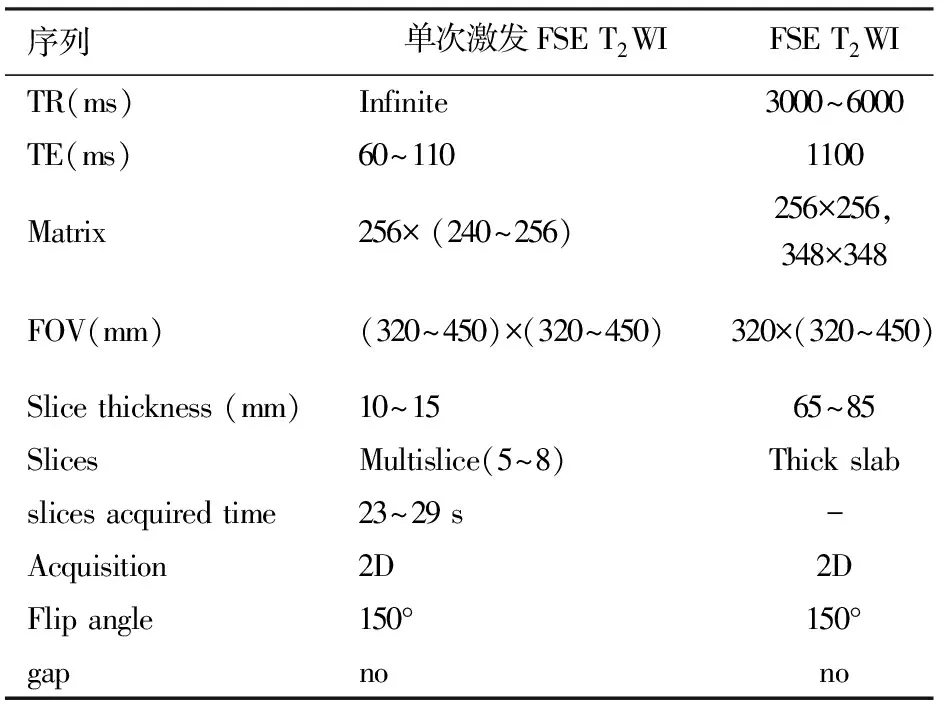
表1 S-MRCP扫描流程图及扫描参数设置
3.量化的方法:(1)半定量评估法:半定量方法评估外分泌功能是根据Matos等[26]在1997年提出的十二指肠充盈程度(duodenal filling, DF)分级标准,将DF分为4级(表2)。此种半定量评估胰腺外分泌功能的方法虽然简单但没有定量评估敏感性和特异性高。(2)定量评估法:定量评估胰腺外分泌功能的方法大致分为3种。第一种方法如Heverhagen等[11,24,27-28]描述的,先通过水模试验证实利用MRCP测得的水的体积与实际注入水的体积有很好的相关性。然后在一组动态MRCP图像上画感兴趣区(region of interest, ROI),ROI需包含胃肠道及胰腺组织,通过测量各个时间点ROI的信号强度,由公式计算ROI内水含量,从而得到时间-胰液分泌量曲线,并可计算出胰液分泌的体积(total excreted volume, TEV)和胰液流率(pancreatic flow output, PFO)以及胰液分泌达峰时间(peak time, PT)。第二种方法如Bali等[11,29]描述的注射胰泌素前给受试者多次饮用等量的水进行体内校正,得到一个校正系数dSref/dV,然后对多层冠状面T2WI画ROI, ROI也必须包括胃肠道及胰腺组织,得到其像素值,通过公式计算出PFO和TEV的值。第三种如Manfredi等[30]描述的,利用磁共振机器所带的3D-Segment后处理软件勾勒出冠状位T2WI上的十二指肠的轮廓,然后由机器自动生成ROI的体积。

表2 十二指肠充盈度分级
4.量化的结果:Heverhagen等[11,27]研究表明无胰腺疾病组注射胰泌素后TEV和胰液开始分泌时间分别为(183±86)ml、(95±94)s,CP组为(61±39)ml、(62±13)s。以TEV<100 ml为临界值,其敏感性和特异性分别为85%、100%。以胰液开始分泌的时间<70 s为临界值,其敏感性和特异性分别为48%、33%。Punwani等[28]计算了11名无胰腺疾病者的PFO为(8.1±2.5)ml/min,峰率为(10±3.8)ml/min。Bali等[31]研究表明,健康者注射胰泌素10 min后的PFO为(6.9±1.5)ml/min, TEV为(103±26)ml。Gillams等[32]对215名受试者研究的结果显示,健康者PFO为(7.4±2.9)ml/min,重度CP患者PFO为(5.3±2.4)ml/min,两者差异有统计学意义。
三、S-MRCP对胰管的评估
为了使MRCP能够清楚地显示胰管的全貌,扫描时需要将视野(field of view, FOV)的长轴与胰腺的长轴平行[33]。MRCP图像中扩张的主胰管(main pancreatic duct, MPD)可以100%显示出来[34-35]。在正常生理情况下,70%~83%的CP患者MPD可完全显示清楚,分支胰管扩张后才可显示。然而胰管的显示依赖于其内液体的充盈,而胰泌素所起的作用正是促进胰液的释放,从而扩张胰管,增加胰管的显示率[25]。剑桥分级诊断的标准认为,在胰腺形态、大小和主胰管均表现正常时,分支胰管达到3支即可诊断为CP[36]。目前,ERCP仍是CP诊断和分期的主要标准,但存在着5%~15%引起急性胰腺损伤的风险[37]。Lagerlof等[38]在1956年第一次报道将胰泌素运用于胰酶增高患者观察胰管的改变。Manfredi等[39]对84例可疑CP患者注射胰泌素后发现在注射后3 min主胰管扩张最显著,主胰管的显示率从65%提高到97%,而分支胰管的显示率从4%提高到53%,两者之间差异有统计学意义;并发现6例患者存在胰腺分裂。Fukukura等[40]研究结果表明,胰泌素注射后增强了主、副胰管和分支胰管可视化程度,并测得无胰腺疾病组各部分胰管显示最佳时间为(4.7±1.6)min,而MPD局限性狭窄、扩张组显示的最佳时间为(4.9±1.4)min。Matos等[41]研究表明健康组在注射胰泌素后2~6 minMPD扩张最显著,于2~3 min达到峰值,10 min左右回到基线位置,而分支胰管不显示。异常组在注射胰泌素后MPD全程或部分延迟扩张,显示的分支胰管超过3支,低于60岁MPD体部直径超过3 mm均可视为异常。笔者的研究发现许多胰腺实质表现正常的可疑CP患者,S-MRCP上可显示分支胰管(图1),表明S-MRCP增加了主胰管和分支胰管的可视化程度,有助于早期CP的诊断。
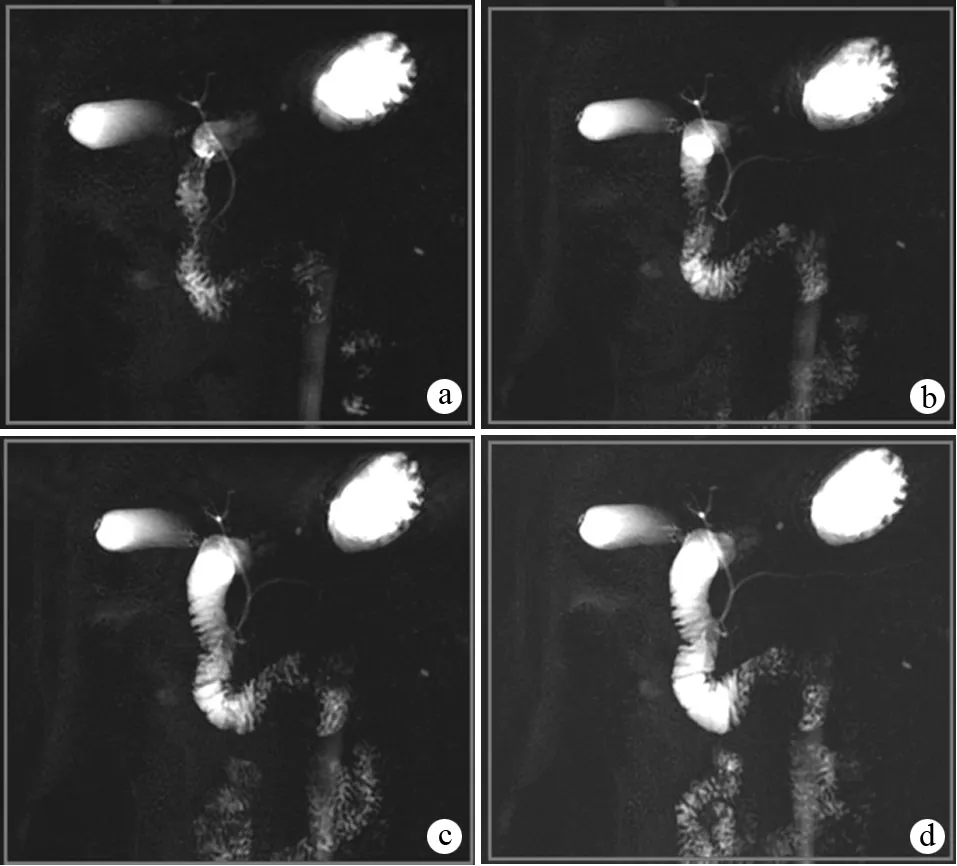
图1 胰泌素注射前(a)及胰泌素注射后1、3、7 min(b~d)MRCP图
四、胰泌素增强磁共振扩散加权成像(secretin-stimulated diffusion-weighted magnetic resonance imaging, S-DWI)对CP的评估
DWI是基于组织内水分子不规则运动不同,对组织结构特征进行分析的一种功能成像方法。近年来在CP的研究中,一种新的技术——S-DWI能通过检测胰腺实质内水分子的变化来评价胰腺外分泌功能,从而有助于轻型或早期CP的诊断和外分泌功能的评估。在MR扫描序列上通常选用屏气的单次激发平面回波扩散加权成像(single-shot echo-planar diffudion-weighted imaging, ss EPI-DWI)序列,b值一般选取200~600 s/mm2。Erturk等[20]在2006年首次将胰泌素用于DWI检查中,他们将83例研究对象分为正常组、长期服酒精的风险组和CP组,注射胰泌素后正常组、风险组的表观扩散系数(apparent diffusion coefficiert, ADC)峰值出现时间分别为90 s~4 min(平均2 min)、4~8 min(平均7 min),风险组峰值出现时间较正常组明显延长,而CP组在胰泌素注射10 min后无ADC峰出现。将胰泌素注射后ADC峰出现的临界时间定在4 min,敏感性和特异性分别为100%和94.7%。Sugiyama等[18]在2007年对38名正常人和l6例有酗酒史(每天饮酒超过50 ml、长达7年以上,但超声或CT未见胰腺异常者)以及15例ERCP证实的重度CP患者进行研究。他们利用一组胰泌素注射前、后长达10 min的MR动态图像绘制成表观扩散系数-时间曲线 (ADC-time curve),结果发现注射胰泌素后正常组ADC峰值及其出现时间为(2.8±0.8)×10-3mm2/s,(2.2±0.7)min;酗酒组为(1.5±0.7)×10-3mm2/s,(6.4±0.9)min ,酗酒者峰值较正常组低,且峰值出现时间较正常组明显延长;重度CP组ADC值为(0.9±0.5)×10-3mm2/s,无ADC峰出现。Balci等[29]在2008年将S-DWI研究结果与金标准ePFT相对照,健康者ADC值为(1.78±0.07)×-3mm2/s,而ePFT结果正常的CP患者ADC值为(1.52±0.13)×10-3mm2/s,两组间差异有统计学意义。AkisikK等[10]于2009年报道,在S-DWI上区别正常组和CP组的ADC峰临界值为2.2×10-3mm2/s,注射胰泌素前、后ADC平均增值和峰值在正常组和CP组间差异有统计学意义,但却不能反应CP的严重程度。Wathle等[42]在2013年对20例健康志愿者研究后发现,注射胰泌素后胰头、体、尾部ADC值均较注射前明显增加,注射胰泌素后1 min测得胰头部ADC值为1.48×-3mm2/s,以后ADC值逐渐下降,13 min后回到基线。
以上的研究表明风险组虽然超声或CT证明胰腺形态学无异常改变,但延迟的ADC峰已提示胰腺存在一定程度的外分泌功能受损,即已经出现轻度CP表现。出现ADC峰延迟的原因为胰腺外分泌组织不同程度纤维化,导致胰液分泌至胰管延迟、胰管小分支内液体流动减慢,从而导致这种水分子的运动扩散受限,造成ADC峰的延迟[43]。此项研究说明,在胰泌素注射后,通过ADC值和达峰时间的测量可以较早地发现胰腺实质的早期病理变化,可作为检测轻度或早期CP的一种方法,且这项技术对胰腺外分泌功能损害评价的敏感性很高。
综上所述,胰泌素增强磁共振成像是一种无创的检查,不仅可以完整地展现胰、胆管的全貌,清晰地显示分支胰管,而且可以量化评估胰腺外分泌功能,了解胰管梗阻的程度、胰腺实质的改变,从而更早、更准确地诊断CP,对于早期CP有特异性,有望在诊断上取代ERCP。
参 考 文 献
[1] Doctor N, Dooley JS,Davidson BR. Assessment of pancreatic duct damage following trauma: is endoscopic retrograde cholangiopancreatography the gold standard[J]? Postgrad Med J, 1995, 71(832):116-117.
[2] Okabe Y, Ishida Y, Kaji R, et al. Endoscopic ultrasonographic study of autoimmune pancreatitis and the effect of steroid therapy[J]. J Hepatobiliary Pancreat Sci, 2012, 19(3):266-273.
[3] Chey WY,Chang TM. Secretin, 100 years later[J]. J Gastroenterol, 2003, 38(11):1025-1035.
[4] Dreiling DA,Messer J. The secretin story: a saga in clinical medicine and gastrointestinal physiology[J]. Am J Gastroenterol, 1978,70(5):455-479.
[5] Laugier R. Dynamic endoscopic manometry of the response to secretin in patients with chronic pancreatitis[J]. Endoscopy, 1994, 26(2):222-227.
[6] Balci NC, Alkaade S, Magas L, et al. Suspected chronic pancreatitis with normal MRCP: findings on MRI in correlation with secretin MRCP[J]. J Magn Reson Imaging, 2008, 27(1):125-131.
[7] Hahn JU, Kerner W, Maisonneuve P, et al. Low fecal elastase 1 levels do not indicate exocrine pancreatic insufficiency in type-1 diabetes mellitus[J]. Pancreas, 2008, 36(3):274-278.
[8] Stevens T, Dumot JA, Zuccaro G Jr, et al. Evaluation of duct-cell and acinar-cell function and endosonographic abnormalities in patients with suspected chronic pancreatitis[J]. Clin Gastroenterol Hepatol, 2009, 7(1):114-119.
[9] Nakamura H, Morifuji M, Murakami Y, et al. Usefulness of a 13C-labeled mixed triglyceride breath test for assessing pancreatic exocrine function after pancreatic surgery[J]. Surgery, 2009, 145(2):168-175.
[10] Akisik MF, Aisen AM, Sandrasegaran K, et al. Assessment of chronic pancreatitis: utility of diffusion-weighted MR imaging with secretin enhancement[J]. Radiology, 2009, 250(1):103-109.
[11] Heverhagen JT, Muller D, Battmann A, et al. MR hydrometry to assess exocrine function of the pancreas: initial results of noninvasive quantification of secretion[J]. Radiology, 2001, 218(1):61-67.
[12] Donati F, Boraschi P, Gigoni R, et al. Secretin-stimulated MR cholangio-pancreatography in the evaluation of asymptomatic patients with non-specific pancreatic hyperenzymemia[J]. Eur J Radiol, 2010, 75(2):e38-e44.
[13] Sanyal R, Stevens T, Novak E, et al. Secretin-enhanced MRCP: review of technique and application with proposal for quantification of exocrine function[J]. Am J Roentgenol, 2012, 198(1):124-132.
[14] Tang HH, Song B, Huang ZR, et al. Application of black tea as a negative oral contrast in magnetic resonance cholangiopancreatography (MRCP)[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2013, 44(3):476-480.
[15] Chu ZQ, Ji Q,Zhang JL. Orally administered lemon/orange juice improved MRCP imaging of pancreatic ducts[J]. Abdom Imaging, 2010, 35(3):367-371.
[16] Duarte JA, Furtado AP,Marroni CA. Use of pineapple juice with gadopentetate dimeglumine as a negative oral contrast for magnetic resonance cholangiopancreatography: a multicentric study[J]. Abdom Imaging, 2012, 37(3):447-456.
[17] Coppens E, Metens T, Winant C, et al. Pineapple juice labeled with gadolinium: a convenient oral contrast for magnetic resonance cholangiopancreatography[J]. Eur Radiol, 2005, 15(10):2122-2129.
[18] Ghanaati H, Rokni-Yazdi H, Jalali AH, et al. Improvement of MR cholangiopancreatography (MRCP) images after black tea consumption[J]. Eur Radiol, 2011, 21(12):2551-257.
[19] Sugiyama M, Haradome H,Atomi Y. Magnetic resonance imaging for diagnosing chronic pancreatitis[J]. J Gastroenterol, 2007, 42(17):108-112.
[20] Erturk SM, Ichikawa T, Motosugi U, et al. Diffusion-weighted MR imaging in the evaluation of pancreatic exocrine function before and after secretin stimulation[J]. Am J Gastroenterol, 2006, 101(1):133-136.
[21] Holzapfel K, Breitwieser C, Prinz C, et al. Contrast-enhanced magnetic resonance cholangiography using gadolinium-EOB-DTPA. Preliminary experience and clinical applications[J]. Radiologe, 2007, 47(6):536-544.
[22] Salvolini L, Urbinati C, Valeri G, et al. Contrast-enhanced MR cholangiography (MRCP) with GD-EOB-DTPA in evaluating biliary complications after surgery[J]. Radiol Med, 2012, 117(3):354-368.
[23] 陈翼赵, 赵云辉,许乙凯,等. 口服静脉用钆喷替酸葡甲胺对MR胰胆管成像质量影响的研究[J]. 中华放射学杂志, 2008,42(12):1292-1297.
[24] Gillams A, Pereira S, Webster G, et al. Correlation of MRCP quantification (MRCPQ) with conventional non-invasive pancreatic exocrine function tests[J]. Abdom Imaging, 2008, 33(4):469-473.
[25] Jin EH, Ichikawa T, Erturk SM, et al. Calibrated magnetic resonance hydrometry to quantify pancreatic juice: a preliminary study[J]. J Magn Reson Imaging, 2009, 29(1):217-220.
[26] Matos C, Metens T, Deviere J, et al. Pancreatic duct: morphologic and functional evaluation with dynamic MR pancreatography after secretin stimulation[J]. Radiology, 1997, 203(2):435-441.
[27] Heverhagen JT, Battmann A, Kirsch M, et al. Magnetic resonance hydrometry: non-invasive quantification of the exocrine pancreatic function[J]. Rofo, 2002, 174(3):291-296.
[28] Punwani S, Gillams AR,Lees WR. Non-invasive quantification of pancreatic exocrine function using secretin-stimulated MRCP[J]. Eur Radiol, 2003, 13(2):273-276.
[29] Balci NC, Momtahen AJ, Akduman EI, et al. Diffusion-weighted MRI of the pancreas: correlation with secretin endoscopic pancreatic function test (ePFT)[J]. Acad Radiol, 2008, 15(10):1264-1268.
[30] Manfredi R, Perandini S, Mantovani W, et al. Quantitative MRCP assessment of pancreatic exocrine reserve and its correlation with faecal elastase-1 in patients with chronic pancreatitis[J]. Radiol Med, 2012, 117(2):282-292.
[31] Bali MA, Golstein P, Deviere J, et al. Evaluation of somatostatin inhibitory effect on pancreatic exocrine function using secretin-enhanced dynamic magnetic resonance cholangiopancreatography: a crossover, randomized, double blind, placebo-controlled study[J]. Pancreas, 2006, 32(4): 346-350.
[32] Gillams AR,Lees WR. Quantitative secretin MRCP (MRCPQ): results in 215 patients with known or suspected pancreatic pathology[J]. Eur Radiol, 2007, 17(11):2984-2990.
[33] Tirkes T, Menias CO,Sandrasegaran K. MR imaging techniques for pancreas[J]. Radiol Clin North Am, 2012, 50(3):379-393.
[34] Fulcher AS,Turner MA. MR pancreatography: a useful tool for evaluating pancreatic disorders[J]. Radiographics, 1999, 19(1):5-24.
[35] Reuther G, Kiefer B, Tuchmann A, et al. Imaging findings of pancreaticobiliary duct diseases with single-shot MR cholangiopancreatography[J]. Am J Roentgenol, 1997, 168(2):453-459.
[36] Sai JK, Suyama M, Kubokawa Y, et al. Diagnosis of mild chronic pancreatitis (Cambridge classification): comparative study using secretin injection-magnetic resonance cholangiopancreatography and endoscopic retrograde pancreatography[J]. World J Gastroenterol, 2008, 14(8):1218-1221.
[37] Sainani NI,Conwell DL. Secretin-enhanced MRCP: proceed with cautious optimism[J]. Am J Gastroenterol, 2009, 104(7):1787-1789.
[38] Lagerlof H,Perman G. The effect of secretin injection on the serum amylase in man[J]. Acta Chir Scand, 1956, 111(1):22-28.
[39] Manfredi R, Costamagna G, Brizi MG, et al. Severe chronic pancreatitis versus suspected pancreatic disease: dynamic MR cholangiopancreatography after secretin stimulation[J]. Radiology, 2000, 214(3):849-855.
[40] Fukukura Y, Fujiyoshi F, Sasaki M, et al. Pancreatic duct: morphologic evaluation with MR cholangiopancreatography after secretin stimulation[J]. Radiology, 2002, 222(3):674-680.
[41] Matos C, Baleato S. Ducts. In:Albert L, Baert. Encyclopedia of Diagnostic Imaging[M].American:Springer-Verlag Berlin Heidelberg,2008,187-223.
[42] Wathle GK, Tjora E, Ersland L, et al. Assessment of exocrine pancreatic function by secretin-stimulated magnetic resonance cholangiopancreaticography and diffusion-weighted imaging in healthy controls[J]. J Magn Reson Imaging, 2014,39(2):448-454.
[43] Concia M, Sprinkart AM, Penner AH, et al. Diffusion-weighted magnetic resonance imaging of the pancreas: diagnostic benefit from an intravoxel incoherent motion model-based 3 b-value analysis[J]. Invest Radiol, 2014,49(2):93-100.
