重症急性胰腺炎合并胃肠功能障碍的机制研究及诊治现状
2014-08-04刘丽蕾王湘英
刘丽蕾 王湘英
重症急性胰腺炎(SAP)患者常发生胃肠动力障碍及胃肠黏膜屏障功能损害。胃肠动力障碍早期表现为胃排空减慢、十二指肠运动迟缓和麻痹性肠梗阻等[1]。既往多项研究证实SAP的严重程度及预后与早期胃肠功能障碍的程度密不可分,尽早恢复胃肠运动是阻止SAP病程危重演变的关键[2-3]。
一、病理生理学改变
肠道除了消化吸收营养功能外,还是一个独特的免疫器官,其免疫防御机制包括蠕动的驱除作用以及黏膜和黏液的机械屏障作用,肠道黏膜上还分布有丰富的sIgA、淋巴细胞等。肠蠕动对维持胃肠道的微生态平衡起着核心作用。肠道动力障碍是促使SAP病情恶化及死亡的重要原因。一方面,SAP本身可导致高代谢及高动力状态,能量及蛋白质代谢消耗增加,若胃肠道不能充分消化并吸收食物,可导致严重营养不良。另一方面,胃肠蠕动减弱或消失,肠道细菌的过度繁殖造成菌群失调,肠道去污能力减弱,肠道内细菌和毒素排泄障碍,加重胃肠道屏障功能损害,促使细菌的易位和毒素的吸收,形成菌血症。后者通过多个途径作用于肠道使肠的动力进一步降低, 甚至发生中毒性肠麻痹,最终引起SIRS及MODS的发生[4]。
改善胃肠动力可使肠腔内压力下降,胃肠道供血及组织微循环得以改善,减轻缺血、缺氧对胃肠黏膜的机械性损伤,同时避免了缺血再灌注时大量氧自由基对细胞膜的损害作用;维持正常的肠道微环境,抑制菌群失调,防止细菌及毒素易位,预防SAP合并的胰腺、胰周感染;肠道S-IgA的合成和释放能力增加,提高了黏膜免疫力[5]。再则,早期肠功能的恢复为肠内营养提供基础条件。因此控制SAP时肠道衰竭的发生对阻止疾病发展,改善SAP患者预后至关重要。
二、发病机制
SAP发生胃肠动力障碍是多种因素综合作用的结果。一般来说,胃肠动力主要受神经和内分泌两方面调节。此外,炎症状态下免疫系统激活,释放大量炎症递质参与了胃肠动力障碍的发生、发展过程。胰腺或后腹膜炎症是疾病早期最明显的原因[6]。对SAP合并胃肠动力障碍的机制研究包括炎症递质、胃肠激素分泌紊乱、PAAF的影响、微循环障碍、消化道Cajal间质细胞缺失、神经肌肉系统功能改变等方面[6-7]。
1.炎性因子:大量文献报道胃肠运动功能障碍与炎性细胞因子IL-1、IL-6及TNF-α密切相关。Hierholzer等[8]报道,炎性细胞浸润小肠肌层后,伴随IL-6和粒细胞集落刺激因子的产生,肠道运动功能减弱。Natale等[9]发现,给予大鼠IL-1、IL-6 时可引起大鼠结肠黏膜离子转运参数变化,影响结肠运动的生理模式和传感反射,使神经传递发生改变,平滑肌直接的收缩反应减少,从而引起结肠运转功能障碍。耿东华等[10]报道,急性坏死性胰腺炎(ANP)大鼠肠血流量减少与血清IL-1β的升高同步发生,IL-lβ通过调控炎性递质引起血管痉挛、白细胞与血小板聚集、血栓形成以及损伤血管内皮细胞而加重肠缺血,造成细胞代谢障碍,ATP酶活性降低及肠黏膜结构破坏,此时肠黏膜上皮细胞再生减慢或停止,黏膜萎缩,绒毛坏死,上皮细胞与固有层分离或脱落,胃肠平滑肌电生理紊乱。Ohama等[11]证实IL-1β对肠道平滑肌收缩具有长期抑制效应,此种抑制效应是通过影响肌球蛋白球蛋白磷酸酶的非催化亚基(MYPT-1)及磷酸酶抑制蛋白-17(CPI-17)的磷酸化水平来实现的。进一步的研究发现TNF-α是介导IL-1β抑制CPI-17表达及磷酸化的关键因子,包括IL-1β在内的其他致炎因子均通过TNF-α的上调来抑制胃肠道平滑肌收缩。TNF-α和IL-1又可引起一氧化氮合成酶活性增强,产生NO舒张平滑肌导致胃肠动力异常。
2.胃肠激素:胃肠激素是由胃肠道黏膜上散在分布的内分泌细胞分泌的高效能生物活性物质,是胃肠动力的主要调控因素,其主要功能是与神经系统一起通过旁分泌、自分泌、神经分泌等方式,共同作用于胃肠道的平滑肌细胞、神经细胞和内分泌细胞,调节消化器官的分泌、运动和吸收,使之成为一个协调的整体[12]。胃肠激素的作用途径包括通过血液循环以内分泌形式直接作用于胃肠平滑肌细胞相应受体参与调控;经神经途径,以神经递质或神经调质形式作用于中枢神经系统或肠神经系统,参与调控。作用方式包括蠕动的调节;消化间期移行性复合运动波(MMC)调节;胃肠平滑肌活动调节;胃肠括约肌调节[13]。
Wang等[7]发现胰腺炎患者全结肠及各节段结肠(主要是左和右半结肠)运输时间均较健康对照组明显延长,且两组的血清促胃动素(MTL)、血管活性肠肽(VIP)和胆囊收缩素(CCK)的浓度有显著差异,因此认为SAP患者常存在胃肠动力障碍。其机制可能是胃肠激素变化的综合效应导致全结肠转运过程减慢,最终发生胃肠动力紊乱。MTL主要由十二指肠和近端空肠黏膜内的M细胞分泌,可兴奋胃和小肠平滑肌细胞膜上的胃动素受体,收缩平滑肌。MTL还可通过神经途径起作用。最新研究证明,胃动素受体广泛表达于人十二指肠和结肠内的神经元。MTL可先作用于迷走神经上的受体,由迷走传入神经传送到下丘脑,通过翻译和整合再下传到迷走神经,促进乙酰胆碱释放介导兴奋运动神经元,启动消化间期移行性复合运动(MMC),从而实现对胃肠道的各种生理活动的调节[14]。将MTL灌注于清醒狗局部空肠动脉,可引起MMCⅢ相收缩,抗MTL血清可阻断这一作用[15]。Jonsson等[16]报道胃排空延迟患者,MMCⅢ期减少或缺失;各时相血浆胃动素水平均明显低于正常并缺乏胃动素分泌高峰。VIP主要由胰腺、肠道NANC神经元释放,存在于黏膜下及肌间神经丛,是抑制胃肠运动的主要神经递质之一,在胃肠道含量最高。它具有松弛消化道括约肌、抑制胃排空、抑制小肠运动、参与胃放射性松弛和结肠扩张的作用[17]。小剂量VIP能显著改善ANP大鼠肠微循环血量,降低血清TNF-α、IL-1β水平,减轻肠黏膜损伤[18];VIP浓度在500 pmol·kg-1·min-1以上可以明显抑制MMC,而VIP抗体能阻断电刺激和迷走神经反射所引起的胃肌条收缩;再次,VlP对胃肠动力的作用还涉及肠肌层和黏膜下层的神经元,导致纵行平滑肌收缩增加。VIP抑制胃肠动力的作用可能是通过刺激Ca2+的转运实现的[19]。Wang等[20]使用传统针灸方法可使急性胰腺炎患者结肠转运时间缩短,其机制与降低血浆VIP浓度有关。
另外,近10年来发现胃泌素、胆囊收缩素、内皮素、P物质及生长激素等胃肠道激素与胃肠道运动功能的紊乱密切相关,然而其具体机制尚不明确,还有待于深入研究探讨。
3.一氧化氮:NO是一种抑制性NANC神经元传递介质,在一氧化氮合酶(NOS)介导下形成的。人体胃肠道组织中均有NOS的分布,在胃排空的肠壁机械感受器和化学感受器的反馈调控中发挥重要作用[21]。NO具有神经毒作用,过量的NO可上调cGMP水平,耗竭神经元细胞的能量储备,造成肌间神经、黏膜下神经元损伤,使消化道的神经支配作用出现异常。NO能神经的紊乱可能造成正常兴奋与抑制的失衡,导致胃肠动力异常,应用NOS抑制剂可消除压力诱导的胃容受性舒张,说明NO能诱导胃肠道舒张,抑制胃的运动[22]。Wiest等[23]证实高浓度NO可抑制ATP 形成,促进氧自由基产生,增大肠上皮间隙,损害肌动蛋白骨架,导致胃肠收缩障碍及细菌易位。Barocelli等[24]通过夹闭及再开放小鼠肠系膜上动脉造成肠道的缺血再灌注损伤,发现胃及小肠蠕动明显延长,同时伴随NO 水平及中性粒细胞浸润显著上升。而iNOS 基因敲除的小鼠及应用选择性iNOS抑制剂能预防缺血再灌注损伤引起的胃肠动力减慢。近年来的研究还进一步论证了NO在对MMC的调控中也起到极其重要作用。现已发现神经型的NOS在神经末梢中与VIP共存肌间神经丛和黏膜下神经丛。有学者认为神经活动中神经末梢释放的NO刺激VIP的释放, 表明VIP的释放有赖于NO的形成[17,22,24]。
4.胰腺炎相关腹水:在胆石症、酗酒、暴饮暴食等众多诱因下通过胃酸、胃泌素和迷走神经的作用使胰腺分泌增加,同时十二指肠Oddis括约肌痉挛,胰管排泄不畅,胰管内压增高致腺泡破裂,胰液溢出至腹腔,导致血管扩张、通透性增高,致腹腔脏器充血、水肿、渗出。另外,胰酶作用于组织细胞后的毒性产物诸如肿瘤坏死因子( TNF) 、白介素( IL) 等炎性细胞介质释放入血扩张内脏毛细血管并损伤毛细血管内皮细胞导致血管通透性增加而引起液体渗漏到组织间隙即毛细血管渗漏综合征(systemic cap illary leakage syndrome,SCLS),促使血浆成分进入腹腔产生大量胰腺炎相关性腹水(pancreatitis associated ascetic fluid, PAAF)[25]。
腹水中含大量消化酶、血管活性物质、坏死组织及其崩解产物。腹腔内炎性渗液积聚、胃肠道及腹膜进行性水肿可导致麻痹性肠梗阻。另外,腹水中这些毒性物质可直接刺激肠系膜根部神经及胃肠道组织,加速肠上皮细胞凋亡,使胃肠黏膜通透性增加。PAAF还可导致腹内压(IAP)急剧升高,甚至发生ACS,在腹腔内限制了肠道的运动导致肠内容物排出不畅,使肠系膜动脉、肝动脉、小肠黏膜、肝脏微循环及门静脉血流均减少,胃肠黏膜和黏膜下低灌注及其后的再灌注损伤,导致组织氧张力降低、无氧代谢、酸中毒、氧自由基和细胞因子释放,引起严重胃肠麻痹、肠动力障碍、肠梗阻,并造成多器官系统的进一步损害[26-27],导致临床上出现较剧烈的腹胀和腹痛症状,引起肠黏膜屏障破坏及胃肠动力障碍。胃肠动力障碍可加重肠屏障功能破坏,加重肠源性内毒素血症,使全身炎症反应失控[28]。PAAF除了对细胞的直接毒性作用外,还可干扰炎症反应的内源性调控机制[25]。Wang等[29]证实,TNF-α、IL-6 mRNA在PAAF中过度表达,且与腹水中溶质的浓度呈剂量依赖性,表明PAAF通过干扰炎性反应和抗炎反应通路上调促炎因子,加剧了急性炎性反应。Ramudo等[30]认为,PAAF通过活化介导核因子-κB参与腺泡细胞分泌TNF-α。PAAF中的TNF-α、IL-1、IL-6还可作用于其血管内皮细胞,使其血栓调节蛋白活性降低,加重缺血和血栓形成,还激活炎性细胞,增加NO与氧自由基释放,直接损伤肠黏膜。方向等[31]以PAAF诱导的SD大鼠肠损伤模型为研究对象,观察到实验组血清LPS、TNF-α、WBC,呼吸频率,肠系膜淋巴结的细菌易位率,肠黏膜损伤程度均较对照组增高,ATP酶活性显著降低。刘殿刚等[32]研究发现,PAAF直接作用于离体肠管,可明显降低肠管的收缩幅度并抑制肠管的运动频率,这种抑制强度与腹水所含溶质的浓度呈正相关;同时还看到反映肌电活动指标的慢波频率和振幅明显降低,慢波频率紊乱发生的百分比明显增加。PAAF注射入健康大鼠24 h后,小肠肌间神经丛和黏膜下层非肾上腺非胆碱能(NANC)神经元NOS表达增加、活性增强,进而产生大量NO,引起胃肠电生理紊乱,抑制胃肠运动。NOS抑制剂LNNA可逆转20%的PAAF对肠管运动的抑制作用。
另外,神经、内分泌、炎症因子可相互作用,促炎症递质与激素可双向调节。一般情况下,激素与前炎症递质处于恰当的平衡中,当PAAF中的大量毒性物质吸收入血时平衡被打破, 引起激素水平异常, 激素与炎症因子比率发生变化, 进而产生内分泌的抵抗,进一步改变激素水平。 同时激素变化也可以改变炎症因子水平,内环境稳态发生改变[33]。
三、临床诊断
对胃肠动力障碍患者的早期诊断将有益于SAP患者的临床治疗,提高SAP治愈率。胃动力检测方法应尽可能合乎生理并具有非侵入性、无放射性、准确、可重复性好、容易操作、低成本等特点。目前在临床上应用较多的方法有:(1)临床症状观察:SAP患者发生胃肠功能障碍时可在原发病的基础上出现腹痛、腹胀、腹泻或便秘、肛门排气排便停止或减少、下消化道出血等,同时常伴有消化、吸收功能障碍,出现不能耐受肠内营养等症状。(2)体征监测:发生胃肠功能障碍的患者在早期便可出现消化道体征如肠鸣音减弱或消失等。杨广印等[34]从药效学方面证实了肠鸣音与胃肠运动的相关性,并认为肠鸣音是一种在自然条件下记录胃肠运动的可行办法。肠鸣音听诊具有无创伤、操作简便、患者依从性好且不影响患者生理状况的优点,是临床和科研上常用的检测胃肠动力的方法。(3)胃电描记:胃平滑肌始终存在电活动,控制胃平滑肌的收缩和舒张,了解胃电活动也是检查胃运动功能的主要方法。上世纪50年代首次报道应用体表胃电记录技术,即胃电图(EGG)。它是一种非侵入性检查方法,因操作简单、准确性强、可重复性和易被接受而得到认可。其操作是将电极放置在患者上腹体表,记录空腹和餐后的胃电慢波活动变化。(4)胃肠传输试验:是应用于胃肠动力研究方面最经典的技术和方法。目前是通过口服一定数量的造影剂或不显影的标志物后,以不同时间消化道内标志物的残留数目或其半数排空时间反映胃肠排空情况。(5)肠道气体定量分析(gas volume score,GVS):将研究对象数字化X线平片输入计算机,用图像处理软件(photoshop7.0)在左右髂前上嵴垂直相交于第10胸椎下缘水平线连接线、耻骨联合上缘水平线形成的矩形框内,标出肠内气体边缘,计算气体容积积分(GVS),即肠气范围像素点占整个矩形框像素点的比例。AP早期可通过GVS测定发现麻痹性肠梗阻征象,即胃、小肠、结肠充气,甚至腹部呈广泛的透亮影,能客观地对胃肠动力进行评估。同时,方便、快捷、费用低廉、非侵入性是其主要优点。
此外,还有超声检查、核素检查、胃肠测压、胶囊内镜、乳果糖呼氢试验等。这些方法还处于研究阶段,临床应用和推广还有待进一步研究。
四、评分
胃肠功能对胰腺炎的影响在既往的多项研究中已被证实,然而对胃肠功能的评估尚缺乏一套完整的评分系统,从而限制了其在临床研究中的发展。Sun等[35]根据Reintam的危重患者的胃肠功能衰竭评分(gastrointestinal failure,GIF)[4]为SAP患者设计了一套改良的胃肠功能衰竭评分(modified gastrointestinal failure score ,iGIF;表1)。改良的GIF评分能更好地评估SAP患者的胃肠功能,另外,GIF评分、SOFA评分及APACHEⅡ评分的结合应用比某个单独的评分系统能更有效地预测SAP的预后。
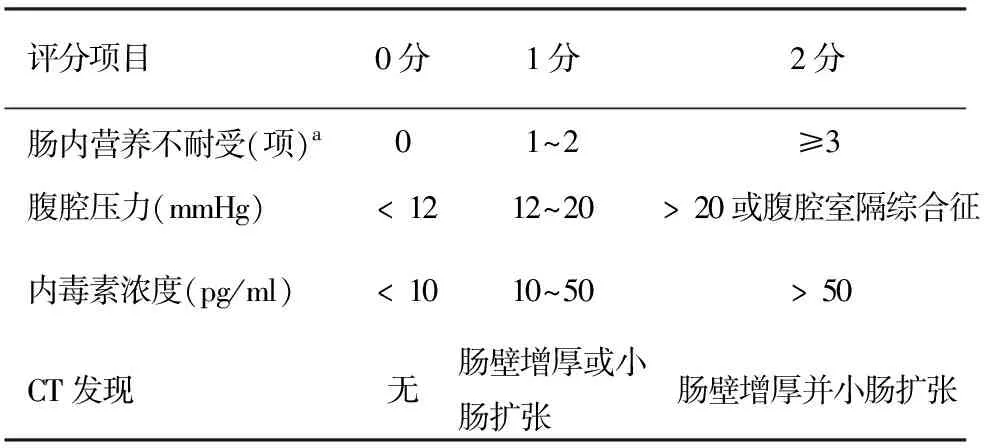
表1 改良的胃肠功能衰竭评分
五、治疗
临床发现胃肠道功能恢复越早的胰腺炎患者预后也越佳,肠道功能障碍的合理治疗是改善AP预后的关键。
1.胃肠道促动力剂:(1)促进胃肠肌间神经丛乙酰胆碱释放的药物,如西沙必利;(2) 胆碱能拟似剂,如贝胆碱;(3)多巴胺受体阻滞剂,如吗丁啉、胃复安;(4) 胆碱酯酶抑制剂,如新斯的明;(5)胃动素受体激动剂,如红霉素及其衍生物;(6)生长抑素及其类似物,如奥曲肽。
2.针灸:针刺足三里等穴位可促进胃肠蠕动。王新宇等[36]将94例AP患者分为电针治疗组(56例)和对照组(38例),结果显示电针能显著增强AP患者的胃肠动力,但其改善AP胃肠动力紊乱的机制是否与对胃肠激素的调节有关尚不明确。
3.中药疗法:口服泻下性药物,如硫酸镁、甘露酵及中药大黄、芒硝等(清胰汤的主要成分亦为大黄)能明显促进胃肠蠕动,是目前临床较常用的方法。使用上述药物灌肠后可促进结肠蠕动。侯冰宗等[37]将36例SAP患者随机分为清胰汤灌肠组和对照组,发现两组临床指标及血清MTL、CCK、VIP浓度变化的比较有显著性差异,清胰汤保留灌肠治疗SAP的疗效显著, 其作用机制可能与调节机体中胃肠激素(MTL、CCK、VIP)的水平有关。
4.补充益生菌:补充外源性益生菌,能抑制肠道病源菌的生长,维护肠道菌群之间平衡并减少细菌易位,保护胃肠道黏膜屏障。Besselink等[38]设计的双盲多中心随机对照试验将200名AP患者随机分为益生菌组和安慰剂组,结果发现益生菌治疗组的感染并发症发生率较安慰剂组降低30%~50%。证实早期肠内应用益生菌可减少感染并发症的发生率,控制全身炎症反应。
5.适时肠内营养:SAP患者为避免刺激胰液分泌常需禁食,但长期胃肠外营养可损伤肠黏膜屏障功能, 诱发细菌易位,掌握好肠内营养时机对肠道功能恢复具有重要意义。目前主张早期肠内营养。肠黏膜的新陈代谢能量主要来源于肠道, 肠内营养不仅能满足胰腺炎治疗的生理要求而且能维持肠道的正常生理状态,从而保护肠黏膜屏障, 防止细菌和内毒素易位。 Kaushik等[39]发现中远端空肠置管给营养元素可避免刺激胰液分泌,起到更好的肠内营养的效果。
6.穿刺引流腹水:及时处理PAAF可以减少毒性物质的产生,从而减轻胃肠道损伤的程度。Delattre等[40]发现B超下腹腔置管引流能使SAP患者腹内压明显降低,胃肠道功能恢复时间缩短,且ARDS发生例数减少,因而住院时间较短,病死率也相对较未置管引流患者低。B超或CT引导下经皮置管引流术已成为治疗SAP合并PAAF的微创治疗代表[41]。局麻下腹腔置管引流操作简便易行,相对于传统开腹手术来说,创伤要小得多,可床旁进行,适应证及安全性广,患者依从性好,几乎适应于所有胰腺炎并腹水患者。
五、展望
胃肠动力障碍是SAP常见的临床表现,纠正肠道功能障碍是治疗SAP的重要环节,对SAP的病程和预后有着重要的影响。随着研究的深入,引起胃肠动力障碍的机制逐步阐明,为临床治疗提供了更多的新思路。但具体到参与其中的细胞、分子及相互间的作用机制仍有许多不明确之处, 有待深入地研究与探讨。有效改善胃肠动力可以促进疾病的恢复,但目前还没找到一种特效疗法,临床上常多种方案联合使用,目的是提高疗效、减少并发症、改善患者的预后。其治疗方法尚有待进一步的临床对照研究。
参 考 文 献
[1] Seerden TC, De Man JG, Holzer P, et al. Experimental pancreatitis disturbs gastrointestinal and colonic motility in mice: effect of the prokinetic agent tegaserod. Neurogastroenterol Motil, 2007, 19(10): 856-864.
[2] Wang G, Wen J, Xu L, et al.Effect of enteral nutrition and ecoimmunonutrition on bacterial translocation and cytokine production in patients with severe acute pancreatitis. J Surg Res, 2013, 183(2):592-597.
[3] Reintam Blaser A, Poeze M, Malbrain ML, et al.Gastrointestinal symptoms during the first week of intensive care are associated with poor outcome: a prospective multicentre study. Intensive Care Med, 2013, 39(5): 899-909.
[4] Ohama T, Hori M, Ozaki H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: how smooth muscle contraction is reduced? J Smooth Muscle Res, 2007, 43(2): 43-54.
[5] Herbert MK, Holzer P.Standardized concept for the treatment of gastrointestinal dysmotility in critically ill patients-current status and future options. Clin Nutr, 2008, 27(1): 25-41.
[6] 刘丽, 高峻,李兆申. 重症急性胰腺炎时胃肠动力障碍机制的研究进展[J]. 中华胰腺病杂志, 2009, 9(1): 70-72.
[7] Wang X, Gong Z, Wu K, et al.Gastrointestinal dysmotility in patients with acute pancreatitis. J Gastroenterol Hepatol, 2003, 18(1): 57-62.
[8] Hierholzer C, Kalff JC, Chakraborty A, et al. Impaired gut contractility following hemorrhagic shock is accompaied by IL-6 and G-CSF production and neutrophil infiltration. Dig Dis Sci, 2001, 46(2): 230-241.
[9] Natale L, Piepoli AL, De Salvia MA, et al. Interleukins 1 beta and 6 induce functional alteration of rat colonic motility: an in vitro study. Eur J Clin Invest, 2003, 33(8): 704-712.
[10] 耿东华,李胜军,刘金钢,等. 尿激酶对大鼠重症急性胰腺炎肠道微循环障碍的作用[J]. 中国医科大学学报, 2007, 36(5): 542-544.
[11] Ohama T, Hori M, Momotani E, et al. Intestinal inflammation downregulates smooth muscle CPI-17 through induction of TNF-alpha and causes motility disorders. Am J Physiol Gastrointest Liver Physiol, 2007, 292(5): G1429-G1438.
[12] 卢义展,王湘英. 重症急性胰腺炎胃肠动力变化机制的研究进展[J]. 中华肝胆外科杂志, 2010, 16(6): 476-480.
[13] Jonsson BH, Theorell T, Gotthard R, et al. Gastrin, cholecystokinin, and somatostatin in a laboratory experiment of patients with functional dyspepsia. Psychosom Med, 1998, 60(3): 331-337.
[14] Miyano Y, Sakata I, Kuroda K, et al. The role of the vagus nerve in the migrating motor complex and ghrelin-and motilin-induced gastric contraction in suncus. PLoS One, 2013, 8(5): e64777.
[15] 周吕. 电针胃经穴对狗胃肠移行性复合运动及脑肠肽释放的作用. 科学通报, 2000, 45(22): 2419-2426.
[16] Jonsson BH, Uvras-Moberg K, Theorell T, et al. Gastrin, cholecystokinin, and somatostatin in a laboratory experiment of patients with functional dyspepsia[J]. Psychosom Med, 1998, 60(3): 331-337.
[17] Van Geldre LA, Lefebvre RA. Interaction of NO and VIP in gastrointestinal smooth muscle relaxation[J]. Curr Pharm Des, 2004, 10(20): 2483-2497.
[18] Zhongkai L, Jianxin Y, Weichang C. Vasoactive intestinal peptide promotes gut barrier function against severe acute pancreatitis[J]. Mol Biol Rep, 2012, 39(4): 3557-3563.
[19] Hagen BM, Bayguinov O, Sanders KM. VIP and PACAP regulate localized Ca2+transients via cAMP-dependent mechanism[J]. Am J Physiol Cell Physiol, 2006, 291(2): C375-C385.
[20] Wang XY, Shi X, He L. Effect of electroacupuncture on gastrointestinal dynamics in acute pancreatitis patients and its mechanism[J]. Zhen Ci Yan Jiu, 2007, 32(3): 199-202.
[21] 刘颖,林中,胡琼花,等. 伴有胃肠动力障碍的重症急性胰腺炎大鼠结肠肠肌间神经丛一氧化氮合成酶神经元的变化[J]. 第三军医大学学报, 2010, 32(3): 274-277.
[22] Lin Z, Liu Y, Zheng Q, et al. Increased proportion of nitric oxide synthase immunoreactive neurons in rat ileal myenteric ganglia after severe acute pancreatitis[J]. BMC Gastroenterol, 2011, 11: 127.
[23] Wiest R, Cadelina G, Milstien S, et al.Bacterial translocation up-regulates GTP-cyclohydrolase I in mesenteric vasculature of cirrhotic rats[J]. Hepatology, 2003, 38(6): 1508-1515.
[24] Barocelli E, Baliabeni V, Ghizzardi P, et al. The selective inhibition of inducible nitric oxide synthase prevents intestinal ischemia-reperfusion injury in mice[J]. Nitric Oxide, 2006, 14(3): 212-218.
[25] Gutierrez PT, Foich-Puy E, Bulbera O, et al. Oxidised lipids present in ascitic fluid interfere with the regulation of the macrophages during acute pancreatitis, promoting an exacerbation of the inflammatory response[J]. Gut, 2008, 57(5): 642-648.
[26] Ke L, Ni HB, Sun JK, et al. Risk factors and outcome of intra-abdominal hypertension in patients with severe acute pancreatitis[J]. World J Surg, 2012, 36(1): 171-178.
[27] Ball CG, Kirkpatrick AW, McBeth P. The secondary abdominal compartment syndrome: not just another post-traumatic complication[J]. Can J Surg, 2008, 51(5): 399-405.
[28] Sugimoto M, Takada T, Yasuda H, et al. The lethal toxicity of pancreatic ascites fluid in severe acute necrotizing pancreatitis[J]. Hepatogastroenterology, 2006, 53(69): 442-446.
[29] Wang J, Xu P, Hou YQ, et al. Pancreatitis-associated ascitic fluid Induces proinflammatory cytokine expression in THP-1 cells by inhibiting anti-inflammatory signaling[J]. Pancreas, 2013, 42(5): 855-860.
[30] Ramudo L, Manso MA, De Dios I. Biliary pancreatitis-associated ascitic fluid activates the production of tumor necrosis factor-alpha in acinar cells[J]. Crit Care Med, 2005, 33(1): 143-148.
[31] 方向,程芳川,陈玉祥,等. PAAF对大鼠血清TNF-α、内毒素及胃黏膜损伤的影响[J]. 肝胆胰外科杂志, 2009, 21(5): 363-365.
[32] 刘殿刚,孙家邦,李非,等. 胰腺炎相关腹水对大鼠胃肠动力的影响[J]. 北京医学, 2005, 27(9): 546-549.
[33] 刘丽, 高峻,李兆申. 重症急性胰腺炎时胃肠动力障碍机制的研究进展[J]. 中华胰腺病杂志, 2009, 9(1): 70-72.
[34] 杨广印,胡翔龙,陈凌,等. 肠鸣音与胃肠运动相关性的初步观察[J]. 福建中医学院学报, 2009, 19(3): 41-43.
[35] Sun JK, Li WQ, Ni HB, et al. Modified gastrointestinal failure score for patients with severe acute pancreatitis[J]. Surg Today, 2013, 43(5): 506-513.
[36] 王新宇, 石现,何磊. 电针对急性胰腺炎患者胃肠动力的影响及其机制研究[J]. 针刺研究, 2007, 32(3): 199-202.
[37] 侯冰宗.石磊,房思炼,等.清胰汤保留灌肠对急性重症胰腺炎患者胃肠动力学变化机制的研究.中山大学学报·医学科学版, 2008,29(8):20.22
[38] Besselink MG, Timmerman HM, Buskens E, et al. Probiotic prophylaxis in patients with predicted severe acute pancreatitis (PROPATRIA): design and rationale of a double-blind, placebo-controlled randomised multicenter trial [ISRCTN38327949][J]. BMC Surg, 2004, 4: 12.
[39] Kaushik N, Pietraszewski M, Holst JJ, et al. Enteral feeding without pancreatic stimulation[J]. Pancreas, 2005, 31(4): 353-359.
[40] Delattre JF, Levy Chazal N, Lubrano D, et al. Percutaneous ultrasound-guided drainage in the surgical treatment of acute severe pancreatitis[J]. Ann Chir, 2004, 129(9): 497-502.
[41] Chen H, Li F, Sun JB, et al. Abdominal compartment syndrome in patients with severe acute pancreatitis in early stage[J]. World J Gastroenterol, 2008, 14(22): 3541-3548.
