奥曲肽联合ERCP+留置内支架对胰头癌治疗效果的临床分析
2014-08-04郑丹范彦黄晓东廖宇圣张姮王萍吴杰
郑丹 范彦 黄晓东 廖宇圣 张姮 王萍 吴杰
胰腺癌是消化系统常见的恶性肿瘤,预后差,总体5年生存率1%~4%[1],1年生存率10%左右,中位生存期3~4个月[2]。80%以上的胰腺癌患者在诊断时已是晚期,且不能行手术切除治疗[3]。胰头癌占全部胰腺癌的60%~70%,对并发阻塞性黄疸的胰头癌患者减黄治疗及综合治疗是临床关注的焦点。ERCP+留置内支架无疑是胰腺癌导致的阻塞性黄疸的一线治疗方案[4],但ERCP+留置内支架本身并不能阻止肿瘤的生长,一些由肿瘤本身引起的症状并不能减轻或解除。奥曲肽是一种人工合成的天然生长抑素(SS)的8肽衍生物,能抑制神经内分泌肿瘤及非神经内分泌肿瘤的生长,亦能抑制胰腺分泌及胰腺肿瘤的生长[5]。为此,本研究联合应用奥曲肽和ERCP+留置内支架术治疗并发阻塞性黄疸的胰头癌患者,观察其疗效。
资料与方法
一、临床资料
收集2006年1月至2011年12月武汉市中心医院消化内科收治的99例并发阻塞性黄疸的胰头癌患者资料。所有患者均经临床表现、影像学检查、肝功能及肿瘤标志物CA19-9检测等明确诊断,且不能或不愿意接受外科治疗及肿瘤放、化疗治疗。采用随机、平行对照的方法,使用DPS统计软件的随机分组功能,制定样本数为99例,将入选患者分为对照组和联合治疗组(治疗组)。
二、肿瘤分期
依据2011《NCCN胰腺癌临床实践指南》[6],将肿瘤分为5期。即按照TNM分期,并根据影像学检查的原发肿瘤情况、淋巴结转移及远处其他脏器转移情况进行分期。
三、治疗方法
对照组患者仅采用ERCP+留置内支架(金属支架)行减黄治疗,治疗组患者在ERCP+留置内支架(金属支架)治疗同时给予奥曲肽(善宁)0.1 mg皮下注射,每日2次,连续注射90 d以上,直至病死。
四、观察指标
所有病例均每月复查肝功能(胆红素),记录患者术前及术后恶心、呕吐、腹痛、腹泻、纳差等症状的发生情况,注射部位皮肤疼痛及术后胰腺炎的发生率,患者术后平均生存时间。
五、统计学处理
结 果
一、一般情况
对照组51例,其中男性27例,女性24例,年龄46~85岁,平均(71±10)岁,Ⅰ、Ⅱ、Ⅲ、Ⅳ期肿瘤分别有3、32、11、5例,血清总胆红素98.3~495.2 μmol/L,平均(253.3±103.5)μmol/L,直接胆红素82.4~354.2 μmol/L,平均(182.4±80.3)μmol/L。治疗组48例,其中男性25例,女性23例,年龄48~86岁,平均(72±10)岁,Ⅰ、Ⅱ、Ⅲ、Ⅳ期肿瘤分别有2、30、13、3例,血清总胆红素103.3~483.5 μmol/L,平均(258.5±104.7) μmol/L,直接胆红素85.9~356.4 μmol/L,平均(178.6±78.4)μmol/L。两组患者年龄、血胆红素水平、胰腺癌分期差异均无统计学意义。由于所有患者未做手术,也未行胰腺穿刺活检,故没有获得肿瘤的病理检查资料。
二、治疗前后患者血胆红素水平的变化
对照组治疗后6例患者再次出现黄疸,考虑支架阻塞,其中3例患者再次行ERCP+留置内支架后黄疸消退,另3例患者未再次行支架置入术,均在一个月左右病死。其余45例患者胆红素均下降至基本正常(血清总胆红素低于正常值的2倍)。治疗组患者治疗后血胆红素均下降至基本正常,且直至患者病死前无1例出现支架阻塞。
三、治疗前后消化道症状改善情况
治疗前两组患者恶心、呕吐,腹痛,纳差发生率的差异均无统计学意义,治疗后两组患者恶心、呕吐,腹痛,纳差发生率均较治疗前明显下降,且治疗组的下降显著优于对照组,差异均有统计学意义(P值均<0.05,表1)。
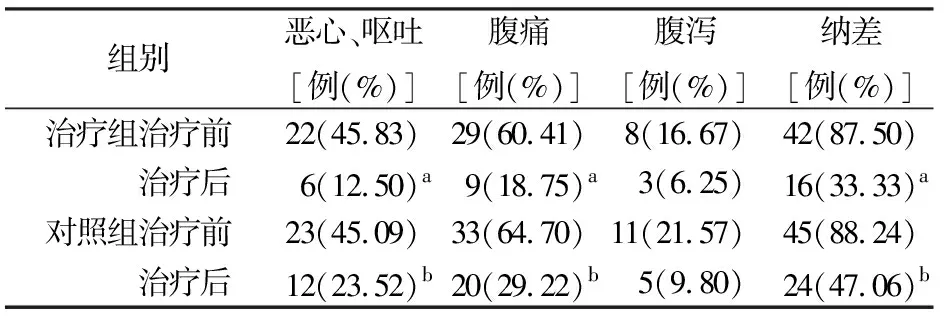
表1 治疗前后两组消化道症状发生率比较
四、并发症
对照组有3例术后发生急性胰腺炎,治疗后缓解。治疗组无1例术后发生胰腺炎,但有3例注射部位发生皮肤疼痛,经更换注射部位后疼痛缓解,2例在开始几次注射奥曲肽后有恶心症状,但能自行缓解,后来长期注射时并无任何不适。
五、患者平均生存时间
99例患者均获跟踪随访。对照组患者平均生存时间为(7.3±5.3)个月,中位生存时间为7.3个月。治疗组患者平均生存时间为(14.4±8.7)个月,中位生存时间为12.3个月。两组差异有统计学意义(t=6.53,P<0.05)。
讨 论
60%~70%胰腺癌发生于胰头部,随着肿瘤的增大,常常堵塞胰管和胆总管,导致胆囊肿大、梗阻性黄疸等症状,易获得诊断。对于可手术切除治疗的患者应积极鼓励患者行手术治疗,因早期胰腺癌手术治疗的获益最大,中位生存时间较长。对于不能手术切除的胰头癌,置入胆总管支架减轻黄疸无疑是改善肝功能的最好办法,已经成为一线的治疗方案[7]。
Nguyen-Tang等[8]和Espinel等[9]的研究结果均显示ERCP+留置内支架减黄治疗能减轻黄疸、改善患者症状。中晚期胰腺癌由于胆胰管狭窄或梗阻可致疼痛,或压迫十二指肠造成梗阻也可造成疼痛,内支架的植入可有效缓解疼痛。内引流术对患者的生理改变较小,避免了外引流造成的胆汁丢失所引起的一系列并发症,同时改善患者的生活质量,并延长生命[10]。本研究结果显示,通过ERCP+支架置入术治疗胰腺癌并阻塞性黄疸患者后血胆红素水平均下降至基本正常水平,并且无严重不良反应,与文献报道的结果一致。当然,一些由肿瘤本身引起的症状则不能通过内置支架来解决。例如有些疼痛是由于癌肿沿神经鞘浸润或压迫腹腔神经丛引起的顽固腹痛和腰背痛,这些腹痛是ERCP+留置内支架引流所不能缓解的,需要辅助麻醉镇痛药或神经阻滞或切除术来解决。
吉西他滨的出现是胰腺癌化疗的一个进步。Storniolo等[11]进行的一项多中心、3 000例晚期胰腺癌的临床研究表明,吉西他滨可以改善晚期胰腺癌患者的生活质量及延长生存期,但其单药的有效率只有13%~18%[12],且化疗药物多少有不良反应,如肝毒性、血细胞减少、乏力、消化道症状等,肿瘤患者耐受性差。
近年来生长抑素(SS)及其类似物对肿瘤细胞增殖的抑制作用日益受到关注。张群华等[13]报道,SS能抑制胰腺癌的生长,促进细胞的凋亡,其作用呈浓度依赖性。奥曲肽是一种人工合成的天然SS的8肽衍生物。Shimon等[14]研究报道,奥曲肽可明显抑制胰腺癌细胞的生长,促进其细胞凋亡,提高胰腺癌患者的中位生存期。且奥曲肽的不良反应小,患者耐受性高。奥曲肽对肿瘤生长的抑制作用机制可能是:(1)通过抑制DNA合成和细胞复制直接抑制肿瘤生长[15];(2)间接抑制肿瘤生长因子的合成[16];(3)抑制血管生成,间接控制肿瘤的发展和转移[17-18]。
本研究在ERCP+支架置入术基础上给予皮下注射奥曲肽的方法治疗胰腺癌并阻塞性黄疸患者,治疗后患者临床症状的改善优于未用奥曲肽的对照组,术后未出现支架堵塞的情况,无1例发生急性胰腺炎,中位生存时间达12.3个月,明显高于对照组7.3个月,即使是Ⅳ期患者治疗后的平均生存时间亦达4.1个月,较文献报道不治疗患者的1.3个月的生存时间明显延长,表明奥曲肽联合ERCP下内支架植入术治疗伴阻塞性黄疸的胰头癌患者能有效改善患者生活质量,延长生存时间,是一种临床上可操作性强、患者接受度高、疗效确切的治疗方法。
参 考 文 献
[1] Minder I, Hoogenveen RT, van Genugten M, et al. Smoking cessation would substantially reduce the future incidence of pancreatic cancer in the European Union[J]. Eur J Gastroenterol Hepatol, 2002, 14(12):1343-1353.
[2] Goldstein D, Carroll S, Apte M, et al. Modern management of pancreatic carcinoma[J]. Intern Med J, 2004, 34(8): 475-481.
[3] Li D, Xie K,Wolff R, et al. Pancreatic cancer[J]. Lancet, 2004, 363(9414): 1049-1057.
[4] Carr-Locke DL. Overview of the role of ERCP in the management of diseases of the biliary tract and the pancreas[J]. Gastrointest Endosc, 2002, 56(6): S157-S160.
[5] Anthony L, Freda PU. From somatostatin to octreotide LAR: evolution of a somatostatin analogue[J]. Curr Med Res Opin, 2009, 25(12): 2989-2899.
[6] 赵玉沛.NCCN胰腺癌治疗实践指南(2011版). National Comprobasive Concer Network, 2011:280.
[7] 王成锋. 胰腺癌的综合治疗[J]. 实用肿瘤杂志, 2009, 24(3): 209-212.
[8] Nguyen-Tang T, Binmoeller KF, Sanchez-Yague A, et al. Endoscopic ultrasound (EUS)-guided transhepatic anterograde self-expandable metal stent (SEMS) placement across malignant biliary obstruction[J]. Endoscopy, 2010, 42(3): 232-236.
[9] Espinel J, Vivas S, Muoz F, et al. Palliative treatment of malignant obstruction of gastric outlet using an endoscopically placed enteral Wallstent[J]. Dig Dis Sci, 2001, 46(11): 2322-2324.
[10] 黄卫民. 中晚期胰腺癌的姑息手术治疗[J]. 海南医学, 2008, 19(1): 35-36.
[11] Storniolo AM, Enas NH, Brown CA, et al. An investigational new drug treatment program for patients with gemcitabine: results for over 3000 patients with pancreatic carcinoma[J]. Cancer, 1999, 85(6): 1261-1268.
[12] 梁永君, 陈晓品. 吉西他滨联合多西紫衫醇治疗晚期胰腺癌的临床观察[J]. 重庆医学, 2008, 37(15): 1720-1722.
[13] 张群华, 倪泉兴, 沈兆中, 等. 生长抑素对胰腺癌生长抑制和凋亡作用的实验研究[J]. 外科理论与实践, 2002, 7(5): 352-355.
[14] Shimon I, Hadani M, Nass D, et al. Malignant bronchial carcinoid tumor metastatic to the pituitary in a thyroid carcinoma patient: successful treatment with surgery, radiotherapy and somatostatin analog[J]. Pituitary, 2004, 7(1): 51-57.
[15] Susini C, Buscail L. Rationale for the use of somatostatin analogs as antitumor agents[J]. Ann Oncol, 2006, 17(12):1733-1742.
[16] 高元平,郝卫刚,张海蓉.生长抑素及其类似物抗肿瘤作用机制研究进展[J].华西医学,2012,27(4):622-625.
[17] Lawnicka H, Stepien H, Wyczolkowska J, et al. Effect of somatostatin and octreotide on proliferation and vascular endothelial growth factor secretion from murine endothelial cell line (HECa10) culture[J]. Biochem Biophys Res Commun, 2000, 268(2):567-571.
[18] Patel PC, Barrie R, Hill N, et al. Postreceptor signal transduction mechanisms involved in octreotide-induced inhibition of angiogenesis[J]. Surgery, 1994, 116(6): 1148-1152.
