壳聚糖热裂解催化剂的筛选
2014-08-03吕衍安索掌怀
吕衍安,李 楠,索掌怀
(烟台大学化学化工学院,山东 烟台 264005)
能源问题是当今世界所面临的严峻问题.随着传统化石资源的日益枯竭,寻求新能源成为学术界及工业界所关注的热点.氢能源清洁、高效,是理想的二级能源.制氢技术是制约氢能利用的关键[1-2].目前,已研发的制氢技术主要包括:(1)基于石油、煤、天然气等化石燃料的制氢技术,占目前氢气产量的95%以上[3].这些技术需要消耗大量的不可再生资源,不适应社会的可持续发展需求.(2)以水为原料的电解或光解制氢技术.但前者耗能高,只能用于小规模制氢;而后者技术不成熟,目前尚在研究中.(3)生物质制氢技术.生物质是由光合作用产生的所有生物有机体的总称,资源非常丰富且可再生,仅每年再生的纤维素和木质素折合成能量可相当于石油年产量的15~20倍.因此,生物质制氢技术是一种符合可持续发展战略的新型制氢技术,是解决人类能源需求的和环境问题的根本途径之一[4].
生物质制氢分生物法制氢、间接转化法制氢和直接热化学法制氢等[5-6].直接热化学法制氢是将生物质在一定温度下气化热裂解或者与水蒸汽重整,得到的混合气经分离后获得氢气,该技术具有方便快捷、产氢率高等优点,被认为是最具经济与技术生命力的制氢技术.在生物质中,壳聚糖是自然界唯一的碱性多糖,是从虾蟹壳蛋白中提取的一种氨基多糖(2氨基-1,4-β葡聚糖),呈网状结构,具有良好的生物相容性和生物可降解性,且具有多种生物活性,被视为最具潜力的生物高分子,在大自然中每年生物合成量高达数千亿t,是一种取之不尽用之不竭的可再生资源[7].但壳聚糖耐热性较好,热分解温度较高,生物降解时间较长.利用壳聚糖制氢需要寻求合适的催化剂催化其分解,降低分解温度.
热分析技术是一种研究程序升温条件下固体样品热分解过程的简便方法,不仅可以获得样品的起始热分解温度、最大热分解温度和终止热分解温度,还可以进行热分解动力学研究[8-9].本文利用热分析技术快捷方便地研究了壳聚糖在金属氧化物或金属硝酸盐等催化剂存在下的热裂解过程,通过比较其热分解温度,寻找能加快壳聚糖热裂解,降低其热裂解温度的催化剂,从而为壳聚糖热裂解制氢技术提供借鉴.
1 实验部分
1.1 催化剂的制备
实验选用Al2O3,SiO2,TiO2,V2O5,Cr2O3,Fe2O3,NiO,CuO,ZnO,ZrO2,CeO2等11种氧化物.其中除Al2O3(山东铝业公司淄博氧化铝厂生产),SiO2(青岛海洋化工集团生产)为商品试剂外,其余氧化物均采用沉淀法制备.实验所用所有试剂均为分析纯.取适量金属硝酸盐固体加水溶解,滴加一定浓度NaOH溶液,调节溶液pH值至8~9,不断搅拌使金属沉淀.再经老化、过滤、洗涤、干燥、焙烧等操作后,所得样品研磨后备用.
1.2 催化剂与壳聚糖的吸附
称取6 g壳聚糖(脱乙酰度90%,青岛海汇生物科技有限公司生产),溶于350 mL 1.5%乙酸水溶液中,搅拌使其完全溶解.
称取1 g商品或自制无机氧化物固体,加入到60 mL壳聚糖溶液中,室温下搅拌使之吸附完全,通过NaOH溶液调节溶液pH值为7~8.所得固体样品经过滤、洗涤、干燥后用于热分析测试.
称取1 g硝酸盐固体,加入到60 mL壳聚糖溶液中,室温下搅拌反应24 h,并不断滴加NaOH溶液使溶液pH值保持在7~8之间,并不断搅拌,静置.所得固体样品经过滤、洗涤、干燥后用于热分析测试.
本实验共考察了以下11种硝酸盐:Mg(NO3)2,Al(NO3)3,Cr(NO3)3,Mn(NO3)2,Fe(NO3)3,Co(NO3)2,Ni(NO3)2,Cu(NO3)2,Zn(NO3)2,La(NO3)3和Ce(NO3)3,所有硝酸盐均为分析纯商品试剂.
1.3 壳聚糖的热分析
热分析研究在ZRY-2P高温综合分析仪(上海精科分析仪器有限公司)上进行.取8~9 mg样品置于热分析样品池中,以α-Al2O3作参比,在静态空气中以10 ℃/min速率由室温程序升温至800 ℃,在线纪录样品的热重(TG)、微分热重(DTG)及差热分析(DTA)曲线,研究添加无机氧化物及金属硝酸盐后壳聚糖的热裂解过程.由热分析曲线获得壳聚糖的起始分解温度Ti、最大分解温度Tm及终止分解温度Tf,再通过分析比较,得到各种添加剂对壳聚糖热裂解的催化性能.
2 结果与讨论
2.1 氧化物催化剂对壳聚糖热分解的影响
本实验首先考察了在壳聚糖中分别添加Al2O3,SiO2,TiO2,V2O5,Cr2O3,Fe2O3,NiO,CuO,ZnO,ZrO2,CeO2等11种氧化物后壳聚糖的热分解过程.图1是部分热分析谱图,由谱图给出的Ti,Tm及Tf值总结于表1中.

图1 无机氧化物掺杂壳聚糖的DTG(a)和DTA(b)曲线

表1 无机氧化物掺杂壳聚糖的热分解温度
由表1可以看出,空白壳聚糖的Ti为230.3 ℃,Tm为283.1 ℃,Tf为340.7 ℃.与空白壳聚糖的热分析相比较,大多数氧化物的加入使壳聚糖的Ti和Tm均明显升高,并不是良好的壳聚糖热裂解催化剂.唯一例外的是V2O5,虽然V2O5的加入使壳聚糖的Ti升高了8.5 ℃,但其Tm却下降了11.8 ℃,Tf也下降了44.3 ℃,表明V2O5的加入使壳聚糖的热分解速率明显加快,催化效果较好.
2.2 金属硝酸盐催化剂对壳聚糖热分解的影响
由于除V2O5以外的无机氧化物加入后,使壳聚糖的分解变得更加困难,因此考虑加入金属硝酸盐,利用壳聚糖对金属离子良好的捕获性能与配位能力来使壳聚糖在较低的温度下分解.图2为部分热分析谱图,表2给出了添加各种硝酸盐后壳聚糖的Ti,Tm及Tf值.
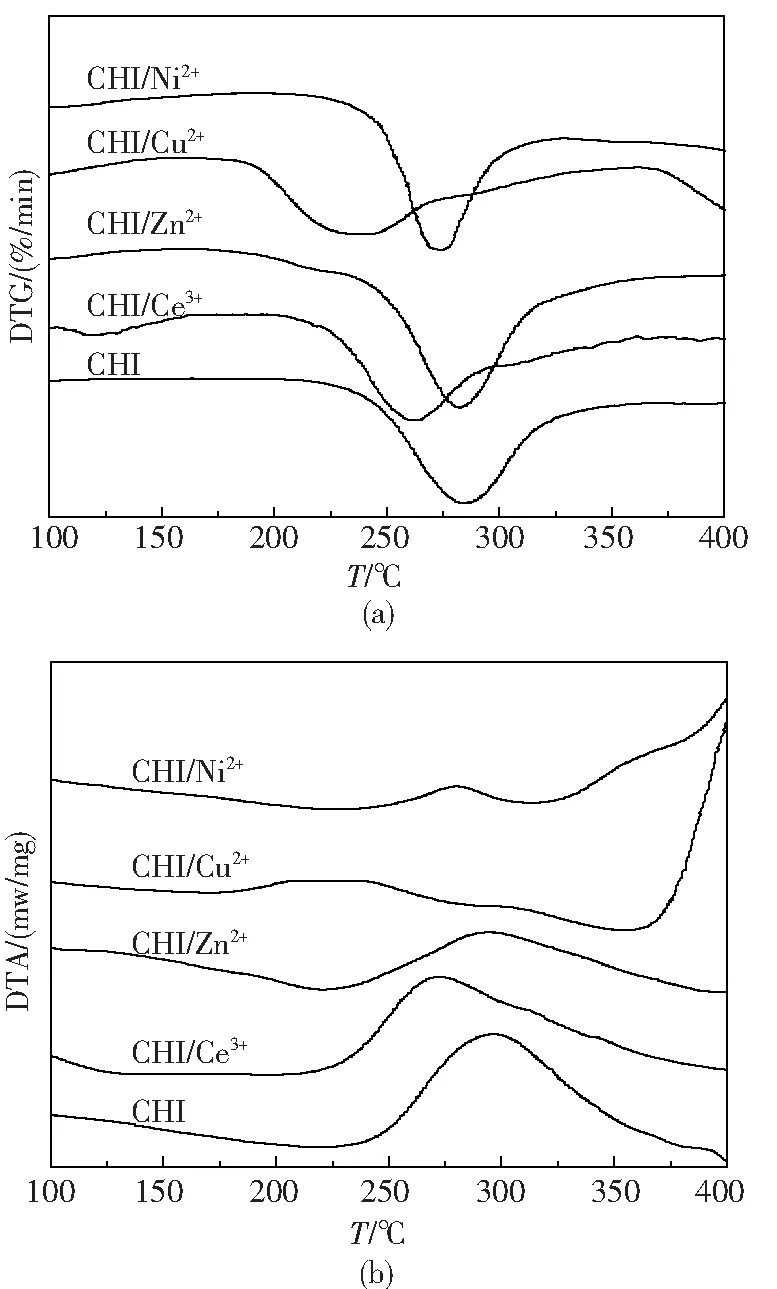
图2 金属硝酸盐掺杂壳聚糖的DTG(a)和DTA(b)曲线
由表2可以看出,与空白壳聚糖相比,加入金属硝酸盐后,壳聚糖的热分解温度普遍降低,尤其以硝酸铜的添加效果最佳,壳聚糖的Ti值由原来的230.3 ℃下降到194.8 ℃,降低35.5 ℃;Tm及Tf值也分别由原来的283.1 ℃和340.7 ℃下降为241.5 ℃和277.3 ℃,分别降低41.6 ℃和63.4 ℃,表明硝酸铜的加入使壳聚糖的热分解温度明显降低,分解速率明显加快.这可能是由于Cu2+与壳聚糖形成的配合物更容易分解所致.此外,添加硝酸镍、硝酸镧、硝酸铈等硝酸盐也能使壳聚糖的热分解温度明显降低,分解速率加快.Chattopadhyay等[10]利用热重分析研究了纸浆生物质热解制氢,发现Cu/Al2O3催化剂的引入能够明显降低其分解温度,与本研究结果一致.负载镍催化剂用于生物质气化制氢的研究也已有报道[11-12].

表2 金属硝酸盐掺杂壳聚糖的热分解温度
利用GC-950气相色谱仪(上海海欣色谱公司)分析了壳聚糖的热裂解产物,检测器为热导检测器(TCD),使用了TDX-01与Porapak Q色谱填充柱.初步实验结果显示,除氢气外,还有CO、CO2、H2O、N2、NOx、CH4等,组成较为复杂,这既与选用的催化剂有关,也与其热裂解温度及采用的气氛有关.进一步的研究正在进行中.
3 结 论
(1)在壳聚糖中加入无机氧化物,除V2O5外,大部分氧化物的加入均使壳聚糖的分解变得更加困难,热分解温度升高,热分解速率变慢.
(2)添加金属硝酸盐能够明显降低壳聚糖的热分解温度,提高其热分解速率,其中尤以硝酸铜的添加效果最佳,可望成为壳聚糖热裂解制氢过程的首选催化剂.
参考文献:

[2]Rostrup J R, Nielsen. Fuels and energy for the future: The role of catalysis [J], Catal Rev, 2004, 46(3&4): 247-270.
[3]Kothari R, Buddhi D, Sawhney R L. Comparison of environmental and economic aspects of various hydrogen production methods [J]. Renew Sus Energy Rev, 2008, 12: 553-563.
[4]Centi G, van Santen R A. Catalysis for Renewables: From Feedstock to Energy Production [C]. Weinheim: Wiley-VCH, 2007.
[5]Turner J, Sverdrupy G, Mann M K, et al. Renewable hydrogen production [J]. Int J Energy Res, 2008, 32: 379-407.
[6]李全新,袁丽霞. 可再生生物质资源制氢技术的研究进展 [J]. 石油化工,2010, 39(2): 107-115.
[7]王小红,马建标,何炳林. 甲壳素、壳聚糖及其衍生物的应用 [J]. 功能高分子学报, 1999(2): 197-201.
[8]廖卫平,索掌怀,ZrxCe1-xO2的制备及其氢氧化物前驱体的热分解动力学研究 [J]. 烟台大学学报: 自然科学与工程版, 2007, 20(4): 254-258.
[9]金明善,张宝华,刘克增,等. 热分析技术研究Zr(OH)4的热分解过程及其ZrO2相变 [J]. 化学研究,2008, 19(3): 27-31.
[10]Chattopadhyay J, Kim C, Kim R, et al. Thermogravimetric study on pyrolysis of biomass with Cu/Al2O3catalysts [J]. J Ind Eng Chem, 2009, 15(1): 72-76.
[11]de Lasa H, Salaices E, Mazumder J, et al. Catalytic steam gasification of biomass: Catalysts, thermodynamics and kinetics [J]. Chem Rev, 2011, 111: 5404-5433.
[12]Lu Youjun, Li Sha, Guo Liejin, et al. Hydrogen production by biomass gasification in supercritical water over Ni/γ-Al2O3and Ni/CeO2-γ-Al2O3catalysts [J]. Int J Hydrogen Energy, 2010, 35(13): 7161-7168.
