原发性肝癌患者肝动脉化疗栓塞术后肝功能失代偿的临床分析
2014-08-02周霖王华明艾鼎伦赵云张林枝余强杨斌彭晓明王京艳刘春梓
周霖,王华明,艾鼎伦,赵云,张林枝,余强,杨斌,彭晓明,王京艳,刘春梓
原发性肝癌患者肝动脉化疗栓塞术后肝功能失代偿的临床分析
周霖,王华明,艾鼎伦,赵云,张林枝,余强,杨斌,彭晓明,王京艳,刘春梓
目的分析原发性肝癌(PLC)患者行肝动脉化疗栓塞术(TACE)后肝功能失代偿的相关因素。方法 回顾性分析2012年4月-2012年10月在解放军302医院住院的251例行TACE治疗的PLC患者的临床资料,应用χ2检验及Logistic回归模型分析与术后肝功能失代偿有关的相关因素。结果251例PLC患者TACE术后40例(15.9%)发生肝功能失代偿。单因素分析结果表明,肿瘤大小、肿瘤Child-Pugh分级、血胆碱酯酶水平、有无门脉癌栓等因素与PLC患者TACE术后是否发生肝功能失代偿相关;而多因素分析结果表明,肿瘤Child-Pugh B级、肿瘤直径≥10cm及低胆碱酯酶是TACE术后发生肝功能失代偿的危险因素。结论对肿瘤直径≥10cm、Child-Pugh B级及低胆碱酯酶的PLC患者需谨慎行TACE治疗,避免术后肝功能失代偿的发生。
肝肿瘤;化学栓塞,治疗性;肝功能不全
原发性肝癌(primary liver cancer,PLC)是全球第5大常见癌症,位居全球恶性肿瘤死因的第3位[1-2]。由于起病隐匿、早期症状不典型,往往造成诊断困难,大多数患者在确诊时已达晚期或已远处转移,只有不到20%的患者符合手术治疗指征[3]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)已被证实能够延缓肿瘤进展和血管侵袭,并可延长患者存活期,是丧失手术机会的中晚期肝癌的首选治疗方法[4]。在我国,肝脏癌变常发生于肝硬化基础上,TACE治疗后使肝脏功能进一步受损,严重者可致肝功能衰竭。本研究对解放军302医院251例接受过TACE治疗的临床资料完整的PLC患者进行回顾性分析,探讨TACE术后肝功能失代偿的相关因素,以期更科学地细化TACE治疗适应证及规范操作程序。
1 资料与方法
1.1 临床资料 纳入2012年4月-2012年10月在解放军302医院住院治疗的PLC患者251例。所有病例均为初治,均经影像学或肝穿刺活检证实。依据巴塞罗那(BCLC)[5]肝癌分期标准确诊为PLC,其中早期91例,中期92例,进展期68例,均接受TACE治疗,患者基线数据见表1。TACE治疗的适应证包括:①不能手术切除的中晚期PLC,无肝肾功能严重障碍,包括巨块型肝癌(肿瘤占整个肝脏的比例<70%)、多发结节型肝癌、门静脉主干未完全阻塞或虽完全阻塞但肝动脉与门静脉间代偿性侧支血管形成、肝功能分级(Child-Pugh)A级或B级而ECOG评分0~2分;②小肝癌,但不适合或不愿意进行手术、局部射频或微波消融的治疗者。TACE治疗的禁忌证包括:①肝功能严重障碍(Child-Pugh C级);②凝血功能严重减退且无法纠正;③门静脉主干完全被癌栓栓塞且侧支血管形成少;④合并活动性感染且不能同时治疗者;⑤肿瘤广泛远处转移,预计生存期<3个月者;⑥恶病质或多器官功能衰竭者;⑦肿瘤癌灶占全肝比例≥70%;⑧外周血白细胞和血小板显著减少,白细胞<2.0×109/L,血小板<50×109/L。
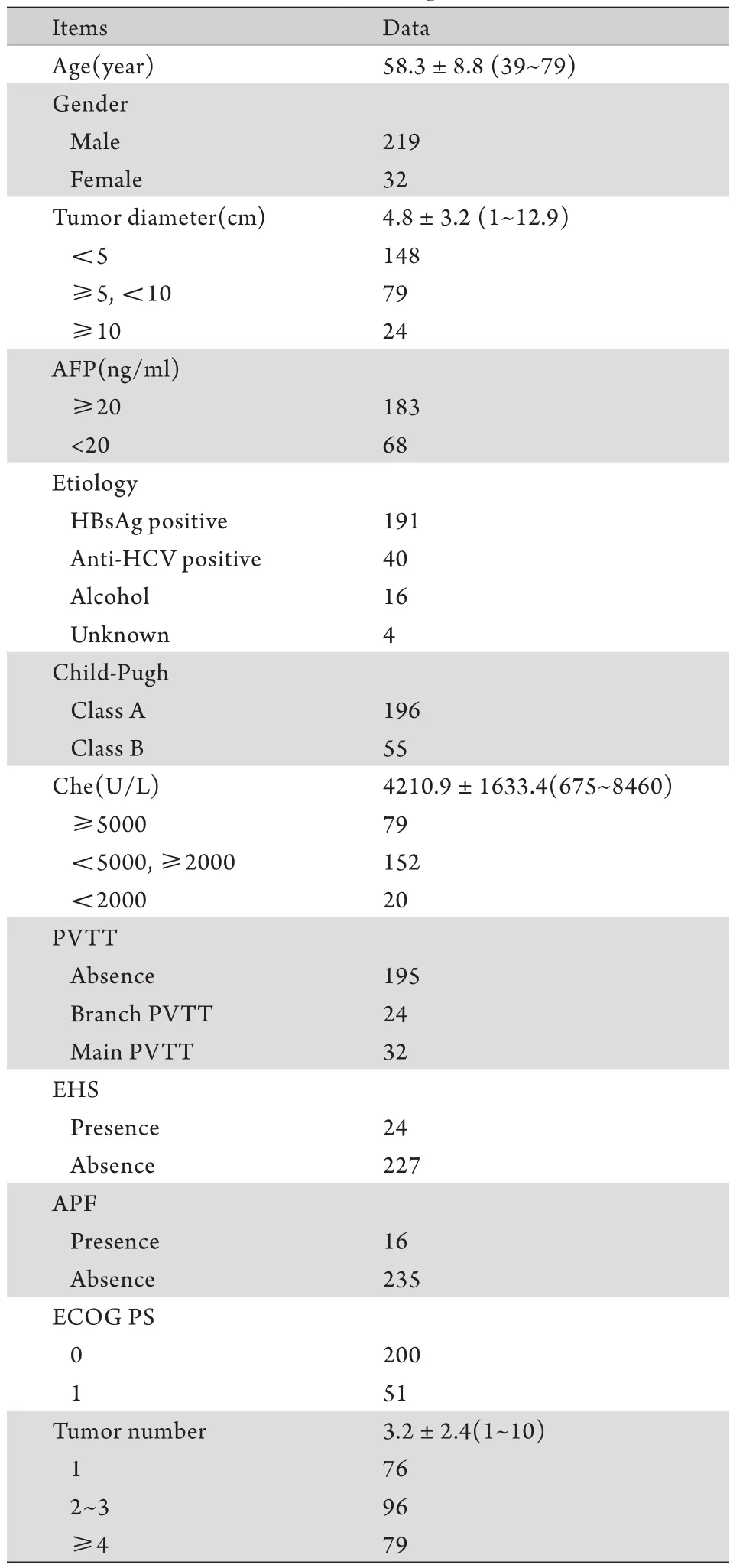
表1 251例PLC患者的临床资料Tab.1 Clinical data of 251 patients with PLC
1.2 治疗方法
1.2.1 TACE治疗 常规术前准备,应用Seldingers法经股动脉穿刺插管,常规行肝总动脉及肠系膜上动脉造影,观察肿瘤染色情况及门静脉充盈状态。选择性插管至肿瘤供应血管后,将氟尿嘧啶0.5~1.0g、表柔比星10~30mg、超液化碘油乳剂5~20m l缓慢注入栓塞靶血管,必要时应用明胶海绵颗粒栓塞肿瘤供血动脉。
1.2.2 TACE术后处理及肝功能失代偿定义 术后常规给予保肝治疗,7~14d后复查肝功能、血浆凝血酶原时间及凝血酶原活动度,行腹部B超检查。如肝功能Child-Pugh分级转变为C级或术后14d内出现上消化道出血,则定义为肝功能失代偿。
1.3 统计学处理 采用Chiss软件进行统计学分析,计量资料以±s表示,计数资料以率表示,采用χ2检验进行单因素分析。采用logistic回归模型分析多个因素对患者TACE术后肝功能失代偿的影响。P<0.05为差异有统计学意义。
2 结 果
2.1 TACE术后肝功能失代偿发生率 251例PLC患者行TACE治疗后40例(15.9%)发生肝功能失代偿,其中男32例,女8例。2例为术后2周内出现上消化道出血。TACE术后未发生肝功能失代偿者211例(84.1%),其中男187例,女24例。
2.2 与TACE术后肝功能失代偿发生的相关因素将251例PLC患者按照术后是否发生肝功能失代偿分为2组,分析其相关因素(表2)。年龄、性别、肿瘤数量、AFP水平、病原学、行为状态评分、有无动脉门脉瘘、有无肝外转移与PLC患者TACE术后是否发生肝功能失代偿无关,而肿瘤大小、Child-Pugh分级、血胆碱酯酶(Che)水平、有无门脉癌栓等因素与TACE术后是否发生肝功能失代偿有关。进一步的多因素分析结果表明,胆碱酯酶水平低、Child-Pugh B级及肿瘤直径≥10cm的PLC患者TACE后发生肝功能失代偿的可能性大(表3)。
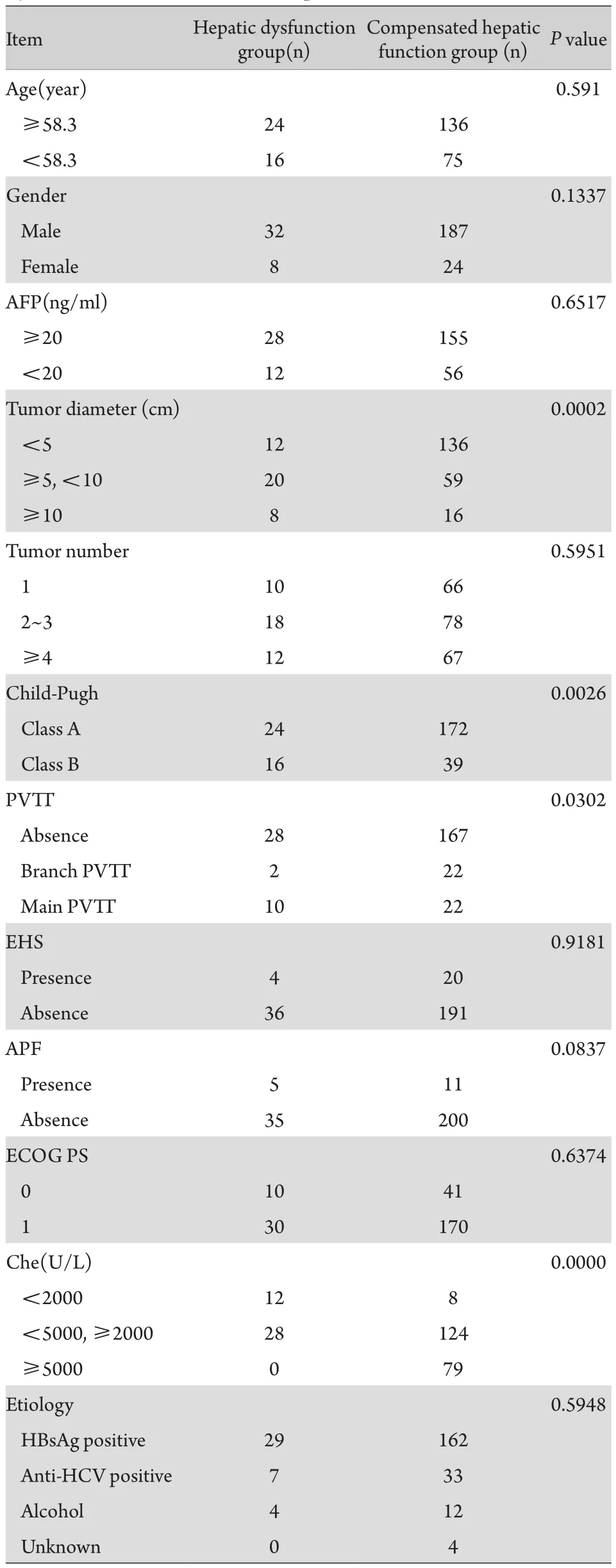
表2 251例PLC患者TACE术后肝功能失代偿与临床资料的相关性(例)Tab.2 Correlation between clinical features and hepatic dysfunction after TACE in 251 patients with PLC (case)
3 讨 论
TACE可在肿瘤局部形成较高的化疗药物浓度,增加化疗药物与肿瘤组织的接触时间,还可通过动脉栓塞减少肿瘤血供使肿瘤细胞缺血、缺氧直至凋亡[6],但由于90%以上的肝癌发生于肝硬化基础上,化疗药物和碘油等栓塞剂对于正常肝组织的损伤往往使原本脆弱的肝脏储备功能进一步受损,导致肝功能失代偿。Grieco等[7]对TACE术后发生肝衰竭与未发生肝衰竭的两组患者随访12个月,发现病死率分别为94.12%(16/17),58.03%(47/81)。
Child-Pugh分级是TACE术前最常用的肝脏储备功能评估手段,通常认为Child-Pugh A级与B级的患者能够耐受手术。但Child-Pugh分级中的一些临床及血液生化指标可受多种因素的影响,一些Child-Pugh C级患者在大量补充白蛋白、利尿消退腹水后可改善为Child-Pugh B级或者A级,但其肝功能仍然很脆弱,行TACE治疗后容易再次导致肝功能失代偿。血清Che是一项临床上日益受到重视的评价肝脏储备功能的指标,包括乙酰胆碱酯酶(acetylcholinesterase,AcChe)和丁酰胆碱酯酶(butyrylcholinesterase,BuChe)两种,前者主要由神经细胞和红细胞合成,后者主要由胶质细胞和肝细胞合成,血清Che以BuChe为主,AcChe含量极少。人类BuChe半衰期为12d[8],当肝功能受损时,血清Che合成明显减少,该指标可反映肝病的严重程度和肝脏储备功能。血清白蛋白(Alb)水平也可反映肝细胞的合成与储备功能,但Alb半衰期较长,特别是对慢性肝病患者常给予白蛋白治疗,其血浆白蛋白水平不能真实反映肝脏实质的储备功能,而血浆Che不受外源性输入的影响,对了解肝病的发展及判断预后的意义更大[9]。Fortunato等[10]研究表明,慢性肝炎患者中血清Che活性随肝组织病理学分级与分期的升高而逐渐下降。顾胤杰等[11]的研究表明,接受门奇静脉断流术的3例肝硬化患者术后出现肝昏迷,术前分别为Child B级(2例)和A级(1例),但术前血清Che均小于2000U/L,提示将Che与Child-Pugh分级结合进行评估可更精准地选择手术时机。本研究中20例Che低于2000U/L的患者有12例术后出现肝功能失代偿,而Che在5000U/L以上者无一例发生肝功能失代偿。由此可见,在TACE治疗术前,除需考虑患者的Child-Pugh分级外,Che也是一个很重要的考虑因素。
门静脉癌栓是影响肝癌患者生存率的重要因素[12]。当出现门静脉癌栓时,癌细胞随时会通过血液全身转移,同时,癌栓也可加重门静脉高压,引起腹水及上消化道出血。合并门静脉癌栓的患者在进行TACE治疗后由于肝动脉血供被阻断,同时由于门静脉癌栓造成患者门静脉血流量减少,肝细胞容易造成缺血缺氧状态,较一般患者更易出现肝功能失代偿。Jeon等[13]研究表明:377例肝癌患者行632次TACE治疗,有76例术后发生肝衰竭,提示术前肝功能差以及门静脉癌栓是主要的危险因素。本组研究结果显示,单因素分析有无门静脉癌栓与TACE治疗后是否发生肝功能失代偿无明显相关性;而门静脉主干癌栓患者TACE术后的肝功能失代偿发生率明显增加。但多因素分析结果并没有提示门静脉癌栓是肝癌患者行TACE治疗后发生肝衰竭的危险因素,可能与门静脉癌栓患者在总病例数中所占比例较少有关(56/251);另外多因素分析的结果受到其他一些参数的影响,在本组病例56个门静脉癌栓患者中有20例是直径>10cm的巨块型肝癌,28例是直径>5cm的块状型肝癌,只有4例是直径<5cm的结节型肝癌。
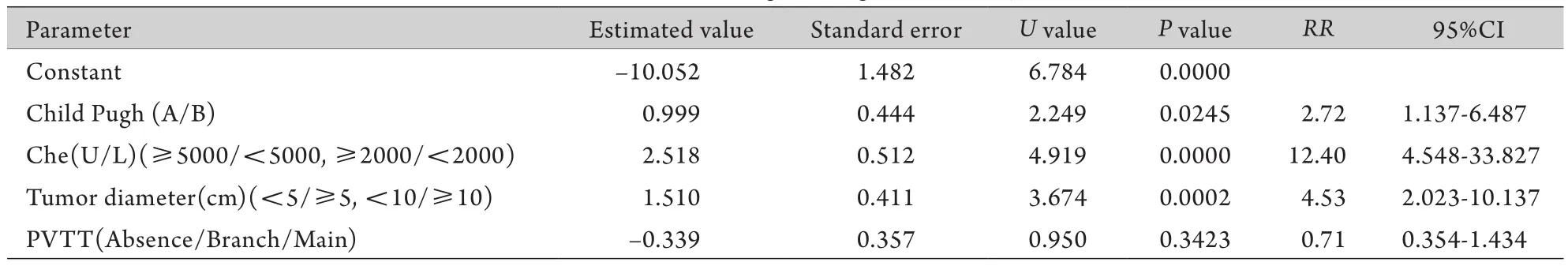
表3 Logistic回归分析结果Tab.3 Results of logistic regression analysis
为了取得理想的治疗效果,肝癌的直径越大,在行介入治疗时所用的化疗药及栓塞剂的用量也越大,但大量的化疗药物及栓塞剂对于肝脏的损害也越大,化疗药物可以引起非肿瘤组织中的肝细胞凋亡,加重肝硬化的程度[14]。碘油等栓塞剂栓塞肝动脉后可引起末梢循环障碍,造成毛细胆管缺血坏死,从而引起胆汁淤积、胆红素上升及肝细胞坏死[15]。而且肿瘤体积增大,正常肝组织体积相对缩小,影响肝脏储备功能。同时肿瘤直径越大的患者越容易发生肝内、血管及远处转移。本组肿瘤直径>10cm的肝癌患者24例,其中8例出现肝功能失代偿,最少的碘油用量为15m l,最多为25m l,平均为18m l。对于这类患者行TACE治疗时应谨慎,要减少化疗药物及栓塞剂的用量。
综上所述,在肝癌患者行TACE治疗前,需要严格掌握适应证,充分了解患者的全身状况、肝功能分级及肿瘤的特征,对患者进行个性化治疗,才能减少术后并发症的发生,延长患者的生存时间。
[1] El-Serag HB.Epidemiology of viral hepatitis and hepatocellular carcinoma[J].Gastroenterology, 2012, 142 (6): 1264-1273.
[2] Zhou L, Fu JL, Lu YY, et al.Changes in regulatory T cells and their relation w ith progrosis of patients after argon-helium cryoablation for hepatitis B related-hepatocellular carcinoma[J].Med J Chin PLA, 2010, 35(4): 367-371.[周霖, 福军亮, 陆荫英, 等.氩氦刀冷冻消融治疗乙型肝炎相关性肝细胞癌前后调节性T细胞的变化及其与患者预后的相关性[J].解放军医学杂志, 2010, 35(4): 367-371.]
[3] Said A, Wells J.Management of hepatocellular carcinoma[J].M inerva Med, 2009, 100 (1): 51-68.
[4] Llovet JM, Real M I, Montaña X, et al.Arterial embolisation or chemoembolisation versus symptomatic treatment in patients w ith unresectable hepatocellular carcinoma: a random ised controlled trial[J].Lancet, 2002, 359(9319): 1734-1739.
[5] European Association For The Study O f The Liver, European O rganisation For Research And Treatment O f Cancer.EASL–EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma[J].J Hepatol, 2012, 56(6): 908-943.
[6] Xiang X, Liu ZW, Shi XJ, et al.Expression of microvessel density and vascular endothelial grow th factor after liver transcatheter arterial chemoembolization[J].Med J Chin PLA, 2005, 24(1): 45.[向昕, 刘志伟, 史宪杰等.经导管肝动脉化疗栓塞后肝癌微血管密度及血管内皮生长因子的表达[J].解放军医学杂志, 2005, 24(1): 45.]
[7] Grieco A, Pompili M, Gam initi G, et al.Prognostic factors for survival in patients with early-intermediate hepatocellular carcinoma undergoing non-surgical therapy: comparision of Okuda, CLIP, and BCLC staging systems in a single Italian centre[J].Gut, 2005, 54: 411-418.
[8] Santarpia L, Grandone I, Contaldo F.Butyrylcholinesterase as a prognostic marker: a review of the literature[J].J Cachexia Sarcopenia Muscle, 2013, 4(1): 31-39.
[9] Yoshiba M, Sekiyama K, Inoue K, et al.Accurate prediction of fulm inant hepatic failure in severe acute viral hepatitis: multicenter study[J].J Gastroenterol, 2002, 37(11): 916-921.
[10] Fortunato G, Castaldo G, O riani G, et al.Multivariate discriminant function based on six biochemical markers in blood can predict the cirrhotic evolution of chronic hepatitis[J].Clin Chem, 2001, 47(9): 1696-1700.
[11] Gu YJ, Zhong YB.Value of serum cholinesterase activity in evaluating liver reserve function of cirrhoticpatients[J].Chin J Med Guide, 2010, 12 (4): 649-650.[顾胤杰, 钟玉兵.胆碱酯酶测定对评估肝硬化患者肝储备的意义[J].中国医药导刊, 2010, 12(4): 649-650.]
[12] Matono R, Yoshiya S, Motomura T, et al.Factors linked to longterm survival of patients w ith hepatocellular carcinoma accompanied by tumour thrombus in the major portal vein after surgical resection[J].HPB (Oxford), 2012, 14(4): 247-253.
[13] Jeon SH, Park KS, Kim YH, et al.Incidengce and riskfactors o f acute hepatic failure after transcatheter arterial chemoembolization for hepatocellular carcinomar[J].Korean J Gastroenterol, 2007, 50(3): 176-182.
[14] Hu DY.The referral treatment on advanced liver tumors[J].J Clin Surg, 2008, 16(9): 581-582.[胡道予.中晚期肝癌的介入治疗[J].临床外科杂志, 2008, 16 (9): 581-582.]
[15] Chen XM, Luo PF.The Problem and resolution of transcatheter arterial chemoembolization in treatment on liver cancer[J].J Pract Med, 2007, 23(6): 786-787.[陈晓明, 罗鹏飞.肝癌经导管肝动脉化疗栓塞存在的问题与对策[J].实用医学杂志, 2007, 23(6): 786-787.]
Clinical analysis of hepatic dysfunction after transcatheter arterial chemoembolization in patientswith primary liver cancer
ZHOU Lin, WANG Hua-ming*, AI Ding-lun, ZHAO Yun, ZHANG Lin-zhi, YU Qiang, YANG Bin, PENG Xiao-ming, WANG Jing-yan, LIU Chun-zi
Department of Interventional Radiology, Center for Medical Iconography, 302 Hospital of PLA, Beijing 100039, China
*
, E-mail: hwm302@sohu.com
ObjectiveTo analyze the correlation between clinical features and hepatic dysfunction after transcatheter arterial chemoembolization (TACE) in patients with primary liver cancer (PLC).MethodsTwo hundred and fifty-one PLC patients from Apr.2012 to Oct.2012 at 302 Hospital treated w ith TACE were retrospectively analyzed.χ2test and logistic regression model were used to assess the correlation between clinical features and hepatic dysfunction after TACE.ResultsForty out of 251 patients (15.9%) presented with hepatic dysfunction after TACE.Univariate analysis showed that the size of tumor diameter, Child-Pugh grade, cholinesterase level and portal vein tumor thrombosis (PVTT) were associated w ith hepatic dysfunction after TACE in PLC patients.Multivariate analysis showed that Child-Pugh grade B, tumor diameter ≥10cm and low cholinesterase level were risk factors associated with hepatic dysfunction after TACE in PLC patients.ConclusionTACE should be carefully performed to avoid hepatic dysfunction in PLC patients with tumor diameter ≥10cm, Child-Pugh grade B and low cholinesterase level.
liver neoplasms; chemoembolization, therapeutic; hepatic insufficiency
R735.7
0577-7402(2014)02-0149-05
10.11855/j.issn.0577-7402.2014.02.14
2013-11-28;
2013-12-17)
(责任编辑:沈宁)
周霖,医学博士,副主任医师。主要从事肝癌的基础与临床研究
100039 北京 解放军302医院医学影像中心介入科(周霖、王华明、艾鼎伦、赵云、张林枝、余强、杨斌、彭晓明、王京艳、刘春梓)
王华明,E-mail:hwm302@sohu.com
