乌司他丁对甘油诱导横纹肌溶解大鼠IL-6、TNF-α释放的影响及其对横纹肌的保护作用
2014-08-02潘志国邵玉陈怿陈镜合苏磊
潘志国,邵玉,陈怿,陈镜合,苏磊
乌司他丁对甘油诱导横纹肌溶解大鼠IL-6、TNF-α释放的影响及其对横纹肌的保护作用
潘志国,邵玉,陈怿,陈镜合,苏磊
目的研究乌司他丁对甘油诱导横纹肌溶解大鼠血浆白细胞介素6(IL-6)和肿瘤坏死因子(TNF-α)的影响及其对横纹肌的保护作用。方法24只Wistar大鼠随机分为4组,每组6只。正常对照组;模型组:肌注50%甘油8m l/kg;低剂量乌司他丁组和高剂量乌司他丁组:造模后分别静脉给予1000U和5000U乌司他丁,1次/12h。72h后立即行下腔静脉采血检测大鼠血浆IL-6、TNF-α水平,并分离大鼠右后肢横纹肌行病理及电镜切片检查。结果造模后大鼠血浆IL-6、TNF-α水平均较正常对照组明显升高(P<0.05)。低剂量乌司他丁组血IL-6、TNF-α水平分别为528.97±77.34、584.65±53.22pg/m l,高剂量乌司他丁组分别为860.68±45.32、480.45±49.78pg/m l,与正常对照组(分别为1546.14±106.33、414.52±55.19pg/m l)及模型组(分别为1994.09±99.45、822.93±78.23pg/m l)比较均明显下降(P<0.05)。病理切片及电镜观察结果显示,乌司他丁组横纹肌组织损伤较模型组明显减轻,其中高剂量乌司他丁组横纹肌肌纹基本恢复正常。结论乌司他丁可抑制甘油诱导横纹肌溶解大鼠血浆IL-6和TNF-α的释放,并对机体横纹肌具有保护作用。
乌司他丁;横纹肌溶解;炎症
横纹肌溶解综合征(rhabdomyolysis,RM)是指由一系列原因引起横纹肌细胞膜损伤进而造成细胞膜完整性改变,导致细胞内毒性物质释放入全身血液循环的综合征[1]。近年来,随着全球自然灾害(高温、地震、海啸等)以及降脂药物、小龙虾事件的频繁发生[2-4],横纹肌溶解再次成为灾害医学、重症医学的研究热点。有文献报道,横纹肌溶解会解释放出大量毒性物质及细胞因子、自由基入血,诱发脓毒症,二者相互促进[1,5]。本研究根据Yousefipour等[6]的方法应用甘油诱导Wista大鼠横纹肌溶解模型,观察大鼠血中IL-6、TNF-α的表达以及横纹肌的病理变化,探讨乌司他丁对横纹肌溶解大鼠的保护作用。
1 材料与方法
1.1 实验动物及主要试剂 24只雄性W ista大鼠(SCXK2011-0015),体重300±20g,由南方医科大学实验动物中心提供。50%超纯甘油购自美国Am resco公司,ELISA检测试剂盒为韩国KOMA公司产品,其余试剂均为国产分析纯,乌司他丁购自广州天普公司。
1.2 建模及分组 所有动物单笼饲养,第1天禁水不禁食,第2天以50%(V/V)甘油8m l/kg右侧后肢肌内注射,注射甘油后饮水、饮食不限。24只大鼠随机分为4组,每组6只。正常对照组;模型组:肌内注射50%甘油8m l/kg造模,造模成功后大鼠肌内病理切片呈横纹肌溶解表现;低剂量乌司他丁组:造模后每只大鼠静脉注射1000U乌司他丁,1次/12h;高剂量乌司他丁组:造模后每只大鼠静脉注射5000U乌司他丁,1次/12h。72h后立即行下腔静脉采血并分离大鼠右后肢横纹肌。
1.3 大鼠血IL-6、TNF-α水平检测 各组大鼠采用10%水合氯醛(3m l/kg)腹腔注射麻醉,打开腹腔、胸腔,快速心脏采血5m l,立即置于干燥管内,轻缓混匀后,3000r/m in离心10m in,取血清–20℃低温保存待测。采用ELISA法检测大鼠血清IL-6、TNF-α水平。
1.4 病理及电镜观察 大鼠采血后迅速分离右后肢横纹肌,用生理盐水冲洗干净后,一部分投入4%多聚甲醛液中固定24h,送广州军区广州总医院病理科行病理检查(HE染色)。另一部分切成1mm3小块组织,移入装有前固定液的标本瓶内,置4℃冰箱固定3~4h后送广州军区广州总医院医学实验科进行电镜室检查。
1.5 统计学处理 采用SPSS 13.0软件进行统计学分析。计量资料以x±s表示,多组资料之间的比较采用单因素方差分析,在方差齐性基础上的两两比较采用SNK-t法,P<0.05示差异有统计学意义。
2 结 果
2.1 乌司他丁对甘油损伤大鼠血浆IL-6、TNF-α释放的抑制作用 造模后大鼠血浆IL-6、TNF-α水平均较正常对照组明显升高(P<0.05)。静脉给予乌司他丁后,低剂量及高剂量乌司他丁组大鼠血浆IL-6、TNF-α水平均有所下降(表1)。
表1 各组大鼠血清IL-6、TNF-α检测结果(pg/m l,±s,n=6)Tab.1 Serum IL-6 and TNF-α levels of rats in each group(pg/ m l,±s, n=6)
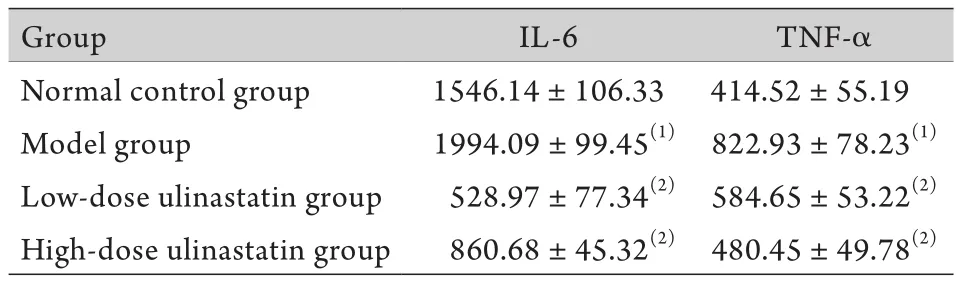
表1 各组大鼠血清IL-6、TNF-α检测结果(pg/m l,±s,n=6)Tab.1 Serum IL-6 and TNF-α levels of rats in each group(pg/ m l,±s, n=6)
(1)P<0.05 com pared w ith normal control group; (2)P<0.05 compared with model group
Group IL-6 TNF-α Normal control group 1546.14±106.33 414.52±55.19 Model group 1994.09±99.45(1)822.93±78.23(1)Low-dose ulinastatin group 528.97±77.34(2)584.65±53.22(2)High-dose ulinastatin group 860.68±45.32(2)480.45±49.78(2)
2.2 横纹肌病理切片结果 光镜下观察,正常对照组大鼠横纹肌肌纹正常;模型组出现肌肉溶解,组织细胞吞噬细胞碎屑的现象;应用乌司他丁后,肌肉溶解损伤明显减少,在高剂量乌司他丁组,横纹肌肌纹甚至基本正常(图1)。
2.3 电镜下观察横纹肌改变 高倍电镜下观察可见,正常对照组大鼠肌组织Z线排列整齐,肌节正常,无肌溶解灶出现。模型组部分横纹肌肌纤维和Z线消失,明显肌溶灶;低剂量乌司他丁组横纹肌组织Z线排列整齐,肌节正常,仅见部分切片少量肌溶解灶出现及部分Z线增粗,肌纤维减少;高剂量乌司他丁组横纹肌组织Z线排列整齐,肌节正常,仅见少量肌溶解灶出现(图2)。

图1 各组大鼠横纹肌组织病理学观察(HE ×100)Fig.1 Histopathological observation of rats' rhabdomyolysis in each group (HE ×100) A.Normal control group; B.Model group; C.Low-dose ulinastatin group; D.High-dose ulinastatin group.Arrows show the dissolving muscle
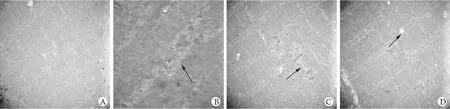
图2 电镜观察各组大鼠横纹肌溶解情况Fig.2 The rhabdomyolysis in different groups (Electronic m icroscopy) A.Normal control group; B.Model group; C.Low-dose ulinastatin group; D.High-dose ulinastatin group.Arrows show the striated muscle
3 讨 论
横纹肌溶解是由于骨骼肌细胞破坏,释放胞内容物入血,导致多脏器功能损害的综合征。除自身遗传性疾病外,创伤、高强度训练、局部缺血、药物、毒素、代谢疾病、感染等均可导致横纹肌溶解[7-9]。横纹肌溶解的基本原因包括线粒体Ca离子超载-线粒体功能障碍;磷脂酶A2活化;横纹肌细胞持久收缩;自由基产生-氧化性应激[3];细胞凋亡等。释放至胞外的毒性物质可导致肌细胞邻近微血管发生损伤,加剧局部能量耗竭。同时,损坏的微血管内皮细胞裸露,导致循环中白细胞附着而活化,继而释放氧自由基及蛋白水解酶类[2]。横纹肌溶解还可通过多种原因导致大量胞内毒素及自由基等物质释放入血循环、凝血功能紊乱、血管内皮损伤、酸碱失衡等多种因素诱发脓毒症,造成多器官功能衰竭,从而增加患者死亡率[10]。
乌司他丁是人体内的一种天然酶抑制剂,可从健康男性尿液中分离纯化获得,其药理作用包括稳定溶酶体膜,抑制水解酶活性,抗炎、抗休克及抗缺血,抑制促炎细胞素TNF-α和IL-6的释放,抑制氧自由基产生,提高机体对氧自由基清除能力,减轻脂质过氧化反应程度等[11-14]。因为该药对抑制全身过度炎症反应,保护机体免受炎症侵害具有重要意义,在临床上广泛应用于全身炎症反应综合征、脓毒症、重症肺炎、重症胰腺炎、凝血功能紊乱等疾病的治疗[15-17]。
在本实验中,给予乌司他丁后,甘油诱导造成的横纹肌溶解大鼠的IL-6和TNF-α水平均明显降低(P<0.05),提示乌司他丁对甘油诱导横纹肌溶解大鼠机体促炎细胞素TNF-α和IL-6的释放具有明显的抑制作用。由病理切片可以看出,低剂量乌司他丁组横纹肌组织虽然仍有小部分横纹消失,但较使用前明显好转。从电镜图片来看,应用乌司他丁后横纹肌Z线排列整齐,肌节正常,仅小部分Z线增粗,肌纤维减少。
综上所述,应用乌司他丁后大鼠横纹肌组织溶解情况明显好转,表明乌司他丁可抑制甘油诱导横纹肌溶解大鼠IL-6和TNF-α的释放,并对机体横纹肌具有保护作用。乌司他丁作为抗炎药物对于横纹肌溶解的保护作用机制仍有待进一步研究。
[1] Pan ZG, Su L, M eng FS, et al.The pathophysio logy o f rhabdomyolysis and the relationship w ith sepsis[J].Lingnan J Emerg Med, 2008, 13(5): 398-399, 402.[潘志国, 苏磊, 孟繁甦.横纹肌溶解症病理生理及其与脓毒症关系[J].岭南急诊医学杂志, 2008, 13(5): 398-399, 402.]
[2] Xie GX, Guo BF, Chen Y, et al.The ep idem io logy o f rhabdomyolysis induced by crayfish intake[J].Mod Prev Med, 2012(20): 5239-5240.[谢国祥, 郭宝福, 陈洋, 等.食用小龙虾致横纹肌溶解综合征事件的流行病学调查[J].现代预防医学, 2012(20): 5239-5240.]
[3] Xu H.1 cases of rhabdomyolysis induced by rosuvstatin[J].J Clin Rational drug, 2013, 6(2): 71.[徐虹.瑞舒伐他汀致横纹肌溶解症1例[J].临床合理用药杂志, 2013, 6(2): 71.]
[4] Yue H J, Song XJ, Leng J, et al.Rhabdomyolysis induced by rosuvstatin[J].Adverse Drug React J, 2011, 13(6): 389-390.[岳慧杰, 宋小骏, 冷静, 等.瑞舒伐他汀致横纹肌溶解症[J].药物不良反应杂志, 2011, 13(6): 389-390.]
[5] de Meijer AR, Fikkers BG, de Keijzer MH, et al.Serum creatine kinase as predictor of clinical course in rhabdomyolysis: a 5-year intensive care survey[J].Intensive Care Med, 2003, 29(7): 1121-1125.
[6] Yousefipour Z, Hercule H, Oyekan AO, et al.Antioxidant U74389G improves glycerol-induced acute renal failure without affecting PPARgamma gene[J].Ren Fail, 2007, 29(7): 903-910.
[7] Guis S, Mattei JP, Cozzone PJ, et al.Pathophysiology and clinical presentations of rhabdomyolysis[J].Joint Bone Spine, 2005, 72(5): 382-391.
[8] Zhou CH, Li M, Yu YW, et al.High-intense m ilitary training resulting in renal impairment in navy army[J].Med J Chin PLA, 2008, 33(12): 1488-1490.[周春华, 李猛, 余永武, 等.海军部队高强度军事训练致肾脏损伤的调查分析[J].解放军医学杂志, 2008, 33(12): 1488-1490.]
[9] Su L.The prevention and treatment in severe heat stroke[J].Med J Chin PLA, 2011(9): 883-885.[苏磊.重症中暑防治回顾与启示[J].解放军医学杂志.2011(9): 883-885.]
[10] M a PL, Su JW, Wang Y, et al.C linical studies o f MODS secondary to rhabdomyolysis[J].Med J Chin PLA, 2006, 31(10): 1021-1023.[马朋林, 苏瑾文, 王宇, 等.横纹肌溶解继发爆发型多器官功能衰竭的临床研究[J].解放军医学杂志, 2006, 31(10): 1021-1023.]
[11] Cao WY, Jin FG, Luo Y, et al.The effect of ulinastatin in rats with ALI induced by sea water drowning[J].Chin J Respir Crit Care Med, 2011, 10(2): 139-143.[曹万英, 金发光, 罗颖, 等.乌司他丁治疗大鼠海水淹溺型急性肺损伤的实验观察[J].中国呼吸与危重监护杂志, 2011, 10(2): 139-143.]
[12] Ni HY, Fang Q, Zhang YT, et al.The effect of ulinastatin on the inflammation and its therapeutic effect in patients with severe sepsis[J].Chin Emerg Med, 2008, 28(4): 342-344.[倪红英, 方强, 章云涛, 等.乌司他丁对重症脓毒症患者炎性反应的影响及疗效评价[J].中国急救医学, 2008, 28(4): 342-344.]
[13] Xu T, Li W, Lu PY, et al.The therapeutic effect and safety of ulinastatin on the treatment of patients with moderate and severe burning[J].Chin Clin Med, 2006, 13(5): 863-864.[许涛, 李卫,陆平言, 等.乌司他丁治疗中重度烧伤患者的疗效与安全性评价[J].中国临床医学, 2006, 13(5): 863-864.]
[14] Xie K, Huang YS, Zhou JL, et al.The cardiac p rotection o f ulinastatin on the treatment of rats with severe burning[J].J Third M il Med Univ, 2005, 27(12): 1244-1246.[谢康, 黄跃生,周军利, 等.乌司他丁对严重烫伤大鼠早期心肌损害保护作用[J].第三军医大学学报.2005, 27(12): 1244-1246.]
[15] Jiang JJ, Shi XY, Yuan HB, et al.The effect of ulinastatin on the pulmonary NF-κB expression in rats with ALI[J].Med J Chin PLA, 2009, 34(5): 550-553.[蒋京京, 石学银, 袁红斌, 等.乌司他丁对急性肺损伤大鼠肺组织NF-κB表达的影响[J].解放军医学杂志, 2009, 34(5): 550-553.]
[16] Xu Z, Wang ZQ, Liu XZ, et al.The effect of ulinastatin on the human coagulation function in vitro[J].Med J Chin PLA, 2009, 34(12): 1445-1447.[徐震, 王卓强, 刘秀珍, 等.乌司他丁对人凝血功能影响的体外观察[J].解放军医学杂志, 2009, 34(12): 1445-1447.]
[17] Su L, Zhou DY, Tang YQ, et al.The rationality of ulinastatin and thymopeptidesα1 on the immuno-regulation in patients with sepsis[J].Med J Chin PLA, 2007, 32(2): 161-163.[苏磊, 周殿元, 唐柚青, 等.乌司他丁联合胸腺肽α1对脓毒症患者免疫调理的合理性分析[J].解放军医学杂志, 2007, 32(2): 161-163.]
Effect of ulinastatin on the release of IL-6 and TNF-α in rats with rhabdomyolysis induced byglycerol and its protective effect on striated muscle
PAN Zhi-guo1, SHAO Yu2, CHEN Yi1, CHEN Jing-he3, SU Lei1*1Department of ICU, Guangzhou General Hospital of Guangzhou Command, The Military Key Laboratory of Trauma Care and Tissue Repair in Hot Zone of PLA,2Department of Overseas Chinese, Guangzhou 510010, China
3Department of Medicine, First Affiliated Hospital, Guangzhou University of Chinese Medicine, Guangzhou 510405, China
*
, E-mail: slei_icu@163.com
ObjectiveTo investigate the effect of ulinastatin on the levels of serum IL-6 and TNF-α in rats w ith rhabdomyolysis induced by glycerol, and its protective effect on striated muscle.MethodsTwenty-four rats were random ly divided into 4 groups (6 each): normal control group, model group with intramuscular injection of 8m l/kg glycerol, low-dose and high-dose treatment group with intravenous injection of 1000 and 5000U ulinastatin respectively, once per 12h.The rats were sacrificed 72h after treatment.The levels of serum IL-6 and TNF-α were determ ined, and pathological changes in striated muscle in the affected limb were exam ined under electron m icroscope.ResultsThe serum IL-6 and TNF-α levels were 528.97±77.34, 584.65±53.22 in low-dose treatment group, and 860.68±45.32, 480.45±49.78 in high-dose treatment group, which were significantly lower than those in normal control group (1546.14±106.33, 414.52±55.19 respectively) and in model group (1994.09±99.45, 822.93±78.23 respectively, P<0.05).The pathological exam ination showed that the changes in striated muscle was milder in both treatment groups than in model group.ConclusionUlinastatin can inhibit the release of serum IL-6 and TNF-α and protect the striated muscle from impairment in rats w ith rhabdomyolysis induced by glycerol.
ulinastatin; rhabdomyolysis; inflammatory
R685.5
0577-7402(2014)02-0105-04
10.11855/j.issn.0577-7402.2014.02.05
2013-11-08;
2014-01-04)
(责任编辑:熊晓然)
This work was supported by the Key Program of “Twelfth Five-year” Military Medicine Technology Research (BWS12J018), and the National Natural Science Foundation of China(81071529, 81101467, 81101406)
全军医学科学技术研究“十二五”发展计划重点项目(BWS12J018);国家自然科学基金(81071529、81101467、81101406)
潘志国,医学博士,主治医师。主要从事急危重病科研及临床救治
510010 广州 广州军区广州总医院重症医学科,全军热区创伤救治与组织修复重点实验室(潘志国、陈怿、苏磊),华侨科(邵玉);510405 广州 广州中医药大学第一附属医院内科(陈镜合)
苏磊,E-mail: slei_icu@163.com
