射频消融过程肿瘤破裂相关物理学因素的理论性模拟研究
2014-08-02姜凯陈照军刘洋陈永卫苏明赵向前张文智王敬董家鸿黄志强
姜凯,陈照军,刘洋,陈永卫,苏明,赵向前,张文智,王敬,董家鸿,黄志强
射频消融过程肿瘤破裂相关物理学因素的理论性模拟研究
姜凯,陈照军,刘洋,陈永卫,苏明,赵向前,张文智,王敬,董家鸿,黄志强
目的探讨射频消融(RFA)过程中发生肝细胞癌破裂的相关物理学因素。方法以不同体积的密闭小球作为肿瘤模拟计算对象,球体内选择水作为介质。模拟RFA加热过程,观察在密闭球体内温度不同的情况下,小球内壁所承受的压力变化。结果随着密闭球体内部温度升高,其内壁所承受的压力呈几何倍数增加,从最初的7.38kPa(40℃)逐步升高到70.14kPa(90℃),增加约9.5倍;当球内温度升至100℃时,其内壁压力达到101.33kPa,与外界大气压平衡;若继续升温,则水介质出现大量气化,体积迅速膨胀,如升高至120℃时,球内压力增加至198.64kPa,150℃时则达到476.24kPa。结论肿瘤内部压力随温度升高呈几何级数迅速增加,当温度达到100℃以上时,肿瘤内液体发生气化膨胀,使瘤体内压力超过外界压力,是导致RFA过程中肿瘤破裂的主要因素。
导管消融术;癌,肝细胞;破裂;压力
射频消融(radiofrequency ablation,RFA)是已经广泛应用于肝细胞癌(hepatocellular carcinoma,HCC)的有效微创治疗手段[1-2]。对于直径<3cm的HCC,RFA术后生存率与外科手术切除相当[3-4]。开腹手术中RFA效果优于外科切除[5]。若肿瘤位于肝脏表面,或在肝内毗邻主要胆管、血管、膈肌、胆囊等特殊部位时,RFA治疗常会使肿瘤消融不完全或引起大出血、脏器穿孔等严重并发症[6-7]。HCC的病理学特点之一是具有丰富的血供,内部含液体量高且组织松软,当肿瘤位于或突出肝表面时,在RFA过程中容易发生破裂,使肿瘤包膜连续性遭到破坏,不仅会导致术中大出血,而且增加了肿瘤细胞种植转移的机会,是RFA治疗过程中的严重并发症之一[6-8]。目前关于RFA过程中肿瘤破裂的发生机制尚未见报道。本研究采用以水为介质的密闭球体模拟肿瘤,在不同热量输入条件下,从理论上推导球体内温度与压力变化的关系,探讨RFA过程可能导致肿瘤破裂的相关物理学因素。
1 材料与方法
设计合理的简化模型。肿瘤模型为具有一定体积的密闭小球,与外界无热量交换,内部填充介质为水,通过外界热量加热,探讨不同温度下小球内壁承受的压力变化。不同体积模型的温度均维持在50~150℃,每隔10℃取其对应的压力值,记录数据。
1.1 模型与假设 假定外压为101.33kPa,小球最初处于40℃(假定小球代替肝脏肿瘤,肝脏初始温度为37.0℃)以下,球内介质为水。
1.1.1 球体内温度在100℃以下 此时球内体系处于气液平衡,此时水产生的气压就是相应温度下水的饱和蒸汽压。球体压力p(T)即球体内壁应该承受的压力可以由饱和蒸汽压查表直接获得。同时,由于球体受热后的温度变化导致的附加压力Δp可由公式①计算,两个p值均可由水的饱和蒸汽压表查得。此状态时小球不破裂,则体积变化可以忽略。
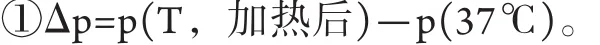
1.1.2 球体内温度超过100℃ 此时密闭球体内的水会大量气化,水的饱和蒸汽压随之将超过101.33kPa。小球内壁在加热前后的压差变化很大,其体积也会迅速增大,超出肿瘤包膜所能承受的极限时则会出现肿瘤破裂。不考虑实际应用中热河流效应(river-fow efect,RFE)[6,9]的影响,仅考虑理论模型,小球内壁的压力p仍需分如下两种情况讨论。
A.如果球体内的水较多或体积较大,即会存在不完全气化(类似高压锅内)的情形。此时p值仍可通过查水的饱和蒸汽压表获得。压差Δp的计算方法也可根据公式①计算。
B.如果小球内的水比较少或者小球的有效体积较小,则需采用克拉伯龙方程②估算;若需要精确计算还可运用范德华方程③对水介质进行校正。
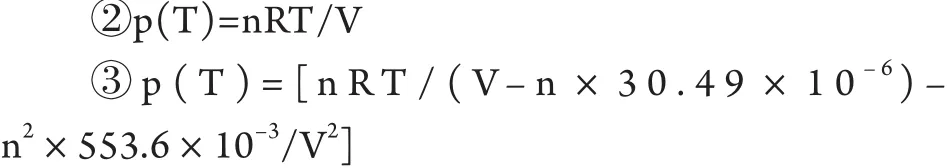
其中n为小球内水的物质的量,V为小球体积;R为阿佛伽德罗常数。将计算出的p(T)值用于公式①即可得到加热前后球体内壁应承受的压差Δp。
1.2 计算步骤
1.2.1 球体内温度在100℃以下 直接查取水的饱和蒸汽压表获取不同温度下对应的p值,通过公式①计算可得相应的压差值Δp,温度依次取40℃、50℃、60℃、70℃、80℃、90℃、100℃。
1.2.2 球体内温度超过100℃ 若球体内含水较多或体积较大,直接按公式①所述方法计算获取相应的压差值Δp,温度分别取100℃、110℃、120℃、130℃、140℃、150℃。
若球体内含水较少或有效体积较小,由公式②计算小球内p(T)值,温度分别取100℃、110℃、120℃、130℃、140℃、150℃,然后再由公式①计算得到压差值Δp。
2 结 果
球体内温度在100℃以下时,通过查取水的饱和蒸汽压表,由公式①计算可知不同温度下相应的小球内壁承受的压差值Δp。结果显示,小球内壁压力值从40℃时初始值的7.38kPa上升至90℃时的70.14kPa,增长约9.5倍,当球内温度升至100℃时,其内壁压力达到101.33kPa,与外界大气压平衡,增长了近13.7倍。具体数据如图1所示。
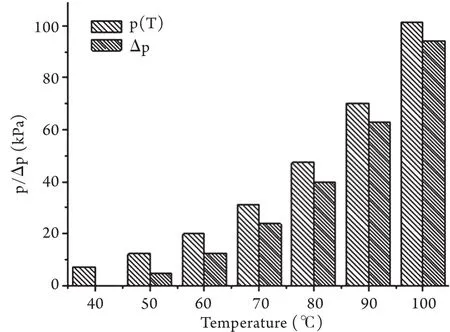
图1 100℃以下密闭小球内壁承受的压力及压差值ΔpFig.1 Value of internal pressure and Δp in enclosed globe at different temperature below 100℃
当球体内温度超过100℃,且含水较多或体积较大时,通过查取水的饱和蒸汽压表,由公式①计算可知不同温度时小球内壁承受的压差值Δp。随着温度持续增加,小球内壁压力由100℃时的101.33kPa增至120℃时的198.64kPa,150℃时的476.24kPa,增长幅度急剧增大。计算数据见图2。
当球体内温度超过100℃,且含水较少或有效体积较小时,由克拉伯龙方程②计算出p(T),然后再由公式①计算出压差值Δp。结果显示,密闭小球内压力从100℃时的101.33kPa增加至150℃的498.00kPa,增长幅度较图2中数据显著,但仍为同样数量级。具体数据见图3。
3 讨 论
RFA治疗肿瘤的原理是利用交变电流产生的射频波,使区域组织内离子与极性分子发生震动摩擦而产生热效应,当肿瘤的温度升高至有效的治疗温度并维持一定时间,即可达到肿瘤细胞完全凝固坏死的目的[9-13]。
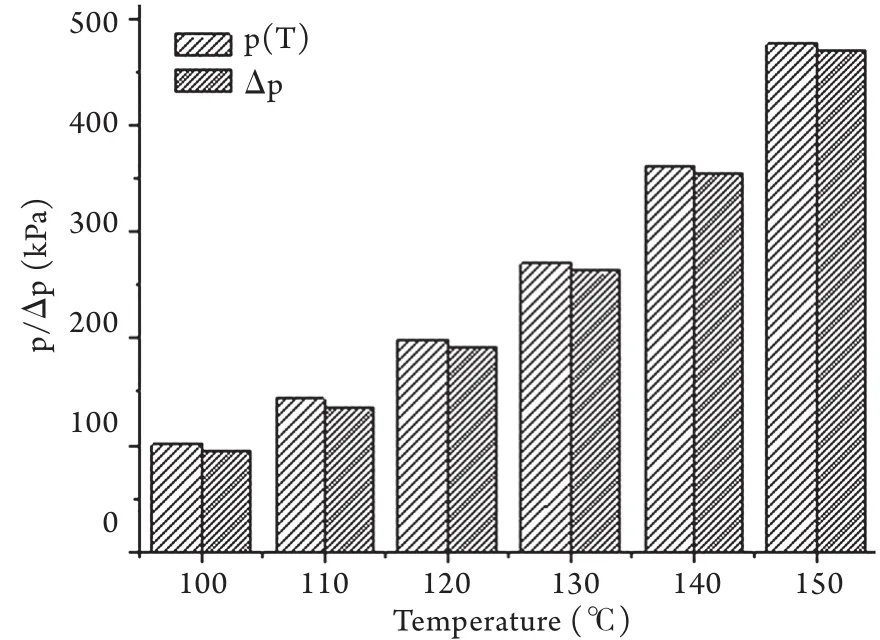
图2 100℃以上小球(体积较大或含水较多)内壁承受压力及压差值ΔpFig.2 Values of internal pressure and Δp in large globe at different temperature above 100℃
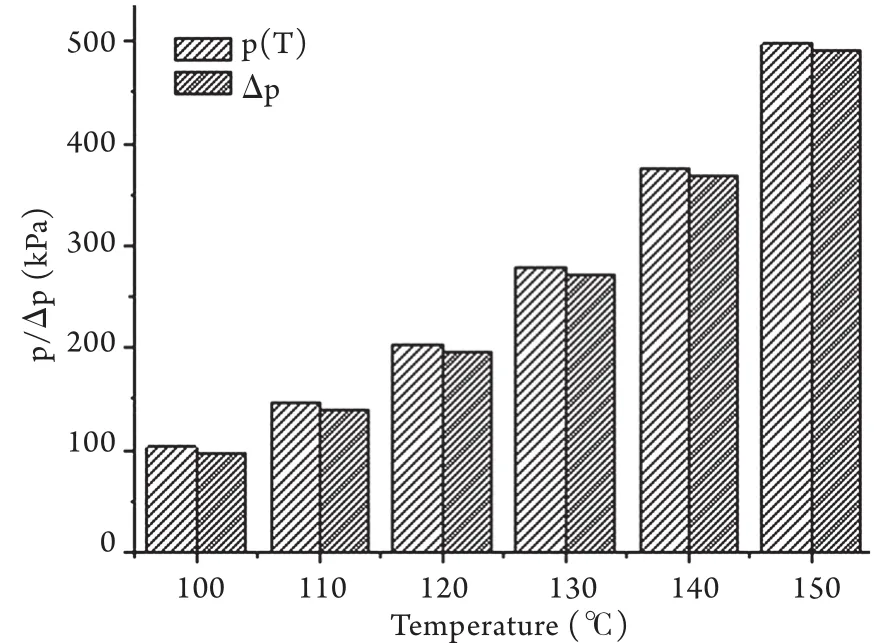
图3 100℃以上小球(体积较小或含水较少)内壁承受压力及压差值ΔpFig.3 Values of internal pressure and Δp in small globe at different temperature above 100℃
为达到一次性完全消融肿瘤,同时尽可能避免严重并发症的发生,需要了解RFA过程中热量对肿瘤及其周围组织的物理学作用和破坏程度,提高RFA的有效性和安全性[6,14]。RFA设备的不断改进,突出表现为通过增加对肿瘤组织的有效破坏范围来提高肿瘤的完全消融率[15-18]。然而,对于肝脏表面的HCC,在RFA过程中,仍然不可避免地会遇到肿瘤的爆炸式破裂,从而导致术中大出血这一严重并发症的发生[14,19]。关于RFA过程肿瘤爆炸破裂现象的可能发生机制目前尚未见报道。
在本研究中,以密闭小球模型代替肝肿瘤。在温度低于100℃时,密闭小球内气液两相处于动态平衡,球内壁承受的压力为当前温度下的饱和蒸汽压,均小于1个标准大气压。因此,假定腹腔内压力约等于外界大气压,则球体外压力始终大于内部压力,小球不会发生膨胀现象。因此,推测肿瘤包膜所处的状态也将相对稳定。然而,当球内温度上升至100℃时,球内壁承受的压力增长了约13.7倍,球内壁内压力接近外界大气压(101.33 kPa),即临近内外平衡状态,在此过程中球壁不会因内部压力过高而出现爆炸破裂现象。在RFA过程中,研究肿瘤包膜能够承受的极限压力范围是保障其安全性的重要前提,有待进一步研究。
球体内温度超过100℃时存在两种情况。首先,对于球内含水量较多时,表现出类似高压锅原理。当温度高于100℃时,球内水分大量气化,饱和蒸汽压随之快速增加,球壁内外压力平衡迅速破坏,密闭球内压大于外压,导致体积迅速膨大。如图2显示,随着温度升高,压力值逐渐增大,温度升高至120℃时,球内压力增加至198.64kPa,150℃时达到476.24kPa。尤其HCC具有丰富的血液供应,瘤体内液体含量高,因此推断在RFA过程中,温度超过100℃后瘤体内的压力会迅速升高,体积也随之急剧增加。肿瘤包膜承受压力超出其极限后即会发生爆炸破裂现象。
在球体内温度超过100℃时,由于球内的压力值改变主要来自内部液体的气化,所以当球的体积小或含液体量极低时,该液体气化产生的压力可忽略不计,因此,相应温度下的压力值由克拉伯龙方程计算得出。在该状态下球内的压力由气体的密度和温度决定,压力增长的幅度为同样数量级,如150℃时球内压力可升至498.00kPa。肝肿瘤作为一个弹性体,随着内部温度升高,当瘤体包膜内壁压力达到101.33kPa时,瘤体以热膨胀为主,维持恒定的压力与包膜张力处于动态平衡,避免了肿瘤爆炸破裂,若热量持续输入,导致温度迅速增加,肿瘤内部压力显著增高,则可导致肿瘤破裂。
根据上述理论模拟结果推断,导致HCC在RFA过程中出现爆炸破裂的热膨胀效应(heat-expand effect,HEE,即RFA过程中瘤体组织因受热而发生整体体积的微小变化,以及因内部液体气化压力急剧升高而发生的整个体积的急剧变化现象)的相关物理学因素,主要包括肿瘤瘤体的内部温度、组织密度(液体含量高低)、肿瘤体积等,而且三者之间相互作用,相辅相成。其中,肿瘤内部压力的显著变化与液体的气化量直接相关。由于肿瘤内部组织液中水的含量约占75%,在101.33kPa情况下,沸点约100℃,因此,瘤体内温度升至100℃时,是液体产生汽化的临界温度。
肿瘤不同于密闭的球体,特别是HCC具有丰富的血液供应(组织液含量高,密度低),动脉血流入,静脉血流出,这些血管的存在,如同高压锅的减压阀一样,在RFA过程中起到了一定的减压作用。然而,不同于较大的肿瘤(直径>3cm),较小肿瘤(直径≤3cm)瘤体内的血管一般是毛细血管,较少见粗大血管(直径≥3mm),受热后容易发生闭塞,因此在较小的肿瘤中这种减压作用是极其有限的。而且,当肿瘤体积较小时,RFA过程早期即可形成对整个瘤体的覆盖(而较大肿瘤难以做到整体覆盖),若局部温度迅速升高至100℃,液体迅速气化,较小的瘤内空间承受过高的压力,脆弱的包膜不能抵抗瞬间增高的压力,导致出现肿瘤爆炸破裂现象,这可能是肝脏表面较小肿瘤RFA过程容易发生破裂的主要原因。因此,RFA过程早期缓慢加热,同时使毛细血管起到有限的减压作用(热河流效应)[6,9],瘤体内液体逐渐减少,密度增高,避免液体发生气化,可能会降低肝表面肿瘤破裂的发生率。另一方面,若较小肿瘤完全处于肝脏内部,由于周围肝脏组织的保护,即使肿瘤内部压力迅速升高,亦不会出现肿瘤破裂,相反,瘤组织的膨胀可将肿瘤内与包膜处的毛细血管迅速压闭,有利于热量的聚集。故肿瘤所处的位置不同,RFA过程中热膨胀效应的表现也将不同。
为减少血供丰富瘤体内的液体含量,增加瘤组织密度,术前选择性经导管动脉栓塞(selective transcather artery embolism,TAE)可能是必要的。临床实践中发现,经过术前TAE处理的肿瘤,无论快速还是缓慢RFA加热,几乎无爆炸破裂现象发生,间接说明瘤体内液体的气化可能与爆炸破裂直接相关。另外,通过缓慢加热的方式使整个瘤体受热均匀,不仅有利于初始的气体排空,也有利于瘤体组织含水量的逐渐减少,从而增加肿瘤组织密度。为避免肿瘤破裂,采用缓慢加热的方式较快速加热相对更安全[8,19-20]。
综上所述,本研究结果显示肿瘤内部压力随温度的升高呈几何级数迅速增加,当温度达到100℃以上时,肿瘤内液体发生气化膨胀,使瘤体内压力超过外界,是导致RFA过程肿瘤破裂的主要因素。因此,RFA过程中早期防止肿瘤内液体气化,可能是避免肿瘤破裂的有效措施。
[1] Soon JL, Jeyaraj PR, Agasthian T.Thoracic complications of radiofrequency ablation of recurrent hepatoma[J].Ann Acad Med Singapore, 2008, 37(1): 75-76.
[2] Jiang K, Su M, Liu Y, et al.The feasibility and safety o f laparoscopic one-off com plete radiofrequency ablation for hepatocellular carcinoma in caudate lobe[J].Med J Chin PLA, 2013, 38(5): 355-358.[姜凯, 苏明, 刘洋, 等.腹腔镜下尾状叶肝细胞癌一次性完全射频消融的可行性及安全性评价[J].解放军医学杂志, 2013, 38(5): 355-358.]
[3] Chen MH, Yang W, Yan K, et al.Large liver tumors: protocol for radiofrequency ablation and its clinical application in 110 patients--mathematic model, overlapping mode, and electrode placement process[J].Radiology, 2004, 232(1): 260-271.
[4] Huang ZQ.Rad io frequency ab lation fo r hepatocellu lar carcinoma: surgeon's views[J].Med J Chin PLA, 2013, 38(5): 339-341.[黄志强.肝细胞癌的射频消融治疗: 外科医生的观点[J].解放军医学杂志, 2013, 38(5): 339-341.]
[5] H ildebrand P, Leibecke T, K leemann M, et al.In fluence of operator experience in radio frequency ablation of malignant liver tumours on treatment outcome[J].Eur J Surg Oncol, 2006, 32(4): 430-434.
[6] Jiang K, Gu WQ.Possible mechanism and prophylaxis strategy of severe complication in radiofrequency ablation treatment on liver tumor[J].World J Cancer Res, 2013, 3(2): 9-12.
[7] Kim YS, Rhim H, Lim HK, et al.Hepatic in farction after radiofrequency ablation of hepatocellular carcinoma with an internally cooled electrode[J].J Vasc Interv Radiol, 2007, 18(9): 1126-1133.
[8] Kai J, M ing S, Yang L, et al.Complete radio frequency ablation of hepatocellular carcinoma adjacent to the main bile duct and blood vessels between the first and the second hepatic portal[J].Cell Biochem Biophys, 2013, 66(2): 397-402.
[9] Ansari D, Andersson R.Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors[J].World J Gastroenterol, 2012, 18(10): 1003-1008.
[10] Lau WY, Leung TW, Yu SC, et al.Percutaneous local ablative therapy for hepatocellular carcinoma: a review and look into the future[J].Ann Surg, 2003, 237(2): 171-179.
[11] Jiang K, Su M, Liu Y, et al.Simulation research of "heat conduction effect" o f liver tissue during rad io frequency ablation[J].Med J Chin PLA, 2013, 38(5): 351-354.[姜凯, 苏明, 刘洋, 等.射频消融过程中肝组织热传导效应的模拟实验研究[J].解放军医学杂志, 2013, 38(5): 351-354.]
[12] Jiang K, Su M, Liu Y, et al.Laparoscopy-assisted and gallbladderpreserved one-off radiofrequency ablation for hepatocellular carcinoma adjoining gallbladder[J].Med J Chin PLA, 2013, 38(5): 359-362.[姜凯, 苏明, 刘洋, 等.腹腔镜下保留胆囊的毗邻胆囊肝细胞癌一次性完全射频消融治疗[J].解放军医学杂志, 2013, 38(5): 359-362.]
[13] Jiang K, Chen JY, Liu Y, et al."River effect" of radiofrequency ablation on relevant regional hepatocytes in living swine liver: a prelim inary pathological study[J].Med J Chin PLA, 2013, 38(5): 347-350.[姜凯, 陈继业, 刘洋, 等.活体猪肝射频消融河流效应对相应流域肝细胞的影响:病理学初步研究[J].解放军医学杂志, 2013, 38(5): 347-350.]
[14] Jiang K, Gu WQ.Theory and treatment safety strategy o f "one-off" complete radiofrequency ablation for hepatocellular carcinoma[J].Chin J Hepatobiliary Surg, 2013, 19(7): 487-490.
[15] Livraghi T, Goldberg SN, Monti F, et al.Saline-enhanced radiofrequency tissue ablation in the treatment of liver metastases[J].Radiology, 1997, 202(1): 205-210.
[16] Rhim H.Com p lications o f radio frequency ab lation in hepatocellular carcinoma[J].Abdom Imaging, 2005, 30(4): 409-418.
[17] Livraghi T, Goldberg SN, Lazzaroni S, et al.Hepatocellu lar carcinoma: radio-frequency ab lation o f medium and large lesions[J].Radiology, 2000, 214(3): 761-768.
[18] Solbiati L, Goldberg SN, Ierace T, et al.Hepatic metastases: percutaneous radio-frequency ablation w ith coo led-up electrodes[J].Radiology, 1997, 205(2): 367-373.
[19] Jiang K, Su M, Zhao X, et al."One-off" complete radiofrequency ablation of hepatocellular carcinoma adjacent to the gallbladder by a novel laparoscop ic technique w ithout gallb ladder isolation[J].Cell Biochem Biophys, 2013[Epub ahead of print].
[20] Jiang K, Zhang W, Su M, et al.Laparoscopic radiofrequency ablation of solitary small hepatocellular carcinoma in the ca date lobe[J].Eur J Surg Oncol, 2013, 39(11): 1236-1242.
Theoretical simulation of physical factors related to tumor burst during radiofrequency ablation
JIANG Kai1, CHEN Zhao-jun2, LIU Yang1, CHEN Yong-wei1, SU M ing1, ZHAO Xiang-qian1, ZHANG Wen-zhi1, WANG Jing1, DONG Jia-hong1, HUANG Zhi-qiang11Department of Hepatobiliary Surgery, General Hospital of PLA, Beijing 100853, China
2College of Chemical Engineering, China University of Petroleum (East China), Qingdao, Shandong 266555, China
ObjectiveTo explore the relative physical factors influencing tumor burst during radiofrequency ablation (RFA) treatment of hepatocellular carcinoma (HCC).MethodsWatertight globes of different size filled with water were used to simulate tumor mass of HCC, and then they were heated to a balanced gradient inner temperature sim ilar to that occurring during RFA treatment.The changes in inner pressure of the wall of globes were then recorded according to gradient balanced temperature.ResultsResponding to a gradually elevation of inner temperature, the inner pressure against the watertight globe wall increased exponentially from 7.38kPa at 40℃ to 70.14kPa at 90℃, i.e.there was a about 9.5-fold increase at 40℃.The inner pressure could reach a pressure of 101.33kPa at 100℃.Continued heating to above 100℃, the vaporized water expanded the globe, the inner pressure would reach to 198.64kPa when the temperature reached 120℃, and the inner pressure would reach 476.24kPa when the temperature reached 150℃.ConclusionsThe inner pressure of tumor increases exponentially along w ith rise of temperature, especially so when heated above 100℃.The vaporization of liquid inside of the tumor could exceed the inner pressure, and it is considered as the major factor in producing tumor burst during RFA treatment.
catheter ablation; carcinoma, hepatocellular; rupture; pressure
R735.7
0577-7402(2014)02-0094-05
10.11855/j.issn.0577-7402.2014.02.03
2013-11-08;
2014-01-07)
(责任编辑:熊晓然)
This work was supported by the National Key Technology Research and Development Program of China (2012BAI06B01)
国家科技支撑计划项目(2012BAI06B01)
姜凯,医学博士,主任医师,副教授。主要从事肝癌的外科临床与基础研究工作以及射频消融的临床安全治疗
100853 北京 解放军总医院肝胆外科(姜凯、刘洋、陈永卫、苏明、赵向前、张文智、王敬、董家鸿、黄志强);266555 山东青岛 中国石油大学(华东)化学工程学院、重质油国家重点实验室(陈照军)
