血清可溶性瘦素受体浓度与妊娠期糖尿病的相关性研究
2014-08-02王亚男李真吴晓华陈莉萍
王亚男,李真,吴晓华,陈莉萍
血清可溶性瘦素受体浓度与妊娠期糖尿病的相关性研究
王亚男,李真,吴晓华,陈莉萍
目的探索正常妊娠、妊娠期糖尿病(GDM)孕妇不同孕期血清可溶性瘦素受体(sLR)浓度变化特点及其与GDM发病的相关性。方法随机选取2012年6月-2013年2月第三军医大学新桥医院就诊的正常妊娠孕妇300例(A组)、GDM孕妇60例(B组)及健康未孕妇女20例(C组),A、B组根据孕周分为3个亚组:孕14~19周(A1,n=100;B1,n=20)、30~34周(A2,n=100;B2,n=20)、足月孕分娩前(≥37周)组(A3,n=100;B3,n=20)。采用酶联免疫吸附双抗体夹心法(ELISA法)分别检测各组血清sLR浓度,分析各组间及组内sLR浓度变化特点及其与GDM的关系。结果未孕组血清sLR浓度为4.095±0.996ng/m l,正常妊娠组中孕14~19周、孕30~34周、足月孕分娩前血清sLR浓度分别为7.091±4.039、8.543±5.460、10.130±7.069ng/m l,均显著高于未孕组,差异有统计学意义(P<0.05),且正常妊娠组内各亚组间比较差异均有统计学意义(P<0.05),即随着妊娠进展,血清sLR浓度逐渐升高。GDM组各孕期血清sLR浓度分别为4.582±1.333、5.863±2.682、5.584±3.914ng/m l,与正常妊娠相比均显著降低(P<0.05),且GDM组内各亚组间比较差异均无统计学意义(P>0.05)。在sLR浓度<4.0、4.0~7.9、8.0~11.9、≥12.0ng/m l水平上,GDM例数及所占比例分别为29(48.3%)、20(33.3%)、9(15.0%)、2(3.3%),除4.0~7.9ng/m l与8.0~11.9ng/m l比较差异无统计学意义(P>0.05)之外,其余两两比较差异均有统计学意义(P<0.05),GDM比例随血清sLR浓度升高而降低。结论孕妇血清sLR浓度越低,GDM的发生率可能越高。
妊娠;糖尿病,妊娠;可溶性瘦素受体
妊娠期糖尿病(gestational diabetes mellitus,GDM)发病率逐年上升,严重危害母婴健康,而其发病机制尚未明确[1]。研究证实,瘦素在胰岛素抵抗及糖脂代谢调节中发挥着重要作用[2-3]。本课题组前期研究证实,孕期胰岛素和高水平瘦素共同参与妊娠期生理性胰岛素抵抗的发生,导致空腹血糖降低,糖耐量下降[4]。在妊娠期生理性胰岛素抵抗状态下,孕妇血清瘦素将随孕周增加而升高,参与调节代谢,维持正常妊娠生理过程,而GDM孕妇血清瘦素显著高于正常妊娠孕妇,与孕周无明显相关性[5],瘦素可能参与GDM的病理生理机制。可溶性瘦素受体(soluble leptin receptor,sLR)是血液中的瘦素转运蛋白,参与调节瘦素生物活性的发挥,并调节瘦素敏感性,进而调控糖脂代谢。众多证据指出,sLR与代谢综合征、2型糖尿病有着密切关系[6-10]。在妊娠过程中,sLR的浓度变化特点及其是否与GDM相关报道甚少。本研究检测随孕期进展正常妊娠及GDM孕妇血清中的sLR浓度,进一步探讨妊娠期sLR的变化特点及其与GDM的关系。
1 资料与方法
1.1 研究对象 随机选取2012年6月-2013年2月于第三军医大学新桥医院门诊常规产前检查及产科住院分娩的正常妊娠孕妇300例(正常妊娠组,A组),根据孕周再分为孕14~19周(A1,n=100)、30~34周(A2,n=100)、足月孕分娩前(≥37周)组(A3,n=100);GDM孕妇60例(GDM组,B组),根据孕周再分为孕14~19周(B1,n=20)、30~34周(B2,n=20)、足月孕分娩前(≥37周)组(B3,n=20);再纳入未孕健康妇女20例作为健康未孕对照组(C组)。纳入标准:单胎;自然受孕;排除合并妊娠期高血压、妊娠期肝内胆汁淤积症、糖尿病合并妊娠、慢性高血压、甲状腺减低症及其他代谢综合征等疾病的孕妇。GDM的诊断依据2010年国际妊娠合并糖尿病研究组织(IADPSG)推荐的标准:于妊娠24~28周进行75g葡萄糖耐量试验(OGTT)筛查,OGTT的诊断界值为空腹血糖5.1mmol/L,糖负荷后1h血糖10.0mm o l/L,糖负荷后2h血糖8.5mmol/L),3项中只要有任何一项血糖值达到或超过上述界值,即可诊断为GDM[11]。体重指数(body mass index,BM I)用体重/身高2(kg/m2)表示。3组间年龄、BM I差异均无统计学意义(P>0.05)。
1.2 标本采集 采集各组研究对象晨起空腹肘静脉血3~5m l,离心分离血清,收集1m l上清液血清,放入-70℃冰箱保存待测。
1.3 检测方法 血清sLR浓度采用酶联免疫吸附双抗体夹心法(ELISA法)测定。人sLR ELISA试剂盒购于重庆海韵生物有限公司,检测范围0.2~60.0ng/ m l,检测步骤按试剂盒说明进行。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以x±s表示,多组均数间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,不同sLR浓度水平与GDM的关系采用χ2检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 正常妊娠时血清sLR的变化 随着妊娠进展,正常妊娠时孕妇血清sLR浓度显著升高(P<0.05)。孕14~19周时sLR浓度(7.091±4.039ng/m l)显著高于未孕时(4.095±0.996ng/m l,P<0.05),孕30~34周时sLR浓度(8.543±5.460ng/m l)显著高于孕14~19周(P<0.05),足月孕分娩前sLR浓度达高峰(10.130±7.069ng/m l,P<0.05)。
2.2 GDM组与正常妊娠组的血清sLR浓度比较 与正常妊娠组相比,中、晚孕及足月孕分娩前GDM组孕妇血清sLR均显著降低(P<0.05),而GDM组孕妇不同孕期血清sLR浓度比较无明显差异(P>0.05,表1)。
表1 GDM组与正常妊娠组不同孕期血清sLR浓度比较(ng/m l,±s)Tab.1 sLR levels of normal and GDM pregnant women in different gestational periods (ng/m l,±s)

表1 GDM组与正常妊娠组不同孕期血清sLR浓度比较(ng/m l,±s)Tab.1 sLR levels of normal and GDM pregnant women in different gestational periods (ng/m l,±s)
(1)P<0.05 compared with 14-19 weeks; (2)P<0.05 compared with 30-34 weeks; (3)P<0.05 compared with normal pregnant group in the same gestational week
Group 14-19 weeks 30-34 weeks Full-term before delivery Normal pregnant (n=100) 7.091±4.039 8.543±5.460(1)10.130±7.069(1)(2)GDM (n=20) 4.582±1.333(3)5.863±2.682(3)5.584±3.914(3)
2.3 血清sLR浓度与GDM发生的关系 将血清sLR分为4个浓度段,分别为<4.0ng/m l、4.0~7.9ng/m l、8.0~11.9ng/m l、≥12.0ng/m l,分析血清sLR浓度与GDM发病的关系,不同sLR浓度水平GDM患者例数及所占比例见表2。统计分析结果显示,随血清sLR浓度升高,GDM所占比例逐渐降低(P<0.05)。
3 讨 论
3.1 sLR的来源及功能 瘦素受体由糖尿病基因(db)编码产生,人db基因定位于染色体1p31。目前已知的瘦素受体由于其m RNA选择性剪切而至少存在6型(Ob-Ra、Ob-Rb、Ob-Rc、Ob-Rd、Ob-Re、Ob-Rf),其中除Ob-Re外,其余均含有胞内结构域,统称为跨膜受体,而Ob-Re仅含胞外结构,为可溶性亚型,称为sLR[12]。有学者认为sLR除由mRNA编码外,还可由跨膜瘦素受体在蛋白酶水解作用下胞外域脱落产生[13-14],然而目前未发现编码人sLR的特异mRNA,因此,人sLR可能由金属蛋白酶水解膜受体胞外域生成。sLR主要存在于外周血清中,是重要的瘦素结合、转运蛋白,可调节瘦素的浓度及生物活性,对瘦素下游信号的调控至关重要,可间接参与调节摄食、能量、糖脂代谢等[15-16]。Cohen等[17]研究证实,在细胞水平,sLR增加不会直接干扰瘦素信号,但可调节瘦素的可利用率及清除,增加瘦素敏感性,使瘦素作用增强。而sLR降低伴随着瘦素结合减弱及瘦素功能受损,提示血清sLR浓度与瘦素功能呈正相关[18]。由此可见,虽然sLR的功能未完全阐明,但目前多认为其可延迟瘦素清除,调节瘦素浓度,调控瘦素的可利用率和生物活性。
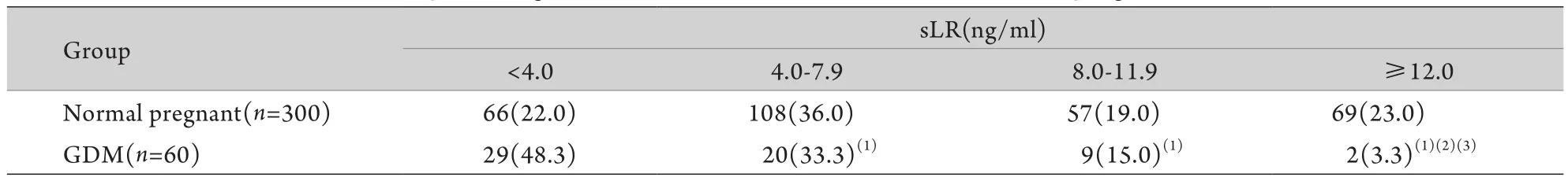
表2 正常妊娠组和GDM组不同浓度sLR水平的例数及百分比[n(%)]Tab.2 Cases and percentage of different sLR levels in normal and GDM pregnant women [n(%)]
3.2 妊娠过程中sLR水平的变化 正常妊娠时,母体血清瘦素浓度随孕周增加而升高,而有研究证实妊娠期孕母sLR水平也发生了变化。Gavrilova等[19]证实肥胖小鼠(ob/ob)胎盘于妊娠第14天开始表达sLR,使得孕鼠血sLR随孕龄增加而升高,分娩前达高峰,约为非孕时的40倍。Lewandowski等[20]研究指出人妊娠相关的sLR升高幅度相对较低,增加约2倍。本研究结果显示,妊娠时母体血sLR水平显著高于未孕女性,且血sLR水平随妊娠进展升高,孕晚期显著高于孕中期,分娩前达高峰,约为未孕组的2倍。妊娠时,胎盘组织不仅分泌维持妊娠所需的多种激素及酶,而且还是母体血瘦素升高的主要来源。胎盘也可表达多种瘦素受体,人孕母血sLR增多可能是由于胎盘跨膜受体胞外域脱落增加所致。sLR可作为运输工具将胎盘合成的瘦素运输至母体组织及胎儿体内,发挥生物效应,母体血清中sLR的变化可进一步促进妊娠时高瘦素血症的形成。另外,有研究指出脐血中可检测到sLR,且孕晚期脐血瘦素水平与胎儿出生体重呈正相关,瘦素信号可促进胎儿生长发育,而sLR作为瘦素运输蛋白及瘦素浓度和生物活性的调节者,可能参与了胎儿出生体重的调节[21]。由此可见,妊娠时胎盘来源的sLR随妊娠进展而增加,以调节瘦素活性,维持妊娠时摄食、能量消耗及糖脂代谢平衡等,还可将胎盘来源的瘦素转运至胎儿,促进胎儿的生长发育,对母儿健康均具有重要作用。
3.3 sLR与GDM发病的关系 目前sLR与GDM发病的关系研究甚少,但一些sLR与代谢综合征相关性的研究表明两者有密切联系。有研究认为,低浓度sLR是代谢综合征的独立危险因素,可作为代谢综合征的预测指标[7-8,18]。Sun等[9]研究发现血清sLR浓度与2型糖尿病发病风险呈负相关。这些发现解释了在许多代谢疾病中,sLR浓度与瘦素敏感性呈正相关的现象。sLR浓度越低瘦素敏感性越低,而瘦素抵抗可降低胰岛素敏感性,加重胰岛素抵抗。
GDM患者除存在胰岛素抵抗外,还具有明显的瘦素抵抗。本课题组前期研究证实了C57BL/KSJ Lepr db/+小鼠作为GDM动物模型的可行性,推测瘦素受体可能与GDM发病相关,而sLR是瘦素功能发挥的重要调节者,跨膜受体是sLR的重要来源。已有研究证实sLR与2型糖尿病的发病有关,因此猜测sLR也参与了GDM的发病。本研究证实,GDM组不同孕期sLR水平均显著低于同孕期正常妊娠组,且不随孕周增加而升高,且血清sLR浓度越低,GDM所占比例越高,考虑其原因可能为:妊娠时,虽然胎盘分泌瘦素,使母体血清瘦素增加,但血清sLR减少,瘦素结合率减低,运输、转运至靶器官的瘦素减少,瘦素功能受损,形成相对性瘦素抵抗;在妊娠生理性胰岛素抵抗状态下,瘦素对糖脂代谢的调节通路亦出现异常,因此不能维持妊娠期的代谢平衡,从而出现糖脂代谢紊乱及GDM发生;同时,sLR与瘦素间存在反馈调节机制,血清sLR减少可反馈性地使瘦素合成增加,因此,GDM患者较正常妊娠者高瘦素血症更加显著。另外,sLR减少可使向胎儿转运的胎盘源性瘦素减少,从而影响胎儿生长发育,这可能是导致GDM孕妇巨大儿、胎儿生长受限发生率高的原因之一。
综上所述,sLR与妊娠生理有着十分密切的关系,妊娠过程中血清sLR升高,可调节瘦素的生物活性,调控糖脂代谢,而低浓度sLR则可能导致GDM发病。孕母血清sLR浓度能否作为GDM临床预测的指标及其临界值仍需要大量研究证实,妊娠时导致血清sLR改变的因素亦需进一步探索。
[1] Kuang DF, Hua SF, Han YH.Effects o f abnormal lipid metabolism in patients w ith gestational diabetes mellitus on body mass of newborn[J].Tianjin Med J, 2012, 40(11): 1128-1130.[匡德凤, 华绍芳, 韩玉环.妊娠期糖尿病患者脂代谢异常对新生儿出生体质量的影响[J].天津医药, 2012, 40(11): 1128-1130.]
[2] Marroqui L, Gonzalez A, Neco P, et al.Role of leptin in the pancreatic beta-cell: effects and signaling pathways[J].J Mol Endocrinol, 2012, 49(1): R9-R17.
[3] Morton GJ, Schwartz MW.Leptin and the central nervous system control of glucose metabolism[J].Physiol Rev, 2011, 91(2): 389-411.
[4] Xin J, Huang J, Li Z.Effect of leptin gene methylation on glucose metabolism in pregnant rats[J].Med J Chin PLA, 2011, 36(11): 1167-1170.[辛静, 黄金, 李真.瘦素基因甲基化对孕鼠糖代谢变化的影响[J].解放军医学杂志, 2011, 36(11): 1167-1170.]
[5] Chen ZQ, Cheng Y, Su HY, et al.Clinical study of maternal sem m leptin levels as a predictor of gestational diabetes mellitus andgestational impaired glucose tolerance[J].Chin J Obstet Gynecol, 2005, 40(3): 164-167.[陈正琼, 成娅, 苏红媛, 等.孕妇血清瘦素水平测定对妊娠期糖耐量异常的预测价值[J].中华妇产科杂志, 2005, 40(3): 164-167.]
[6] Martins CJ, Genelhu V, Sanjuliani AF, et al.Association between leptin and its soluble receptor with cardiometabolic risk factors in a Brazilian population[J].Eur J Intern Med, 2012, 23(6): e131-e135.
[7] Yu D, Yu Z, Sun Q, et al.Effects of body fat on the associations of high-molecular-weight adiponectin, leptin and soluble leptin receptor with metabolic syndrome in Chinese[J].PLoS One, 2011, 6(2): e16818.
[8] Hamnvik OP, Liu X, Petrou M, et al.Soluble leptin receptor and leptin are associated with baseline adiposity and metabolic risk factors, and predict adiposity, metabolic syndrome, and glucose levels at 2-year follow-up: the Cyprus Metabolism Prospective Cohort Study[J].Metabolism, 2011, 60(7): 987-993.
[9] Sun Q, van Dam RM, Meigs JB, et al.Leptin and soluble leptin receptor levels in plasma and risk of type 2 diabetes in U.S.women: a prospective study[J].Diabetes, 2010, 59(3): 611-618.
[10] Ingelsson E, Larson MG, Yin X, et al.Circulating ghrelin, leptin, and soluble leptin receptor concentrations and cardiometabolic risk factors in a community-based sample[J].J Clin Endocrinol Metab, 2008, 93(8): 3149-3157.
[11] Metzger BE, Gabbe SG, Persson B, et al.International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycem ia in pregnancy[J].Diabetes Care, 2010, 33(3): 676-682.
[12] Gorska E, Popko K, Stelm aszczyk-Emmel A, et al.Lep tin receptors[J].Eur J Med Res, 2010, 15(Suppl 2): 50-54.
[13] Gallardo N, Arribas C, Villar M, et al.ObRa and ObRe are differentially expressed in adipose tissue in aged food-restricted rats: effects on circulating soluble leptin receptor levels[J].Endocrinology, 2005, 146(11): 4934-4942.
[14] Schaab M, Kausch H, K lamm t J, et al.Novel regu lato ry mechanisms for generation of the so luble leptin receptor: implications for leptin action[J].PLoS One, 2012, 7(4): e34787.
[15] Lammert A, Kiess W, Bottner A, et al.Soluble leptin receptor represents the main leptin binding activity in human blood[J].Biochem Biophys Res Commun, 2001, 283(4): 982-988.
[16] Huang L, Wang Z, Li C.Modulation of circulating leptin levels by its soluble receptor[J].J Biol Chem, 2001, 276(9): 6343-6349.
[17] Cohen SE, Kokkotou E, Biddinger SB, et al.High circulating leptin receptors with normal leptin sensitivity in liver-specific insulin receptor knock-out (LIRKO) m ice[J].J Bio l Chem, 2007, 282(32): 23672-23678.
[18] Sandhofer A, Laimer M, Ebenbichler CF, et al.Soluble leptin receptor and soluble receptor-bound fraction of leptin in the metabolic syndrome[J].Obes Res, 2003, 11(6): 760-768.
[19] Gavrilova O, Barr V, Marcus-Samuels B, et al.Hyperleptinem ia of pregnancy associated with the appearance of a circulating form of the leptin receptor[J].J Biol Chem, 1997, 272(48): 30546-30551.
[20] Lewandowski K, Horn R, O'Callaghan CJ, et al.Free leptin, bound leptin, and soluble leptin receptor in normal and diabetic pregnancies[J].J Clin Endocrinol Metab, 1999, 84(1): 300-306.
[21] Schulz S, Hackel C, Weise W.Hormonal regulation of neonatal weight: placental leptin and leptin receptors[J].BJOG, 2000, 107(12): 1486-1491.
Correlation between serum soluble leptin receptor level and gestational diabetes mellitus
WANG Ya-nan, LI Zhen*, WU Xiao-hua, CHEN Li-ping
Department of Obstetrics and Gynecology, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
*
, E-mail: drlizhen@sina.cn
ObjectiveTo investigate the serum levels of soluble leptin receptor (sLR) in normal pregnant women and women with gestational diabetes mellitus (GDM) in gestational period, and the correlation between sLR and GDM.Methods three hundred normal pregnant women (group A), 60 pregnant women w ith GDM (group B), and 20 healthy non-pregnant women (group C) were randomly selected from Jun.2012 to Feb.2013 in Xinqiao Hospital of third Military Medical University.Group A and group B were respectively divided into 3 subgroups according to gestational ages: 14-19 weeks (A1, n=100; B1, n=20), 30-34 weeks (A2, n=100; B2, n=20), full-term before delivery (≥37weeks) (A3, n=100; B3, n=20).Serum sLR levels of all groups were determined by enzyme-linked immunosorbent assay (ELISA), features of changes in sLR levels within and between groups were analyzed, and the correlation between serum sLR and GDM was analyzed.Results the serum sLR concentrations of normal pregnant women at three diferent gestational periods were 7.091±4.039, 8.543±5.460 and 10.130±7.069ng/m l, respectively, and they were much higher than that of non-pregnant women (4.095±0.996ng/m l, P<0.05), and the diferences among diferent gestational periods showed statistical signifcance (P<0.05).With the progression of the pregnant duration, the serum sLR levels of normal pregnant women increased dramatically.the serum sLR levels in women with GDM at three diferent gestational periods were 4.582±1.333, 5.863±2.682 and 5.584±3.914ng/m l, respectively, and they were much lower than those of normal pregnant women.However, no signifcant diference was found among the subgroups of group B (P>0.05).At four levels of sLR <4.0ng/m l, 4.0–7.9ng/m l, 8.0–11.9ng/m l and ≥12.0ng/m l, the cases and proportion of GDM were 29(30.53%), 20(15.63%), 9(13.64%) and 2(2.82%), signifcant diferences were found between diferent sLR concentrations for proportion of GDM (P<0.05) except between 4.0–7.9ng/m l and 8.0–11.9ng/m l (P>0.05).ConclusionSerum sLR level is negatively correlated with GDM, the lower the concentration of sLR, the higher the incidence of GDM.
pregnancy; diabetes, gestational; soluble leptin receptor
R714.256
] 0577-7402(2014)02-0125-04
10.11855/j.issn.0577-7402.2014.02.09
2013-10-09;
2013-12-26)
(责任编辑:张小利)
This work was supported by the National Natural Science Foundation of China (30973203)
国家自然科学基金(30973203)
王亚男,硕士研究生。主要从事围产医学方面的研究
400037 重庆 第三军医大学新桥医院妇产科(王亚男、李真、吴晓华、陈莉萍)
李真,E-mail:drlizhen@sina.cn
