NAA种子期处理对黄瓜种子萌发与幼苗生长的影响
2014-08-01田艳春
田艳春
NAA种子期处理对黄瓜种子萌发与幼苗生长的影响
田艳春
(赤峰学院 生命科学学院,内蒙古 赤峰 024000)
用不同浓度的α-萘乙酸(NAA)200mg/L、400mg/L、600mg/L处理黄瓜种子12小时,以蒸馏水为对照,进行恒温催芽及幼苗培养,观察其对黄瓜种子萌发及幼苗生长的影响,结果表明:NAA处理对黄瓜种子的萌发与幼苗生长有明显的促进作用,发芽率、发芽势、壮苗指数和G值均比对照高,且随着处理浓度的增加各项指标呈现先上升后下降的趋势,其中400mg/L处理对黄瓜种子萌发及幼苗生长的促进作用最明显,为本实验筛选的最佳浓度.
α-萘乙酸(NAA);黄瓜;种子萌发;幼苗生长
黄瓜(Cucumis Sativus L.)是葫芦科(Cucurbitaceae)一年生草本植物,原产于喜马拉雅山南麓,是人们喜食的一种蔬菜[1].从口感上,黄瓜肉质脆嫩、汁多味甘、芳香可口;营养上,它含有蛋白质、脂肪、糖类,多种维生素、纤维素以及钙、磷、铁、钾、钠、镁等丰富的成分.尤其是黄瓜中含有的细纤维素,可以降低血液中胆固醇、甘油三酯的含量,促进肠道蠕动,加速废物排泄,改善人体新陈代谢.且新鲜黄瓜中含有的丙醇二酸,还能有效地抑制糖类物质转化为脂肪,因此,常吃黄瓜可以减肥和预防冠心病的发生.此外黄瓜还有清热利水,解毒消肿之功效,在我国各地蔬菜栽培中占有重要地位,在世界上分布也十分广泛,目前己成为人们餐桌上必不可少的蔬菜之一.
萘乙酸(Naphthalene acetic acid,NAA)是一种重要的广谱性植物生长调节剂,因其不易受可见光、紫外线及植物体内吲哚乙酸氧化酶所破坏,而且原料丰富,生产过程简单,故广泛应用于农业、林业、蔬菜、花卉、果树等领域[2].大量实验表明适量浓度的α-萘乙酸可刺激生长插条生根、诱导开花、提高座果率、增强植物抗性、促进早熟和增产等[2]. NAA有双重作用,表现为既能促进发芽,又能抑制发芽,既能促进生长,又能抑制生长.这取决于细胞的年龄、NAA的浓度、器官的种类.研究表明:NAA对种子在萌发过程中生理活动或特性的影响,不是其本身的直接作用,它可能与受体结合以后,作为第二信使,激活了其它调控机制,进而对植物生长发育产生影响[3].
黄瓜属喜温作物,种子发芽适温为25~30℃,生长适温为18~32℃.黄瓜对土壤水分条件的要求较严格,生长期间需要供给充足的水分.由于北方气温低,气候干燥,黄瓜根系分布浅,再生能力较弱,加之黄瓜的生长周期比较长,这就造成了黄瓜长势不理想,上市也比较晚,产量也比较低,为了提早黄瓜的上市时期,增加产量,创造更多的经济价值,很多实验表明一些生长物质、植物激素对黄瓜的生长都有促进作用,与其它物质相比较NAA在稳定性和价格方面都适合于推广应用,所以利用NAA处理黄瓜种子从而达到促进植株生长发育的目的,这对于黄瓜等蔬菜的生产增收有着重要意义.但不同浓度的NAA处理对黄瓜的影响是不同的,下面通过实验探讨一下促进黄瓜种子萌发与幼苗生长最佳浓度.
1 材料与方法
1.1实 验材料
本实验于2012年10月在赤峰学院生命科学系植物学实验室中进行,实验材料为天津市绿丰园艺新技术开发有限公司研制的津绿21-18黄瓜种子,实验药品为α-萘乙酸.
1.2实 验方法
本实验采用不同浓度NAA处理黄瓜种子,实验浓度设计为:200mg/L、400mg/L、600mg/L,以蒸馏水为对照.2012年10月1日,每个浓度选取籽粒饱满的黄瓜种子100粒进行浸种,12小时后,将浸好的种子用纱布滤出,蒸馏水冲洗,随机放在铺有5层滤纸的培养皿中,贴好标签,并各加30mL蒸馏水浸润[4].然后置于25℃培养箱中催芽(注意:保持湿润,但水不要过多,以倾斜时皿底无溶液和聚为宜),每24小时观察和记录一次各项指标.10月6日,每一处理选取10粒黄瓜种子随机播种于标记好的花盆中,实验期间土壤湿度在50%~60%左右,两次重复,培养30天后,每组处理随机选取5株幼苗从花盆中小心拔出,测量并记录株高和茎粗,以及地上部与地下部鲜重,然后置于70℃的干燥箱中进行烘干,48小时后取出并称量地上部与地下部干质量.
2 结果与分析
2.1不 同浓度NAA种子期处理对黄瓜种子萌发的影响
2.1.1 对黄瓜种子发芽率、发芽势的影响
种子发芽率是指发芽实验的终期,在规定日期内全部正常发芽种子数占供试实验种子数的百分率[1].种子发芽势,是指发芽实验初期,规定的日期内正常发芽种子的百分率[5].表1表明:在黄瓜种子期用NAA处理,黄瓜种子的发芽率、发芽势均高于对照,并表现出先上升后下降的趋势,400mg/L处理的黄瓜种子的发芽率和发芽势最高,其差异达到了极显著水平,其发芽率比对照的增加了16.87%,比200mg/L处理和600mg/L处理分别增加了11.49%和11.49%,发芽势比对照增加了32.86%,比200mg/L和600mg/L处理分别增加了32.86%和30.99%.NAA对黄瓜种子发芽的影响,可能是由于NAA处理增强了种子的活性.
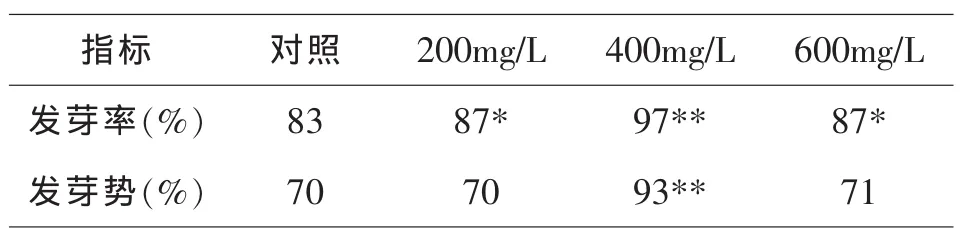
表1 不同浓度NAA浸种处理对黄瓜种子发芽率、发芽势的影响
2.1.2 对黄瓜种子发芽指数、活性指数的影响
发芽指数与活性指数是表现种子萌发力的重要指标,二者成正相关,其中活性指数包括发芽速率与幼苗生长势两个变量,全面表征种子活力[5].表2表明:400mg/L处理的种子活力比较高,其差异与对照达到极显著水平,变化规律与发芽率、发芽势一致,但随着催芽时间的延长,这种差异也越来越不明显,可能种子萌发受到自身营养的限制. 400mg/L处理的发芽指数比对照增加了30.96%,比200mg/L和600mg/L处理分别增加了15.70%和25.85%.活性指数比对照增加了31.63%,比200mg/L和600mg/L处理分别增加了22.86%和27.72%.说明400mg/L为本实验设计的浓度中对种子活力影响最大的浓度,排除种子质量等其它因素的干扰,总体来看,NAA对黄瓜种子萌发确有一定的促进作用,也就是说,其能提高种子的活力[1].

表2 不同浓度NAA浸种处理对黄瓜种子发芽指数、活性指数的影响
2.2不 同浓度NAA浸种对黄瓜幼苗的影响
2.2.1 对黄瓜幼苗生长的影响
表3表明,在黄瓜幼苗生长过程中,对照组幼苗的生长速度略高于其它处理组,实验后期,400mg/L处理黄瓜的幼苗生长明显比对照好,而其它两个处理并不明显,且各项指标呈现先上升后下降的趋势.所有NAA处理全株干重都要比对照高,其中400mg/L处理比对照增加了66.34%,比200mg/L和600mg/L分别增加了29.46%和29.65%.由此可以得出,种子期用NAA进行处理,促进了黄瓜幼苗的生长,起到了壮苗作用,且对黄瓜幼苗根系生长和物质的积累有明显的促进作用[7],这对于黄瓜的生长、增强抗性和果实成熟有重要意义.
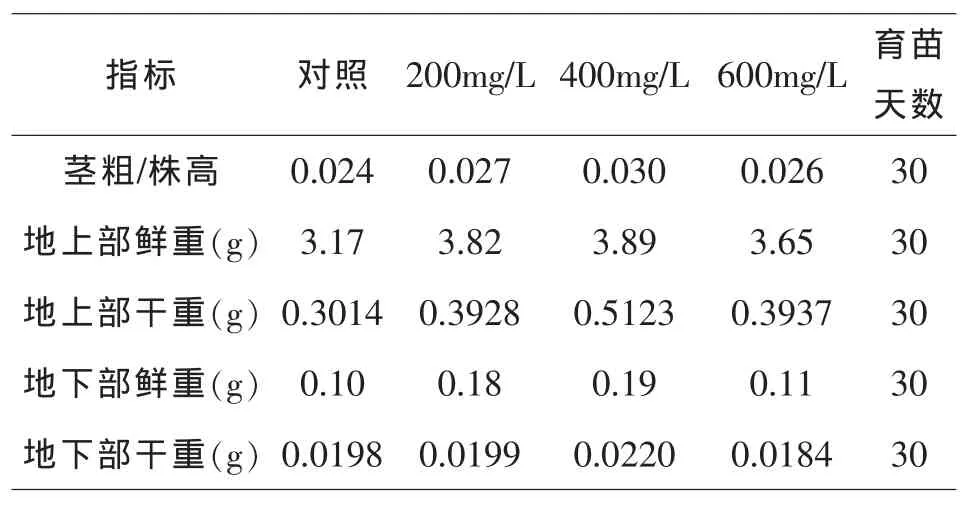
表3 不同浓度NAA种子期处理对黄瓜幼苗生长的影响
2.2.2 对G值和壮苗指数的影响
不同浓度NAA浸种处理对黄瓜幼苗的影响,用壮苗指数和G值来衡量,其中G值更能直接的反应幼苗在生育期内的生长情况.在黄瓜的幼苗期,400mg/L处理的黄瓜幼苗的株高低于对照、茎粗明显高于对照,而200mg/L与600mg/L处理的黄瓜幼苗的株高、茎粗与对照相当.图1、2表明,一定浓度的NAA对黄瓜幼苗有一定的壮苗作用,黄瓜幼苗的G值和壮苗指数都有先上升后下降的趋势,其中400mg/L处理的最为明显,其G值比对照增加了65.37%,比200mg/L和600mg/L分别增加了29.53%和35.95%,壮苗指数比对照增加了100%,比200mg/L和600mg/L分别增加了47.37%和55.56%.由此说明,NAA浸种对黄瓜幼苗的生长和壮苗确有促进作用.

图1 不同浓度NAA处理对黄瓜瓜幼苗G值的影响

图2 不同浓度NAA处理对黄瓜瓜幼苗壮苗指数的影响
3 结论与讨论
3.1在 黄瓜种子期用NAA处理,对黄瓜种子的萌发有一定的促进作用
外源激素浓度不同对种子影响的机制也不同,外源激素进入正常的种子后,促进了许多水解酶(如:淀粉酶、蛋白酶等)的活性,从而促进了贮藏物质的水解,供给幼胚生长所需,所以加快了种子萌发.外源激素进入种子的量是由种子的吸水过程决定的,浸种时种子是靠吸胀进行吸水的.处理浓度高,则吸水速度和吸水量就大,而吸入的越多,种子内的激素浓度大,处理浓度低,则吸水速度和吸水量就相对较少,种子内激素浓度相对较低[10].本实验中,NAA处理的黄瓜种子的各项指标呈现先上升后下降的趋势,其中200mg/L与400mg/L处理的黄瓜种子的发芽率、发芽势、发芽指数与活性指数均高于对照,其中400mg/L处理要明显高于对照,且差异与对照达到了极显著水平,说明此浓度是促进黄瓜种子萌发的最佳浓度.
3.2对 黄瓜幼苗的生长起到了壮苗作用
植物生长是细胞分裂及细胞生长的总和,细胞分裂只发生在植物分生组织中,而细胞生长则发生在植物各器官的伸长区,NAA的主要影响在于增加细胞壁的伸展,NAA通过第二信使促进水解酶的活性,从而打开细胞壁纤维结构间交结点的键,所以NAA能促进植物幼茎生长和促进弹性伸长[11,12].本实验中,各处理的G值和壮苗指数均高于对照,其中400mg/L与对照达到了极显著水平,再次证明了400mg/L的NAA是幼苗生长的最适浓度.且NAA处理所有黄瓜幼苗的茎都有所加粗,其真叶生长也比对照快,说明NAA对壮苗生长有一定的作用.这与乙烯利浸种幼苗生长的影响的实验结果相同.NAA促进黄瓜幼苗根和茎伸长,根加粗,同时还可以促进真叶的生长,这一结果与前人的实验结果是一致的.
实验表明:适宜浓度NAA种子期处理黄瓜种子对黄瓜种子的萌发和幼苗的生长有促进作用,且最佳的最适浓度为400mg/L,此浓度对黄瓜种子的萌发与幼苗的生长有明显的促进作用.在生产中,如果用400mg/L浓度的NAA对黄瓜种子浸种12h后进行播种,就能够达到提高黄瓜生长速度、并使植株更加健壮的目的,从而能使黄瓜提早成熟、早日上市、并增加了产量,创造更多的经济效益.
〔1〕秦立金,徐振军,袁树祥.乙烯利浸种对冬季日光温室黄瓜种子萌发与幼苗生长的影响 [J].安徽农业科学,2012(22):10601-10602.
〔2〕姜孝成,陈益芳.萘乙酸浸种对“湘早籼11号”种子萌发的影响[J].湖南师范大学自然科学学报,1997(4).
〔3〕张林静,原跃军,王诚刚,潘晓玲.水杨酸和萘乙酸对山茱萸种子萌发的生理学影响[J].山西师范大学学报(自然科学版),2006(4).
〔4〕夏铁骑,陶令霞.NAA对小麦根、芽生长的影响[J].濮阳教育学院学报,2001(1).
〔5〕王敏,杨思泽,等.大气压等离子体对黄瓜种子萌发及幼苗生长的影响 [J].农业工程学报,2012(2).
〔6〕舒英杰,周玉丽,张子学,随益虎.外源水杨酸对提高黄瓜萌发种子抗冷性的效应[J].中国农学通报,2006(10).
〔7〕鲁旭东,黄妤.几种植物生长调节剂浸种对黄瓜种子萌发和幼苗生长的影响[J].孝感学院学报,2005(3).
〔8〕田丽岩,王福全.萘乙酸对丁香幼苗生长的影响[J].高师理科学刊,2004(3).
〔9〕夏丽华,依艳丽,刘孝义.磁场处理对几种种子活力的影响[J].松辽学刊(自然科学版),2000(1).
〔10〕云兴福,张受远.植物激素对黄瓜种子萌发的影响[J].内蒙古林业科技,1991(4):1007-4066.
〔11〕孟焕文,程智慧,高艳明.矮壮素浸种对黄瓜幼苗生长的影响[J].陕西农业科学,1998(4).
〔12〕Drew RLK Brocklehurst PA.The effects of PH during treatment of lettuce seeds with chlorine-releasing compounds on germ ination and seedling development.Ann Appl Biol, 1985,106(1):157.
S642.2
A
1673-260X(2014)10-0018-03
