白芨种子的高效萌发及其无性繁殖体系的构建*
2014-07-30王楷李玥张云峰田宝强杨秀梅普家宁严胜柒
王楷, 李玥, 张云峰,2,3, 田宝强, 杨秀梅, 普家宁, 严胜柒
(1.云南师范大学 生命科学学院,云南 昆明650500;2.教育部生物能源持续开发利用工程中心,云南 昆明6505002;3.云南师范大学、台湾新竹清华大学联合实验室,云南 昆明650500;4.昭通市农业技术推广研究所,云南 昭通657000)
白芨 (Bletilla striata (Thunb.)Reichb.f.)为兰科白芨属的多年生草本植物,别名紫兰、紫蕙、百笠等.全世界白芨属植物有6种,我国有4种,分别为白芨、小白芨 (B.formosana(Hayata)Schltr.)、黄花白芨 (B.ochracea Schltr.)及华白芨(B.sinensis(Rolfe)Schltr.).白芨假鳞茎为我国传统中药[1],含有近50种化合物[2],具有收敛、补血、止血、消肿等多种功能[3-4].现代药理研究表明白芨可使凝血酶生成时间缩短,能抑制纤维蛋白酶的活性,使细胞快速凝聚形成血栓而止血[5],具有保护胃黏膜[6]、抗真菌[7]及抗癌[8]等作用.此外,白芨胶还可用作乳化剂、悬浮剂,代替西黄蓍胶和阿拉伯胶,在医药、化工、食品等方面的应用前景十分广阔[9].
由于野生白芨遭到过度采挖,加上其野生生境的破坏,导致我国野生白芨资源急剧减少,濒临灭绝,已被国家列为珍稀濒危的保护植物[10].白芨种子非常细小且无胚乳,自然状况下萌发率极低,并且生长缓慢.传统栽培主要依赖分株繁殖[11],而分株繁殖周期长、繁殖效率低、耗种量大,很难满足规模栽培的需要.自Kundson首次进行兰科植物种子的无菌萌发以来,无菌萌发已成为兰科植物种质保存及规模繁殖的重要手段.兰科种子的萌发率依赖于培养基的种类、培养基中的添加物及外源激素.添加椰汁乳、香蕉汁、菠萝汁、马铃薯汁等能促进种子的萌发,其中椰汁乳被认为是最为有效的添加物[12].目前,国内对白芨无菌播种已有诸多的报道[13-14],并对白芨种子的无菌萌发过程[15]、白芨种子染菌萌发过程的细胞超微结构变化[16]进行了研究,这些研究对白芨种质资源保护及其繁殖具有较大的促进作用,但相关报道中白芨种子的萌发率都较低,而且萌发周期较长.本研究拟以液体培养,以期建立白芨种子的高效无菌萌发体系及其无性繁殖体系,为实现白芨的快速繁殖和工厂化生产提供基础数据.
1 材料与方法
1.1 材料
试验材料为成熟未开裂的野生白芨蒴果,蒴果于2013年7月采自云南省昭通市威信县瓦石村后山(北纬27°49′7.85",东经104°46′57.81").该地区干湿季分明,日温差小,年温差大,年平均气温为12.4℃.冬季雨量少气温低,平均温度为4℃,最低温度为-1.0℃;夏季雨量大气温高,平均温度为21.6℃,最高温度31.4℃.
1.2 方法
1.2.1 无菌播种
选取成熟未裂蒴果用流水洗净,在超净台内进行表面消毒,消毒过程为:75%的酒精表面消毒30s,再用0.15%的升汞(HgCl2)消毒10min,无菌水冲洗5~6次,用无菌滤纸吸干表面水分.在无菌条件下,用手术刀纵向剖开蒴果,用镊子夹取蒴果外壳,将种子均匀播种于培养基.放置种子后先将培养基置于暗条件下培养,种子萌发后再移至光照条件下.基本培养基采用MS、1/2MS的大量元素及全量的微量元素[17]、KC[18]和 VW[19],每类基本培养基又设置8组,如表1.所有培养基均添加3%的蔗糖,固体培养基添加0.6%的琼脂粉.灭菌前将培养基的pH值调整到5.8,每个处理重复8次.种子培养30d后,观察基本培养基、培养基类型、添加物及6-BA浓度对种子萌发率的影响.在低倍倒置显微镜下以每个处理统计200粒种子的萌发计算,统计重复5次.

表1 种子萌发培养基Table 1 Mediums used for seed germination in Bletilla striata
为检验椰子汁浓度对白芨种子萌发的影响,作了补充实验:以1/2MS为基本培养基,设置5个组,每组8瓶,分别添加0、10%、20%、30%、40%的椰汁乳.所有培养基6-BA 浓度为1.0mg·L-1,均添加3%的蔗糖,灭菌前将pH值调整至5.8.培养30d后观察各组的种子萌发率,并测量各组的原球茎鲜重及原球茎长度.原球茎鲜重(M)测量方法:种子放置培养基后,立即称量并记录为M1,30d后用同样的方法称量并记录为M2,则M=M2-M1.每个处理记录5瓶,求平均数.
1.2.2 测定发育后种子活力
种子播种培养30d后,用0.1%的 TTC(2,3,5-Triphenyltetrazolium chloride,氯化三苯基四氮唑)溶液测定种子活力,染色时间为0.5h,5次重复.着色后,在显微镜下观察种子染色情况,随机选取3个视野,分别计算每个视野的种子总数、有活力种子数和败育种子数.凡是胚染成有光泽的鲜红色,为有生活力的种子;凡是完全不染色或染成无光泽的淡红色或灰白色,为败育或无活力种子数.
1.2.3 无性繁殖体系构建
种子萌发形成原球茎后,将原球茎转接到无性繁殖培养基上进行培养,培养基以全量MS为培养基,添加10%椰汁乳、3%蔗糖及不同激素6-BA(6-Benzylaminopurine)和 NAA(1-Naphthaleneacetic acid)的组合配比(表2),pH 调至5.8.每个处理接种10瓶.培养温度(26±2)℃,光照强度2 200~2 600lx,光照时间10h/d.培养30d后,观察原球茎的生长状况和调查原球茎继代增殖数情况,增殖倍数以继代培养35d的原球茎突起数与继代当天的原球茎数比值.

表2 扩繁培养基Table 2 Medium used for propagation in Bletilla striata
2 实验结果
2.1 白芨种子无菌萌发
采集种子(图1B)经消毒处理播种于培养基,黑暗条件下培养18d后,在液体培养基中可观察到少数种胚膨大(图1G),继而突破种皮开始萌发(图1H-I),转入光照下培养种子开始变绿(图1 F,J).而在固体培养基中,22d后才观察到种子萌发(图1C-E).兰花种子在自然条件下发芽率很低,影响其萌发的因素有种皮的机械阻力和透水性差、种胚发育不全、贮存的营养物质过少以及可能存在抑制物质等.白芨种子也不例外,种子呈粉末状,无胚乳,解剖镜下观察,种子呈纺锤形,结构简单,由1层透明的种皮和1个种胚组成,自然条件下萌发率极低.在后续补充实验中,在固体培养基及液体培养基(6-BA浓度1.0mg·L-1、椰汁乳浓度10%)中添加1%的活性炭并未提高其萌发率.由此推断白芨自然条件下萌发率低与其胚发育程度低及贮存物质不足有关.对培养35d的白芨进行TTC染色,发现液体培养基中的种子活力高(实际是种子培养后的胚存活率)(图1K,图4),而固体培养基中的种子活力低(图1L,图4).
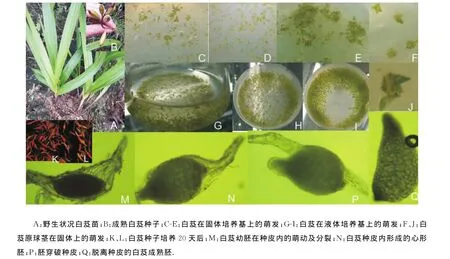
图1 白芨种子萌发过程Fig.1 The seeds germination course of Bletilla striata
2.2 基本培养基对白芨种子萌发率的影响
在激素同为6-BA 0.5mg·L-1的4种基本培养基(1/2MS、MS、KC、VW)中,发现1/2MS培养基中的萌发率最高.1/2MS培养基中的萌发率为(41.93±3.98)%,而在 MS、KC及 VW 培养基中的萌发率分别为(35.75±2.54)%、(29.47±2.39)%及(32.54±3.12)%(图2).在p<0.05时,1/2MS培养基中的萌发率与MS、KC及VW中的差异性显著.说明1/2MS为白芨种子萌发的最适基本培养基.
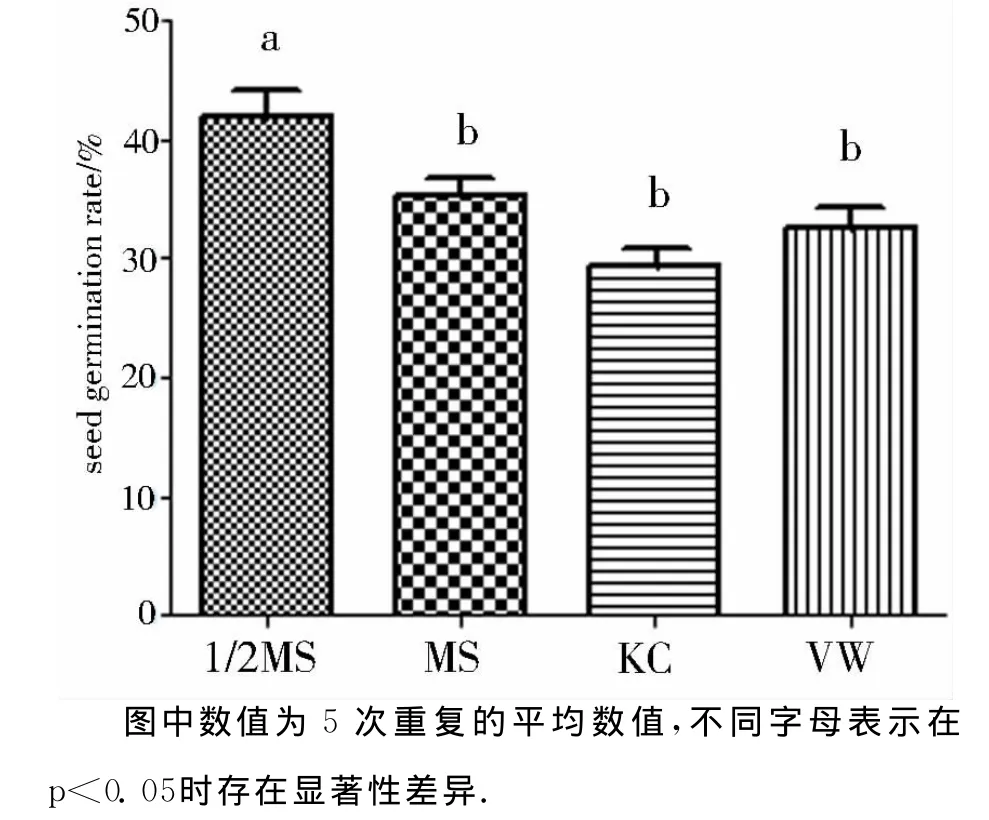
图2 培养基对白芨种子萌发率的影响Fig.2 Effect of various culture medium on seed germination in Bletilla striata
2.3 培养基类型及添加物对萌发率的影响
为确定培养基类型、椰汁乳对白芨种子萌发率的影响,实验对1/2MS大组进行了仔细观察.结果表明,白芨种子在固体培养上的萌发较液体培养慢了4~6d,且转入光照培养后,生长较慢,绿色较淡.固体培养基的萌发率在(41.93±2.41)%~(59.96±6.19)%间,而液体培养基的萌发率在(47.93±4.79)%~(82.47±8.45)%间(图3),表明培养基的类型对白芨种子萌发率的影响较大.在添加10%椰汁乳条件下,6-BA浓度分别为0.5、1.0、1.5时,固体培养中白芨种子的萌发率较液体培养中的分别下降10.87%、22.51%、13.73%,在p<0.05条件下呈显著性差异性(图3),表明在有椰汁乳的情况下,液体培养中的萌发率大大高于固体培养.在6-BA浓度为1.0时,无椰汁乳的固体培养、液体培养中白芨种子的萌发率分别为39.16%、47.93%,较添加椰汁乳的培养基分别降低了20.80%、34.54%,在p<0.05条件下,白芨种子的萌发率呈显著性差异性(图3),表明培养基中添加椰汁乳可有效提高白芨种子的萌发率.种子培养30d后的TCC染色,也发现液体中胚存活率较固体中的胚胎存活率高(图4).

图3 培养基类型及添加物对萌发率的影响Fig.3 The effect of culture medium status and Organic amendments on seed germination rate in Bletilla striata
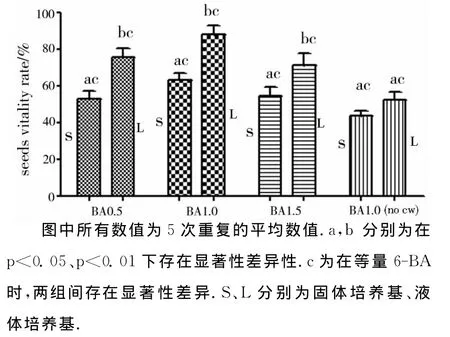
图4 培养30天后固体和液体培养基中种子活力的比较Fig.4 The comparison seeds vitality after 30days culture in solid and liquid medium in Bletillastriata
2.4 6-BA浓度对萌发率的影响
为确定白芨种子萌发的最适6-BA浓度,实验对1/2MS大组进行了进一步分析.有椰汁乳条件下,当6-BA 浓度分别为0.5、1.0、1.5时,在固体、液体培养基中白芨种子的萌发率分别为:(41.93±2.41)%、(59.96±6.19)%、(49.20±4.51)%;(52.71±4.44)%、(82.47±8.45)%、(62.93±3.80)%.从中可以看出,液体培养基中的种子萌发率都较固体的高,提高幅度分别为10.78%、22.51%、13.72%,其 中 6-BA 浓 度 为1.0时的提高幅度最大(图3),即为白芨种子萌发的最适浓度.如不加椰汁乳,在6-BA浓度为1.0时,固体、液体培养中的白芨萌发率分别为(39.16±3.48)%、(47.93±4.79)%,提 高 幅 度 仅 为8.77%.表明6-BA对白芨种子萌发的影响在固体和液体中是一致的,但这种影响与椰汁乳的添加有关,添加椰汁乳可促进6-BA对白芨种子萌发的影响,6-BA及椰汁乳对白芨种子萌发的促进作用间存在互作.
2.5 椰汁乳浓度对白芨种子萌发率及原球茎生长的影响
为研究6-BA、椰汁乳对促进白芨种子萌发的互作作用,在白芨种子萌发的实验中,补充了液体培养基中不同椰汁乳浓度对白芨种子萌发率、原球茎鲜重、原球茎长度的影响实验.在液体培养基中分别添加0、10%、20%、30%、40%的白芨种子萌发 率 分 别 为 (47.96±4.79)%、(82.47±8.45)%、(91.02±4.35)%、(88.97±5.40)%、(77.61±4.59)%.在p<0.05条件下,除未添加椰汁乳培养基外,椰汁乳浓度从10%~40%间没有显著性差异.表明椰汁乳对白芨种子萌发不存在剂量影响(图5),但对白芨种子萌发后所形成的原球茎鲜重及原球茎长度存在明显的影响(图6,图7).当椰汁乳浓度为0、10%、20%、30%、40%时,原球茎的鲜重分别为(0.72±0.06)mg、(1.21±0.10)mg、(1.45±0.09)mg、(1.93±0.13)mg及(1.56±0.06)mg;而原球茎长度分别为(1.67±0.08)mm、(2.86±0.17)mm、(3.33±0.36)mm、(4.29±0.34)mm、(3.29±0.29)mm.种子萌发率最高的椰汁乳添加浓度为20%,而原球茎鲜重及原球茎长度最高的椰汁乳添加浓度是30%,表明椰汁乳对白芨种子萌发及促进原球茎生长的浓度要求是不一样的.
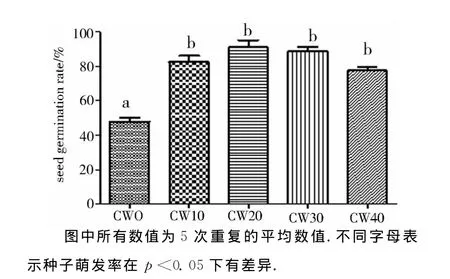
图5 椰汁乳浓度对白芨种子萌发率的影响Fig.5 The effect of coconut water concentration on seed germination in Bletilla striata
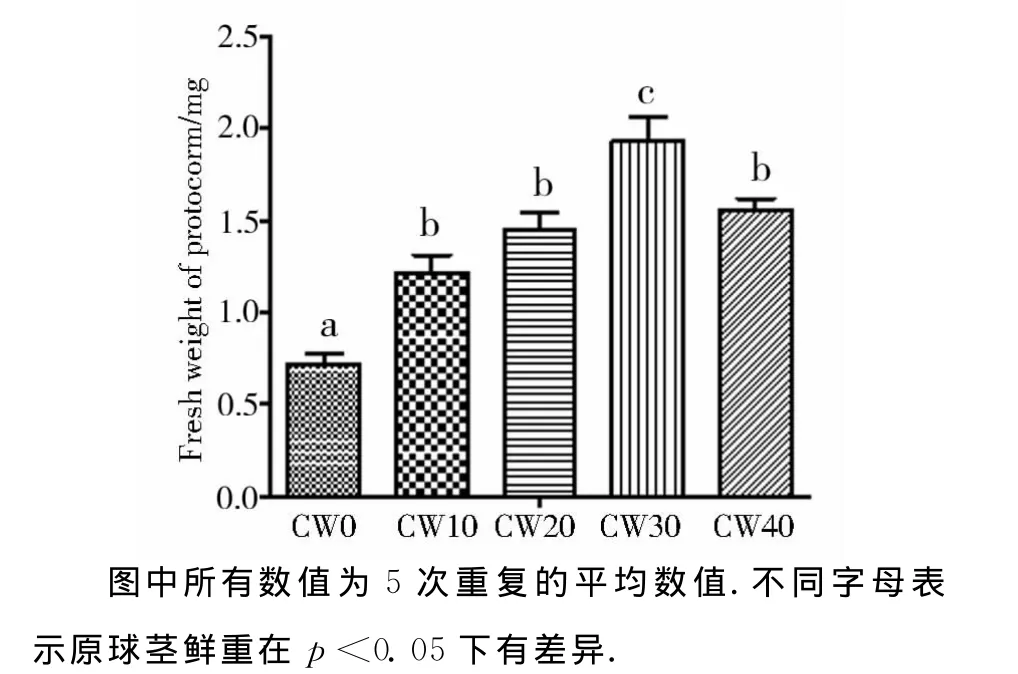
图6 椰子汁浓度对原球茎鲜重的影响Fig.6 The effect of coconut water concentration on protocorm fresh weight
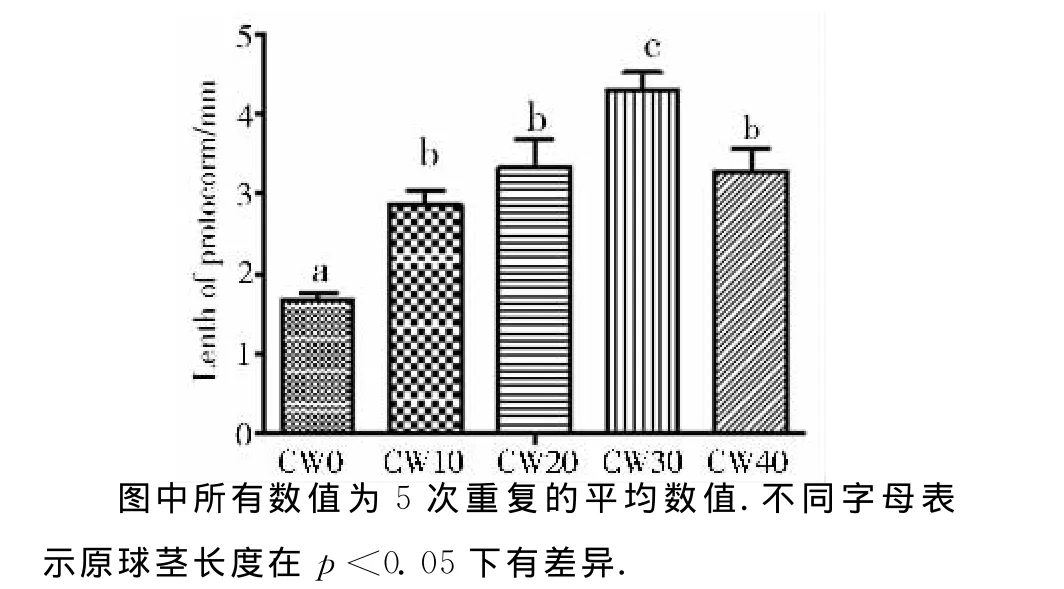
图7 椰汁乳浓度对原球茎长度的影响Fig.7 The effect of coconut water concentration on Length of protocorm
2.6 无性繁殖系的构建
将原球茎转入扩繁培养基培养35d后,观察到各植物激素配比培养基中原球茎的生长状况如表3,原球茎继代增殖数如表4.综合表3、4,A1B2培养基中原球茎颗粒饱满、呈黄绿色,且无分化现象、增殖最多,增殖倍数达到5.275,为最高增殖倍数.结果表明A1B2培养基中原球茎的生长和增殖效果最好,即 MS+6-BA 1.0mg·L-1+NAA 0.2mg·L-1为最佳扩增繁殖培养基.从中也发现原球茎增殖较少的激素组合,原球茎会很快萌发形成幼苗.因此,在无性系培养中,如将激 素 设 定 为 6-BA 1.0mg · L-1、NAA 0.2mg·L-1,可大量扩增原球茎;如将激素调整为6-BA 1.0mg·L-1、NAA 0.8mg·L-1,可获得白芨幼苗.

表3 不同植物激素配比对原球茎生长状况的影响Table 3 Effects of different plant hormones on the protocorm growth in Bletilla striata

表4 不同植物激素配比对原球茎继代增殖数的影响Table 4 Effects of different plant hormones on protocorm growth and propagation in Bletilla striata
3 讨 论
MS是一种高盐培养基,在白芨种子萌发时会产生一定毒害作用,从而降低白芨种子萌发率.选用1/2MS作为种子萌发的基本培养基,其盐分较低,比较温和,有利于萌发.在白芨进行丛芽增殖的时候,富含更多盐分的MS则更加适合,因为能提供更多的养分.白芨的蒴果种子在固体培养基上的萌发率均达37.53%以上,少数种子可能因为在培养基中吸收水分不足,而未能萌发.液体培养基中种子萌发率均达48.25%以上,部分接近75.42%,少数可能因为胚的结构不完整而未能萌发,其余均能萌发.张建霞[20]等发现蒴果的胚龄越长,白芨种子的有胚率越高.本实验所用的种子为已经成熟但未开裂的白芨蒴果,并且是野外采集的,显然有胚率较高,故萌发率高.将固体和液体培养基相比较,液体培养基中种子能更充分的吸收水分和养分,故萌发率要大大高于固体培养基.
在无菌播种实验中,培养基均添加了单一激素6-BA,并设计了浓度梯度(0.5、1.0、1.5),结果表明:无论固体培养基还是液体培养基,当6-BA浓度为1mg/L时种子萌发率最高,这与袁宁[21]、叶静[22]等的结果相似,说明不同植物激素浓度及配比与原球茎的增殖有很大关系,原球茎的继代增殖需要浓度适宜的植物生长素和细胞分裂素共同作用[23].此外,添加椰汁乳也能提高种子萌发率,并能促进原球茎的形成.不同浓度的椰汁乳添加到了培养基,发现不同浓度的椰汁乳不仅可促进白芨种子的萌发,还可提早萌发时间,但椰汁乳浓度对白芨种子萌发率的影响没有显著性差异(p<0.05).此外还发现椰汁乳可提高白芨原球茎的鲜重及长度,其中椰汁乳添加浓度为30%时原球茎鲜重及长度最为明显(p<0.05)(图6、图7).在培养的初期,会发现白芨种子缓慢膨胀,在显微镜下可观察到种子内包含有一椭圆胚,该阶段大约维持1~2周后会转化为球形胚,随后球形胚逐步变大突破种皮,仔细观察发现球形胚的上部份细胞分裂旺盛,原球茎变长并在其上部发育形成乳头状的叶源基(prophyll)组织保护原球茎上部.此时的原球茎可肉眼观察到为小的叶色繁殖体(green propagule),15天后可看到小叶的形成.在添加椰汁乳无激素的MS中,白芨幼苗在50天时达到9.2~15.2mm,但随后幼苗不生根,也不继续生长.而在添加激动素(1~4mg·L-16-BA或Kt)或与0.2~1.0mg·L-1NAA 组合会进一步促进幼苗的生长.其中6-BA的效果更为明显,但在幼苗的叶片数目上未显示出显著性差异.
在原球茎扩增繁殖实验中,设计两个浓度的6-BA(0.5、1.0)和三个浓度的 NAA(0.2、0.5、0.8)进行组合配比,经过实验选出最适宜原球茎生长繁殖的组合.本实验结果表明当6-BA浓度为1.0mg·L-1、NAA浓度为0.2mg·L-1时原球茎生长繁殖效果最好,即A1B2组合为最佳扩增繁殖培养基,而A3B2组合为生长理想培养基.
[1]彭丽丽,刘祥东,刘华,等.白芨的组培快繁(简报)[J].中国野生植物资源,2004,23(5):65.
[2]罗新根,刘文庸,张卫东,等.中药白及的化学成分及临床研究进展[J].药学实践杂志,1999,17(6):359-364.
[3]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005.
[4]中国植物志编委会.中国植物志(第十八卷)[M].北京:科学出版社,1999.
[5]焦一鸣,王放.论白及的致瘀功用[J].时珍国医国药,2001,12(5):458.
[6]耿志国,郑世玲,王遵琼.白芨对盐酸引起的大鼠胃粘膜损伤的保护作用[J].中草药,1990,21(2):24-26.
[7]SHUZO T,MASAE Y,KEIKO I.Antimicrobial agents from Bletilla striata [J].Phytochemistry,1983,22(4):1011-1015.
[8]周至明,黄程生,彭丽丽,等.白及人工种植初步研究[J].中药材,2006,29(1):7-8.
[9]刘光斌,黄忠,黄长干,等.天然植物白芨胶的功能及在化妆品中的运用[J].日用化学品科学,2005,28(8):22-24.
[10]张亦诚.白芨的生物特性及栽培技术[J].农业科技与信息,2007(10):45.
[11]袁宁.白芨组织培养技术体系研究[D].成都:西南交通大学,2009.
[12]曾宋君,黄向力,陈之林,等.白及的无菌播种和组织培养研究[J].中药材,2004,27(9):625-626.
[13]张燕,黎斌,李思锋.不同培养基上白芨的种子萌发与幼苗形态发生[J].西北植物学报,2009,29(8):1584-1589.
[14]喻苏琴,罗文秀,张寿文.不同培养条件对白芨种子萌发效应的研究[J].安徽农业科学,2010,38(16):8421-8422.
[15]张燕,黎斌,李汝娟,等.白芨种子的无菌萌发过程观察和组培快繁研究[J].北方园艺,2013 (3):158-160.
[16]郭顺星,徐锦堂.白芨种子染菌萌发过程中细胞超微结构变化的研究[J].植物学报,1990,32(8):594-598.
[17]MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Physiol Plant,1962,15:473-497.
[18]KNUDSON L.A new nutrient solution for germination of orchid seeds[J].Am Orchid Soc Bull.1946,5:214-217.
[19]VACIN E,WENT FW.Some pH changes in nutrient solutions[J].Bot Gaz,1949,110:605-613.
[20]张建霞,付志惠,李洪林,等.白芨胚发育与种子萌发的关系[J].亚热带植物科学,2005,34(4):32-35.
[21]袁宁,何俊蓉,何锐,等.白芨组培快繁育苗技术研究[J].西南农业学报,2009,22(3):781-785.
[22]叶静,郑晓君,管常东,等.白芨的无菌萌发与组织培养[J].云南大学学报:自然科学版,2010,S1:422-425.
[23]翟月婷.霍山石斛试管丛生芽及原球茎继代增殖措施的研究[D].合肥:安徽农业大学,2011.
