霍山石斛安全性评价研究
2014-07-26李滨陈锋王新生张炜玲戴亚峰欧阳臻
李滨,陈锋,王新生,张炜玲,*,戴亚峰,欧阳臻
(1.江苏大学药学院,江苏镇江212013;2.安徽圣农生物科技股份有限公司,安徽六安237000)
霍山石斛是兰科石斛属植物,是石斛中的极品,素有“软黄金”之称,主产于大别山区的安徽省霍山县。霍山石斛因具有益胃生津、滋阴清热、清心明目、润肺止渴等功效[1-2],已成为食品行业炙手可热的原料。但鲜见霍山石斛的毒性研究的报道。为了科学地评价霍山石斛作为新食品资源食品和保健食品原料的安全性,本文对其进行了动物毒理实验和外源性毒素(农残、重金属)含量的研究,为以霍山石斛为主要原料的产品开发推广提供科学依据,并为霍山石斛质量标准的建立提供理论参考。
1 材料与方法
1.1 样品
霍山石斛在安徽圣农生物科技股份有限公司石斛有机栽培基地采摘,经烘干、粉碎过100目筛的粉末。
1.2 剂量
2010版《中国药典》第一部石斛的人体推荐最大剂量为12 g/d,以每人60 kg体重计算,折合剂量0.2g/kg·bw。
1.3 动物及环境
清洁级ICR健康小鼠及SD大鼠由上海斯莱克实验动物有限责任公司提供,实验环境为屏障系统。实验期间实验环境温度22℃~24℃,湿度52%~58%。
1.4 仪器、试剂及菌株
1.4.1 仪器
6890N气相色谱仪:美国安捷伦公司;AA-670型原子吸收分光光度计:日本岛津;EX224ZH电子天平:上海精密仪器有限公司;OLYMPUS显微镜:日本OLYMPUS株式会社;YXQ.WF-0.5高压灭菌器:衡阳市金一帆制药设备实业有限公司;日立7180型全自动生化分析仪:日本 OLYMPUS株式会社;CELLDYN3700型全自动血球计数仪:美国雅培公司;BMJ-160恒温培养箱:上海博迅实业有限公司。
1.4.2 试剂
六六六、滴滴涕、铅、砷、汞标准品均由国家标准物质研究中心提供;总蛋白、白蛋白、尿素氮、血糖、谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆固醇、甘油三酯和肌酐试剂盒均来自于国药集团;其余试剂均为分析纯由国药集团提供。
1.4.3 菌株
鼠伤寒沙门氏菌组氨酸缺陷型 TA97、TA98、TA100、TA102四株菌株和S-9均由中国CDC营养与食品安全所提供。
1.5 方法
1.5.1 外源毒素含量测定(有机氯农药残留和重金属)
按2010年版《中国药典》一部附录ⅨQ和相关国家标准[3-4]的方法测定有机氯类农药残留量;按2010年版《中国药典》一部附录ⅨE和相关国家标准中的方法测定 Pb、As、Hg[5-7]的含量。
1.5.2 动物安全性评价
依据《保健食品检验与评价技术规范》(2003年版)[8]中保健食品安全性毒理学检测方法进行动物实验;
1.5.2.1 小鼠急性经口毒性试验[9]
采用最大耐受剂量法,选小鼠20只,雌、雄,首次灌胃前禁食16 h,自由饮水。取受试样品加蒸馏水配制成0.5 g/mL的溶液,按最大灌胃量20 mL/kg·bw,给小鼠1 d内间隔4 h经口灌胃3次,累积染毒剂量为30 g/kg·bw。灌胃后连续观察14 d,记录中毒表现及死亡情况,求得最大耐受剂量。
1.5.2.2 致突变试验[10]
1)细菌回复突变试验(Ames试验)
采用标准平板掺入法,采用经鉴定合格的鼠伤寒沙门氏菌突变型菌株 TA97、TA98、TA100、TA102,活化系统为多氯联苯诱导的大鼠肝S-9。在无菌条件下,将受试样品用无菌水稀释成不同的剂量,随后与琼脂、试验菌液、S-9混合液混合导入平皿中。平皿中最终剂量分别为 5 000、1 000、200、40、8 μg/皿,每个剂量组做3个平皿,同时设空白对照、溶剂对照和阳性对照(2-AF、敌克松、叠氮钠、1,8-二羟蒽醌,剂量分别为10、50、1.5、50 μg。)。均包括加 S-9 和不加 S-9 两种情况。平皿37℃培养48 h,计数每皿回变菌落数。如果受试物的回变菌落数超过自发回变菌落数的2倍以上,并有剂量一反应关系者定为阳性。整套试验在相同试验条件下重复一次。
2)小鼠骨髓细胞微核试验
采用30给受试物法。选ICR小鼠50只,随机分成5组,每组10只,雌雄各半。将受试物分为高、中、低 3 个剂量组,分别为 2.0、1.0、0.5 g/kg·bw,另设阴性对照(无菌水),阳性对照(环磷酰胺0.04 g/kg·bw)。受试样品用无菌水配制浓度为1.0、0.5、0.25 g/mL,以20 mL/kg·bw灌胃,两次间隔24 h,第二次给受试样品后6 h处死小鼠,取胸骨常规制片、镜检,每鼠计数1 000个骨髓嗜多染红细胞(PCE),记录含微核细胞数、微核发生率,每片记数200个嗜多染红细胞,观察嗜多染红细胞与成熟红细胞的比值(PCE/RBC)。结果采用Poisson分布U检验进行统计学处理。
3)小鼠精子畸形试验
选ICR小鼠25只,随机分成5组,每组5只。将受试物分为高、中、低3个剂量组,分别为2.0 g/kg·bw、1.0 g/kg·bw、0.5 g/kg·bw,另设阴性对照(无菌水),阳性对照(环磷酰胺0.04 g/kg·bw)。受试样品用无菌水配制浓度为 1.0、0.5、0.25 g/mL,以 20 mL/kg·bw 灌胃,每天1次,连续5 d。于首次给受试样品后的第35天处死小鼠,取两侧附睾精子滤液按常规制片、镜检。每鼠计数1 000个结构完整的精子,计算精子畸形发生率(以百分率计),结果采用秩和检验进行统计处理。
1.5.2.3 大鼠30 d喂养试验[11]
选择SD健康大鼠80只,随机分4组,每组20只,雌雄各半。受试样品按人体推荐最大剂量的30、65、100 倍设 6.0、13.0、20.0 g/kg·bw 3 个剂量组,另设阴性对照(无菌水)。受试样品用无菌水配制浓度分别为0.3、0.65、1.0 g/mL,以 20 mL/kg.bw 灌胃,连续 30 d。大鼠自由进食饮水,每周称1次体重和2次食物摄入量,计算每周及总的食物利用率,每周观察动物一般情况,有无中毒表现和死亡。实验过程中观察大鼠体重、食物利用率,血液学指标,脏器系数、病理学检查。
2 结果与分析
2.1 霍山石斛原料中外源毒素的含量测定
根据中国药典第一部(2010版)农药残留量和重金属测定方法,检测出霍山石斛原料中六六六、滴滴涕、铅、砷、汞的含量见表1。
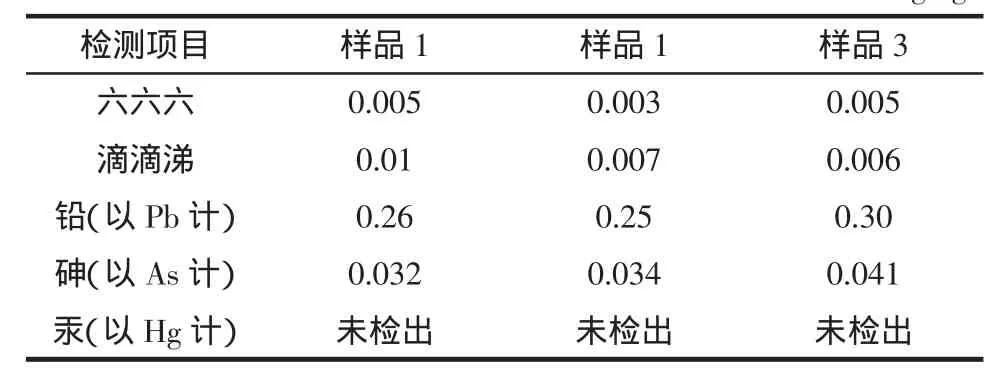
表1 霍山石斛中外源毒素的含量Table 1 Exogenous toxins content in Dendrobium huoshanense mg/kg
从表1可以看出霍山石斛中有机氯农药残留量(六六六、滴滴涕)和重金属(铅、砷、汞)均大大低于保健(功能)食品通用标准[12]、食品中农药最大残留限量[13]和药用植物及制剂外经贸绿色行业标准中的规定。因此上述研究结果表明安徽圣农生物科技股份有限公司提供霍山石斛原料外源性毒素含量完全符合国家相关标准,食用安全。
2.2 小鼠急性经口毒性试验
以30 g/kg·bw剂量的霍山石斛给小鼠灌胃后未见明显中毒症状,观察14 d无死亡。观察期末将受试动物处死进行解剖检查,肝、脾、肾、胃、肠、心、肺等主要脏器,未见明显异常改变。因此,霍山石斛的雌雄小鼠急性经口的最大耐受剂量(MTD)大于30 g/kg·bw(相当于人体推荐剂量的150倍),属无毒级。
2.3 致突变试验结果
2.3.1 Ames试验
Ames试验结果见表2,表3。
表2 霍山石斛Ames实验回变菌落数(±SD)(第一次)Table 2 Dendrobium huoshanense Ames test about the colony count(first)(±SD)
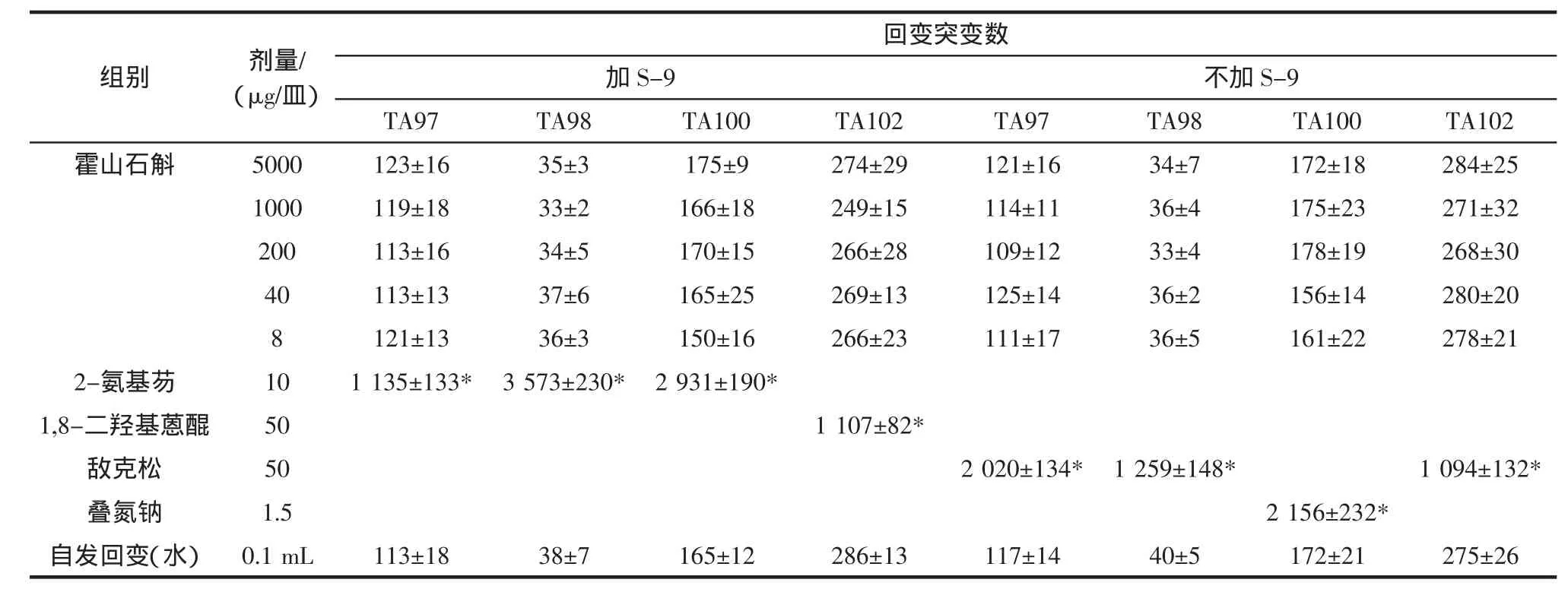
表2 霍山石斛Ames实验回变菌落数(±SD)(第一次)Table 2 Dendrobium huoshanense Ames test about the colony count(first)(±SD)
注:“*”表示超过阴性对照组菌落数2倍以上。
不加S-9 TA97 TA98 TA100 TA102 TA97 TA98 TA100 TA102霍山石斛 5000 123±16 35±3 175±9 274±29 121±16 34±7 172±18 284±25 1000 119±18 33±2 166±18 249±15 114±11 36±4 175±23 271±32 200 113±16 34±5 170±15 266±28 109±12 33±4 178±19 268±30 40 113±13 37±6 165±25 269±13 125±14 36±2 156±14 280±20 8 121±13 36±3 150±16 266±23 111±17 36±5 161±22 278±21 2-氨基芴 10 1 135±133* 3 573±230* 2 931±190*1,8-二羟基蒽醌 50 1 107±82*敌克松 50 2 020±134* 1 259±148* 1 094±132*叠氮钠 1.5 2 156±232*自发回变(水) 0.1 mL 113±18 38±7 165±12 286±13 117±14 40±5 172±21 275±26组别 剂量/(μg/皿)回变突变数加S-9
表3 霍山石斛Ames实验回变菌落数(±SD)(第二次)Table 3 Dendrobium huoshanense Ames test about the colony count(second)(±SD)
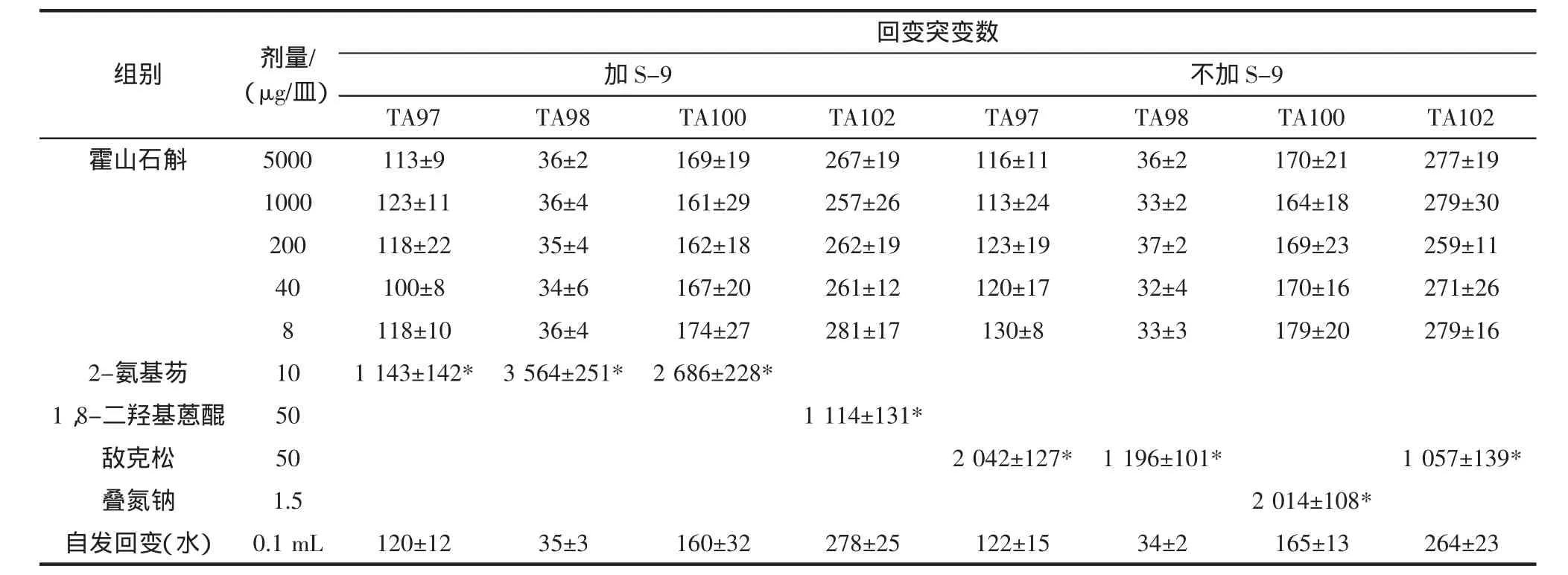
表3 霍山石斛Ames实验回变菌落数(±SD)(第二次)Table 3 Dendrobium huoshanense Ames test about the colony count(second)(±SD)
注:“*”表示超过阴性对照组菌落数2倍以上。
不加S-9 TA97 TA98 TA100 TA102 TA97 TA98 TA100 TA102霍山石斛 5000 113±9 36±2 169±19 267±19 116±11 36±2 170±21 277±19 1000 123±11 36±4 161±29 257±26 113±24 33±2 164±18 279±30 200 118±22 35±4 162±18 262±19 123±19 37±2 169±23 259±11 40 100±8 34±6 167±20 261±12 120±17 32±4 170±16 271±26 8 118±10 36±4 174±27 281±17 130±8 33±3 179±20 279±16 2-氨基芴 10 1 143±142* 3 564±251* 2 686±228*1,8-二羟基蒽醌 50 1 114±131*敌克松 50 2 042±127* 1 196±101* 1 057±139*叠氮钠 1.5 2 014±108*自发回变(水) 0.1 mL 120±12 35±3 160±32 278±25 122±15 34±2 165±13 264±23组别 剂量/(μg/皿)回变突变数加S-9
试验结果表明霍山石斛各剂量组回变菌落数均未超过阴性对照组回变菌落数的2倍,亦无剂量-反应关系。即霍山石斛对 TA97、TA98、TA100、TA102 四株试验菌株,在加与不加S-9时,均未见有致基因突变作用。
2.3.2 小鼠骨髓细胞微核试验
小鼠骨髓细胞微核试验结果表明,霍山石斛各剂量组微核率与阴性对照组比较差异无统计学意义(P>0.05),而阳性对照组(环磷酞胺)与阴性对照组比较差异有统计学意义(P<0.01)。同时未见霍山石斛对小鼠骨髓嗜多染红细胞微核形成及PCE/RBC比值产生影响。上述结果表明霍山石斛对小鼠骨髓细胞无损伤作用。结果见表4。
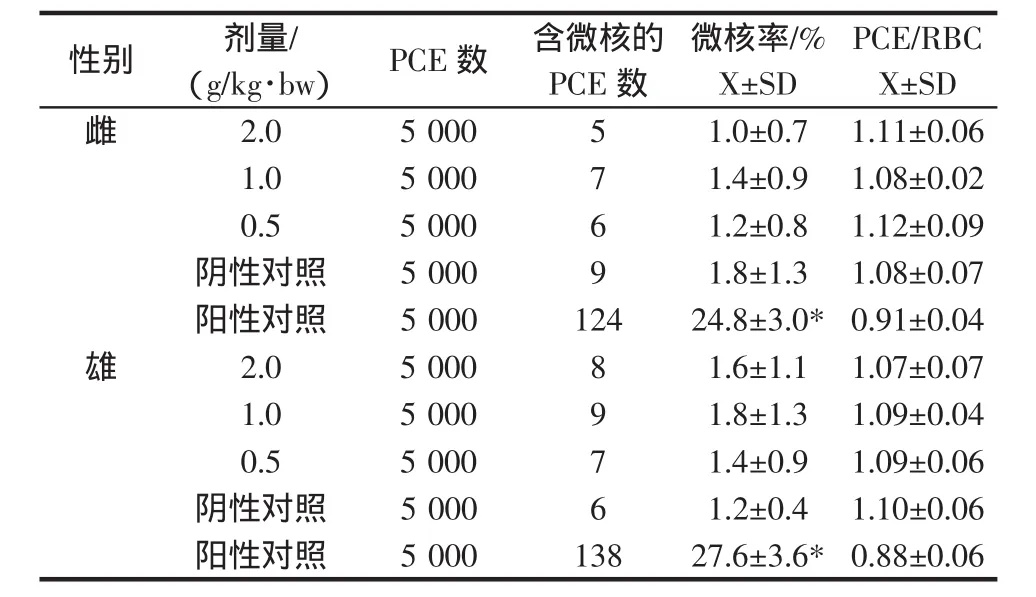
表4 霍山石斛对小鼠骨髓细胞微核发生率和PCE/RBC比值的影响Table 4 Influence of Dendrobium huoshanense incidence and PCE/RBC ratio on the micronucleus of bone marrow cells in mice
2.3.3 小鼠精子畸形试验
霍山石斛对小鼠精子畸形的影响结果见表5和表6。
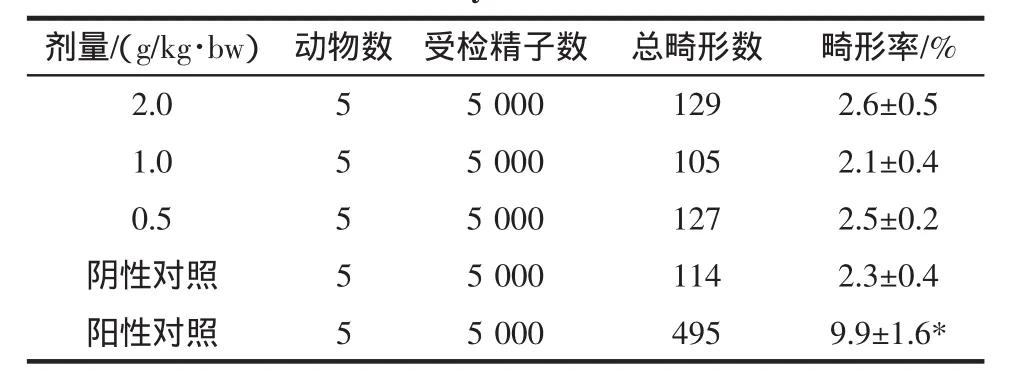
表5 霍山石斛对小鼠精子畸形率的影响Table 5 Influence of Dendrobium huoshanense affect sperm deformity rate in mice
从表5和表6可见,各剂量组精子畸形率与阴性对照组比较,无显著性差异(P>0.05),而阳性对照组小鼠精子畸形率与阴性对照组比较有显著提高(P<0.01)。因此试验结果表明霍山石斛对小鼠精子畸形率未产生影响。
2.4 大鼠30 d喂养试验
用霍山石斛掺入饲料喂养大鼠30 d内,各组小鼠生长发育良好,无异常行为和中毒症状,无死亡。并通过以下指标检测来判断霍山石斛对大鼠身体状况的影响。
2.4.1 霍山石斛对大鼠体重及食物利用率的影响
记录大鼠30d喂养期间内不同阶段的体重、增重及总增重结果见表7和表8。各剂量组雌雄鼠各时点的每周及总进食量、每周及总食物利用率见表9和表10。
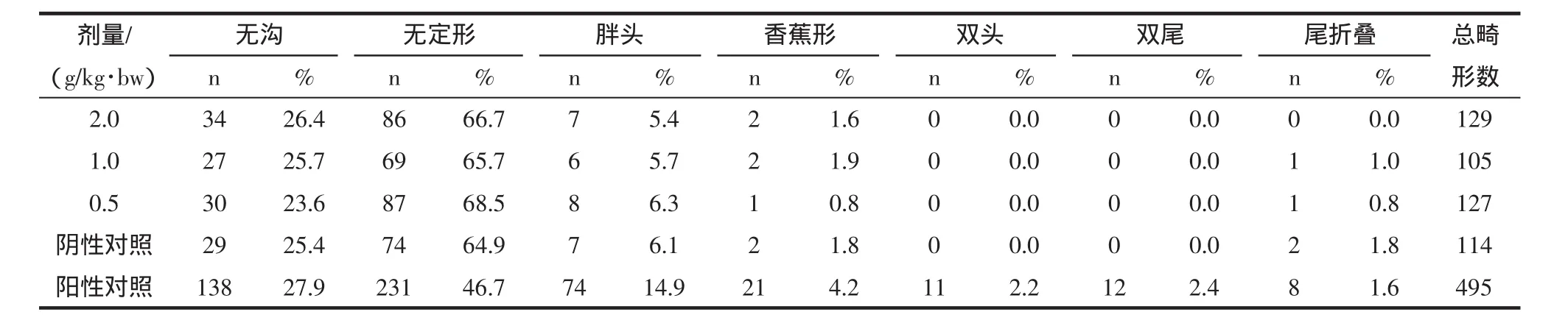
表6 霍山石斛对小鼠精子畸形类型及比例的影响Table 6 Influence of Dendrobium huoshanense effects on mice sperm malformation type and proportion
表7 霍山石斛对大鼠体重的影响(±SD)Table 7 Influence of Dendrobium huoshanense effect on the body weight of rats(±SD)
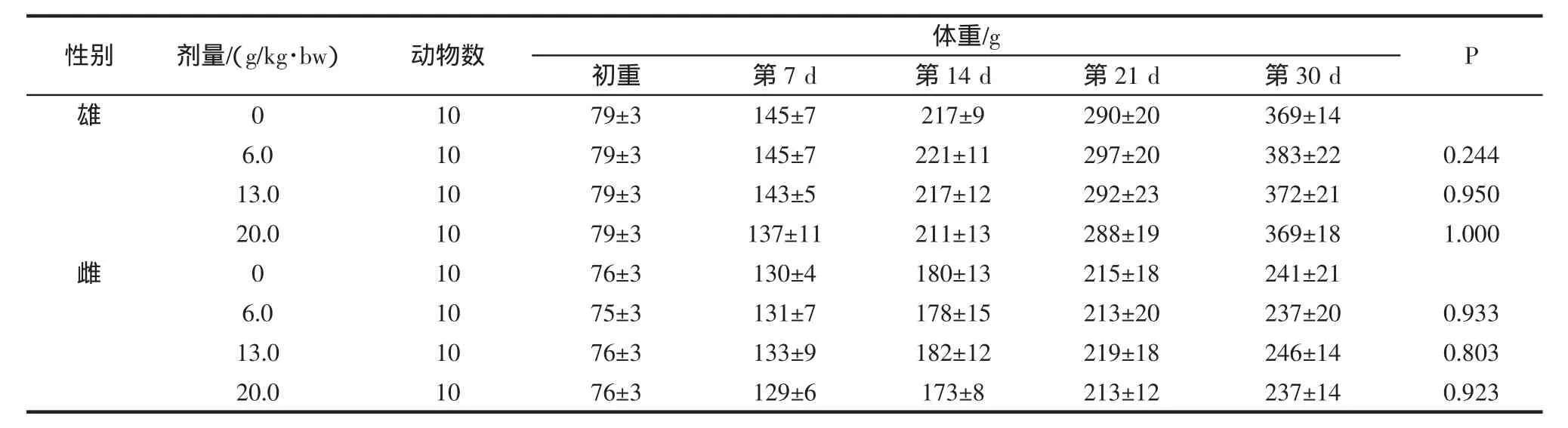
表7 霍山石斛对大鼠体重的影响(±SD)Table 7 Influence of Dendrobium huoshanense effect on the body weight of rats(±SD)
性别剂量/(g/kg·bw)动物数体重/gP初重 第7 d 第14 d 第21 d 第30 d雄0 10 79±3 145±7 217±9 290±20 369±14 6.0 10 79±3 145±7 221±11 297±20 383±22 0.244 13.0 10 79±3 143±5 217±12 292±23 372±21 0.950 20.0 10 79±3 137±11 211±13 288±19 369±18 1.000雌0 10 76±3 130±4 180±13 215±18 241±21 6.0 10 75±3 131±7 178±15 213±20 237±20 0.933 13.0 10 76±3 133±9 182±12 219±18 246±14 0.803 20.0 10 76±3 129±6 173±8 213±12 237±14 0.923
表8 霍山石斛各剂量组大鼠的增重(±SD)Table 8 Dendrobium huoshanense each dose group of rats weight(±SD)
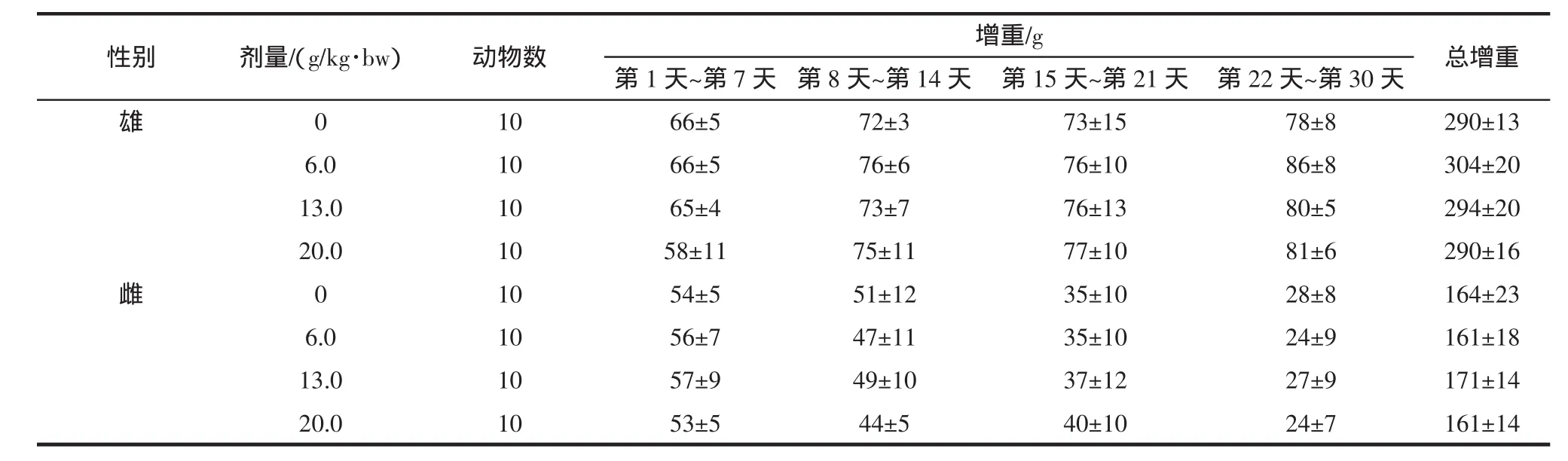
表8 霍山石斛各剂量组大鼠的增重(±SD)Table 8 Dendrobium huoshanense each dose group of rats weight(±SD)
性别剂量/(g/kg·bw)动物数增重/g总增重第1天~第7天 第8天~第14天 第15天~第21天 第22天~第30天雄0 10 66±5 72±3 73±15 78±8 290±13 6.0 10 66±5 76±6 76±10 86±8 304±20 13.0 10 65±4 73±7 76±13 80±5 294±20 20.0 10 58±11 75±11 77±10 81±6 290±16雌0 10 54±5 51±12 35±10 28±8 164±23 6.0 10 56±7 47±11 35±10 24±9 161±18 13.0 10 57±9 49±10 37±12 27±9 171±14 20.0 10 53±5 44±5 40±10 24±7 161±14
表9 霍山石斛各剂量组大鼠的摄食量(±SD)Table 9 Dendrobium huoshanense each dose group of rats Ingestion(±SD)
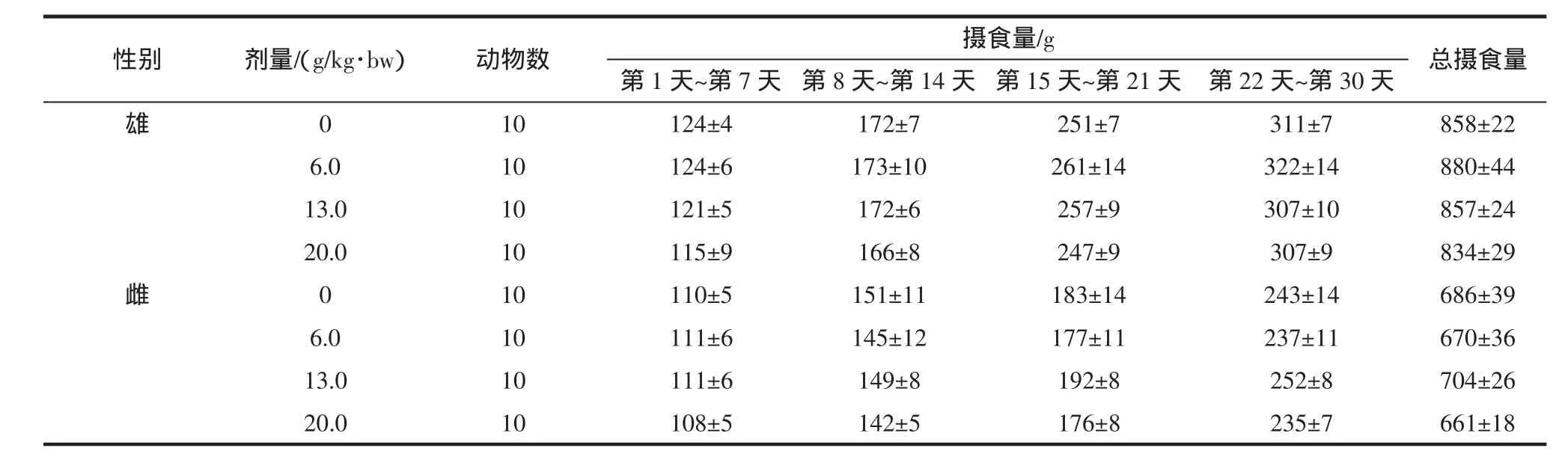
表9 霍山石斛各剂量组大鼠的摄食量(±SD)Table 9 Dendrobium huoshanense each dose group of rats Ingestion(±SD)
性别剂量/(g/kg·bw)动物数第1天~第7天第8天~第14天第15天~第21天第22天~第30天雄0摄食量/g 总摄食量10 124±4 172±7 251±7 311±7 858±22 6.0 10 124±6 173±10 261±14 322±14 880±44 13.0 10 121±5 172±6 257±9 307±10 857±24 20.0 10 115±9 166±8 247±9 307±9 834±29雌0 10 110±5 151±11 183±14 243±14 686±39 6.0 10 111±6 145±12 177±11 237±11 670±36 13.0 10 111±6 149±8 192±8 252±8 704±26 20.0 10 108±5 142±5 176±8 235±7 661±18
表10 霍山石斛对大鼠食物利用率的影响(±SD)Table 10 Influence of Dendrobium huoshanense on rat food utilization rate(±SD)
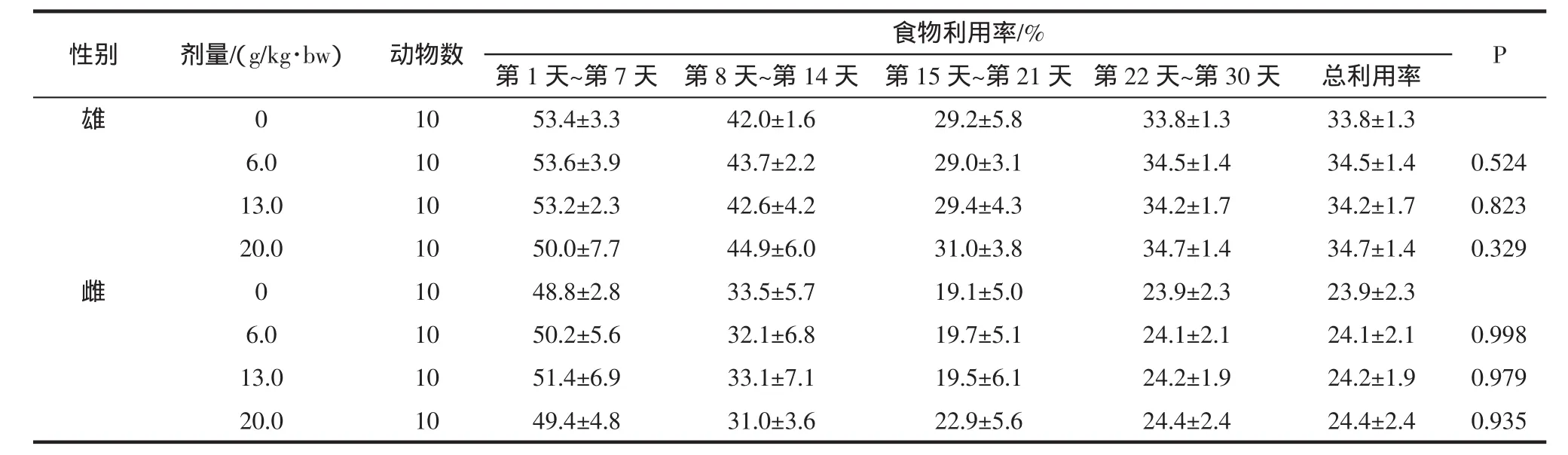
表10 霍山石斛对大鼠食物利用率的影响(±SD)Table 10 Influence of Dendrobium huoshanense on rat food utilization rate(±SD)
性别剂量/(g/kg·bw)动物数食物利用率/%P第1天~第7天 第8天~第14天 第15天~第21天 第22天~第30天 总利用率雄0 10 53.4±3.3 42.0±1.6 29.2±5.8 33.8±1.3 33.8±1.3 6.0 10 53.6±3.9 43.7±2.2 29.0±3.1 34.5±1.4 34.5±1.4 0.524 13.0 10 53.2±2.3 42.6±4.2 29.4±4.3 34.2±1.7 34.2±1.7 0.823 20.0 10 50.0±7.7 44.9±6.0 31.0±3.8 34.7±1.4 34.7±1.4 0.329雌0 10 48.8±2.8 33.5±5.7 19.1±5.0 23.9±2.3 23.9±2.3 6.0 10 50.2±5.6 32.1±6.8 19.7±5.1 24.1±2.1 24.1±2.1 0.998 13.0 10 51.4±6.9 33.1±7.1 19.5±6.1 24.2±1.9 24.2±1.9 0.979 20.0 10 49.4±4.8 31.0±3.6 22.9±5.6 24.4±2.4 24.4±2.4 0.935
表7和表8的结果显示,各剂量组的大鼠在各个阶段的体重与阴性对照相比均无明显的差异,无统计学意义(P>0.05)。
表9和表10显示,各剂量组动物食物利用率与对照组相比无显著性差异(P>0.05)。
2.4.2 霍山石斛对大鼠血液学指标的影响
经口给予大鼠不同剂量的霍山石斛30 d后测定各剂量组大鼠血液红细胞计数、血红蛋白水平、白细胞计数及其分类等指标,结果见表11。
由表11可见,霍山石斛的高、中、低剂量组各血液学指标与阴性对照组比较,差异均无统计学意义(P>0.05)。
2.4.3 霍山石斛对大鼠血液生化指标的影响
经口给予大鼠不同剂量的霍山石斛30天后测定各剂量组大鼠血清谷丙转氨酶、谷草转氨酶、总蛋白、白蛋白、总胆固醇、甘油三酯、尿素氮、肌酐及血糖的水平。结果显示,霍山石斛的高、中、低剂量组各血液生化指标与阴性对照组比较,差异均无统计学意义(P>0.05),详见表12。
2.4.4 霍山石斛对大鼠脏器重量及脏体比的影响
大鼠30天喂养试验结果表明,以6.0、13.0、20.0 g/kg·bw剂量霍山石斛给大鼠灌胃30 d,各剂量组雌雄大鼠的肝脏、肾脏、脾脏、睾丸、卵巢的重量及脏体比与对照组比较,差异无统计学意义(P>0.05),结果见表13。
表11 霍山石斛对大鼠血液学指标的影响(±SD)Table 11 Influence of Dendrobium huoshanense effect on rat hematology indexes(±SD)
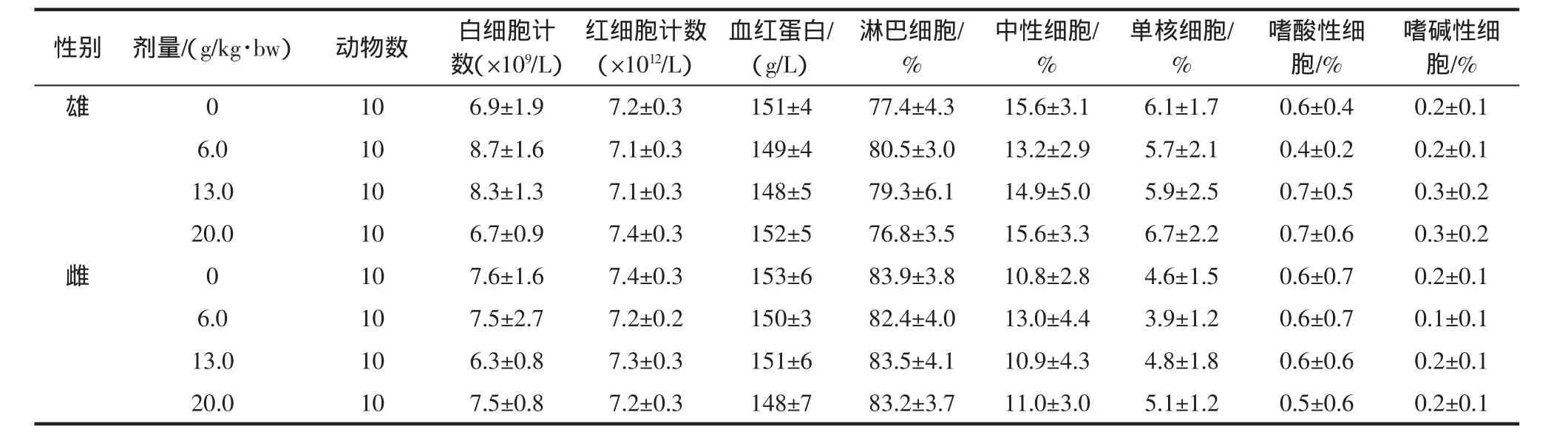
表11 霍山石斛对大鼠血液学指标的影响(±SD)Table 11 Influence of Dendrobium huoshanense effect on rat hematology indexes(±SD)
性别剂量/(g/kg·bw)动物数白细胞计数(×109/L)嗜碱性细胞/%雄0 10 6.9±1.9 7.2±0.3 151±4 77.4±4.3 15.6±3.1 6.1±1.7 0.6±0.4 0.2±0.1红细胞计数(×1012/L)血红蛋白/(g/L)淋巴细胞/%中性细胞/%单核细胞/%嗜酸性细胞/%6.0 10 8.7±1.6 7.1±0.3 149±4 80.5±3.0 13.2±2.9 5.7±2.1 0.4±0.2 0.2±0.1 13.0 10 8.3±1.3 7.1±0.3 148±5 79.3±6.1 14.9±5.0 5.9±2.5 0.7±0.5 0.3±0.2 20.0 10 6.7±0.9 7.4±0.3 152±5 76.8±3.5 15.6±3.3 6.7±2.2 0.7±0.6 0.3±0.2雌0 10 7.6±1.6 7.4±0.3 153±6 83.9±3.8 10.8±2.8 4.6±1.5 0.6±0.7 0.2±0.1 6.0 10 7.5±2.7 7.2±0.2 150±3 82.4±4.0 13.0±4.4 3.9±1.2 0.6±0.7 0.1±0.1 13.0 10 6.3±0.8 7.3±0.3 151±6 83.5±4.1 10.9±4.3 4.8±1.8 0.6±0.6 0.2±0.1 20.0 10 7.5±0.8 7.2±0.3 148±7 83.2±3.7 11.0±3.0 5.1±1.2 0.5±0.6 0.2±0.1
表12 霍山石斛对大鼠血液生化指标的影响(±SD)Table 12 Influence of Dendrobium huoshanense on rat blood biochemical indicators(±SD)
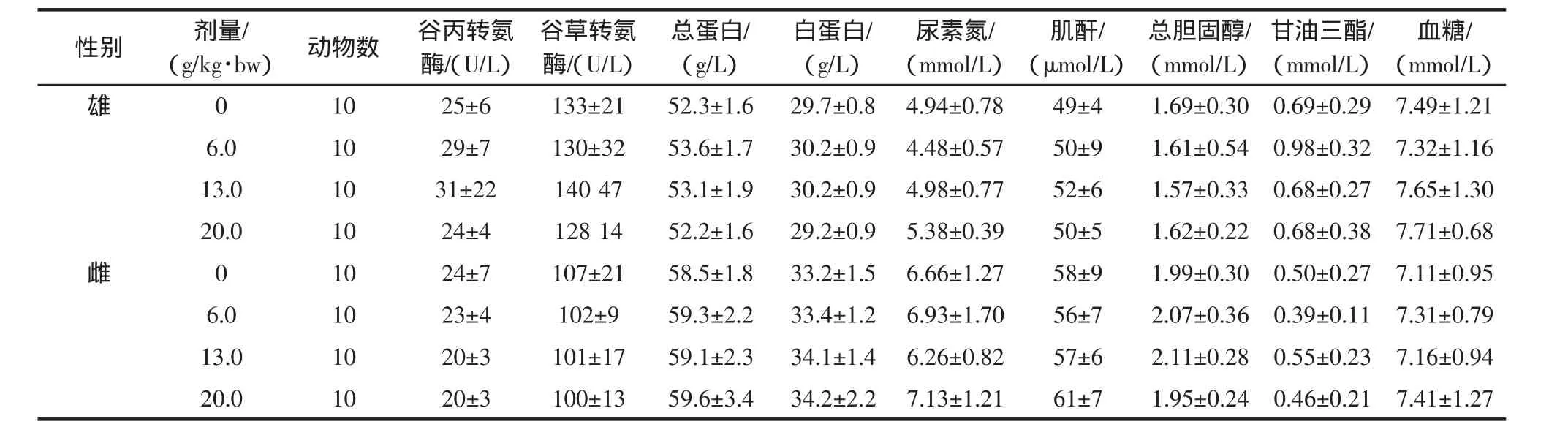
表12 霍山石斛对大鼠血液生化指标的影响(±SD)Table 12 Influence of Dendrobium huoshanense on rat blood biochemical indicators(±SD)
性别 剂量/血糖/(mmol/L)雄0 10 25±6 133±21 52.3±1.6 29.7±0.8 4.94±0.78 49±4 1.69±0.30 0.69±0.29 7.49±1.21 6.0 10 29±7 130±32 53.6±1.7 30.2±0.9 4.48±0.57 50±9 1.61±0.54 0.98±0.32 7.32±1.16 13.0 10 31±22 140 47 53.1±1.9 30.2±0.9 4.98±0.77 52±6 1.57±0.33 0.68±0.27 7.65±1.30 20.0 10 24±4 128 14 52.2±1.6 29.2±0.9 5.38±0.39 50±5 1.62±0.22 0.68±0.38 7.71±0.68雌0 10 24±7 107±21 58.5±1.8 33.2±1.5 6.66±1.27 58±9 1.99±0.30 0.50±0.27 7.11±0.95 6.0 10 23±4 102±9 59.3±2.2 33.4±1.2 6.93±1.70 56±7 2.07±0.36 0.39±0.11 7.31±0.79 13.0 10 20±3 101±17 59.1±2.3 34.1±1.4 6.26±0.82 57±6 2.11±0.28 0.55±0.23 7.16±0.94 20.0 10 20±3 100±13 59.6±3.4 34.2±2.2 7.13±1.21 61±7 1.95±0.24 0.46±0.21 7.41±1.27(g/kg·bw) 动物数 谷丙转氨酶/(U/L)谷草转氨酶/(U/L)总蛋白/(g/L)白蛋白/(g/L)尿素氮/(mmol/L)肌酐/(μmol/L)总胆固醇/(mmol/L)甘油三酯/(mmol/L)
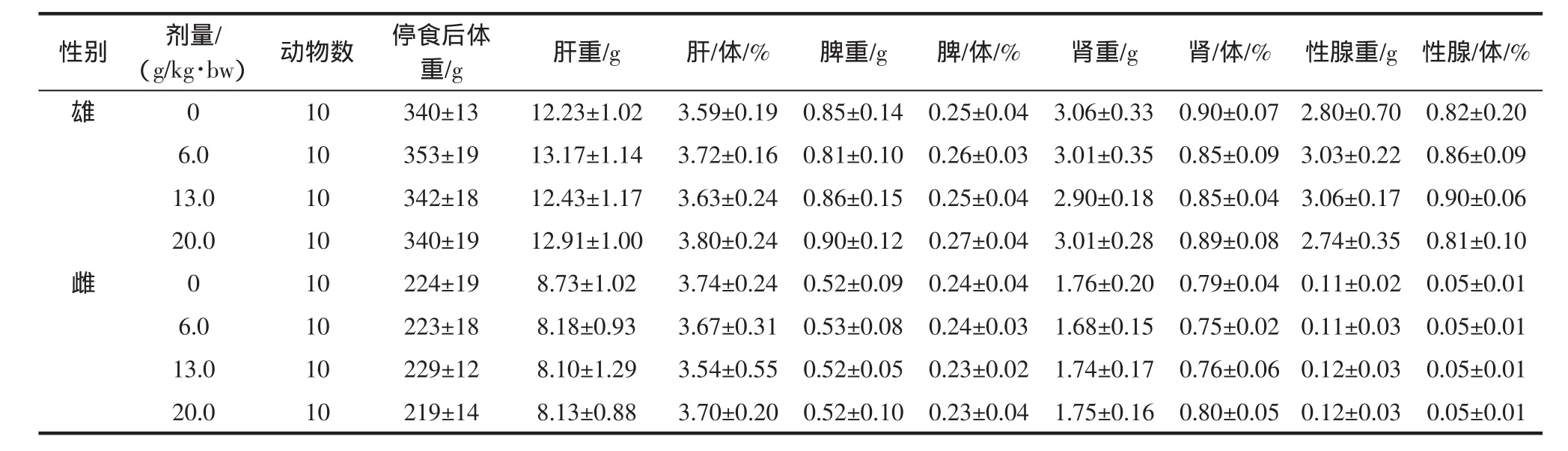
表13 霍山石斛对大鼠脏器重量及脏体比的影响Table 13 Influence of Dendrobium huoshanense on rat than the organ weight and dirty rat body
2.4.5 大体解剖及组织学检查结果
30 d喂养实验结束后,检查对照组和各剂量组共80只大鼠,雌、雄各半。剖检后肉眼观察,心、肺、肝、脾、肾、胃、肠、翠丸(卵巢)等主要脏器的色泽、大小、形态结构等均未见明显异常。
3 讨论
霍山石斛作为药食同源药材在最早的药学专著《神农本草经》中就有记载,在当地民间更被当做是救命良药,有很长的食用历史;且现代研究表明,霍山石斛具有增强免疫力、清咽、明目、保肝、抗癌等多种功效,具目前研究最热门的保健食品新原料之一。本文从外源性毒素和动物毒理两方面评价霍山石斛的安全性。为霍山石斛的进一步开发提供安全性依据。
通过测定霍山石斛有机氯农药残留和重金属含量,确定原料的外源性毒素符合国家相关标准;依据《保健食品检验与评价技术规范》(2003年版)中保健食品安全性毒理学检测方法对霍山石斛进行动物安全性评价结果显示:
1)霍山石斛的小鼠急性经口MTD大于30g/kg·bw,属无毒级。
2)霍山石斛的Ames试验结果为阴性。
3)霍山石斛小鼠骨髓细胞微核试验结果为阴性。
4)霍山石斛小鼠精子畸形试验结果为阴性。
5)霍山石斛30 d喂养试验结果显示受试动物一般情况良好,各项指标检查均正常,从而说明霍山石斛最大为观察到有害作用剂量(NOAEL)为20.0 g/kg·bw。
上述结果表明,霍山石斛在本研究剂量范围内作为食品和保健食品原料是安全可靠的,非常广阔的市场前景。
[1]崔田,马洪怡.霍山石斛的研究概况[J].吉林中医药,2007,27(10):66-68
[2]林萍,毕志明,徐红,等.石斛属植物药理活性研究进展[J].中草药,2003,34(11):19-22
[3]国家药典委员会.中华人民共和国药典2010版[S].一部.北京:中国医药科技出版社,2011
[4]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.19-2008食品中有机氯农药多组分残留量的测定[S].北京:中国标准出版社,2008:1-3
[5]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.12-2010食品安全国家标准食品中铅的测定[S].北京:中国标准出版社,2010:8-12
[6]卫生部食品卫生监督检验所,中国国家标准化管理委员会.GB/T 5009.11-2003食品中总砷及无机砷的测定[S].北京:中国标准出版社,2003:70-76
[7]卫生部食品卫生监督检验所,中国国家标准化管理委员会.GB/T 5009.17-2003食品中总汞及有机汞的测定[S].北京:中国标准出版社,2003:119-132
[8]卫生部.保健食品检验与评价技术规范[M].北京:清华同方电子出版社,2003
[9]傅颖,梅松,刘冬英,等.铁皮枫斗胶囊的毒性研究及安全性评价[J].中国卫生检验杂志,2010,20(11):2789-2790
[10]宾捷.金钗石解胶囊内容物毒理学安全性评价的实验研究[D].长沙:公共卫生学院,2010
[11]解国梁,王莉,尹幸念,等.骨蛎胶囊毒理学安全性实验研究[J].北方药学,2010,7(6):9-12
[12]中华人民共和国卫生部,中国国家标准化管理委员会.GB 16740-1997保健(功能)食品通用标准[S].北京:中国标准出版社,1997:516-520
[13]中华人民共和国卫生部,中国国家标准化管理委员会.GB 2763-2005食品中农药最大残留限量[S].北京:中国标准出版社,2005:15-27
