超声波萃取-HPLC检测饮料中DEHP的含量
2014-07-26刘燕伟周真巡赵文峰马彤梅
刘燕伟,周真巡,赵文峰,马彤梅,*
(1.华南理工大学化学与化工学院,广东广州510640;2.江苏师范大学化学化工学院,江苏徐州211116)
“塑化剂”又称为邻苯二甲酸酯类(PAEs),是一种被广泛使用的工业增塑剂。PAEs主要用作增加塑料的可塑性和韧性,也可使油脂更好地分散到水中,起乳化、增稠作用[1]。PAEs其对人体的危害性远远大于三聚氰胺[2-4],在体内长期积累会导致畸形、癌变和突变[5-6];而其中的邻苯二甲酸二(2-乙基)己基酯(DEHP)对幼儿带来的潜在危害会更大,食用后果可能会造成小孩性别错乱,包括生殖器变短小、性征不明显[7]。
塑化剂与塑料分子的相溶性较好,两者间没有严密的化学结合键,而是由氢键或范德华力连接,彼此保持各自独立的化学性质。当塑料制品接触到水、油脂等时,其中的塑化剂便会迁移入水中,从而造成了对水、食物等污染[1,8-9]。目前,市场上很多饮料都采用塑料瓶包装,在为消费者提供方便的同时也带来了食品安全隐患。
目前,检测食品及塑料制品中PAEs含量的方法较多,而检测饮料中PAEs的方法较少,其中检测DEHP的方法更少。因此,建立一种快速、简便测定饮料中DEHP含量的方法是很必要的。目前国内外测定食品中DEHP主要采用的检测方法是GC/MS[10-12],我国的国标也采用该方法[13]。GC/MS具有重复性好、定性准确等优点[14],但由于GC/MS价格昂贵,且其检测器容易受污染等原因,越来越多的研究者开始使用HPLC技术检测样品中DEHP的含量[15-16],且HPLC适用于检测DEHP等具有高沸点的化合物。目前,常见提取样品中塑化剂主要有超声波辅助提取[17]、索氏萃取[18]、微波提取[19-20]、快速溶剂萃取[21]等技术,为了使样品中塑化剂提取得更充分,通常需要较长的处理时间。
本研究建立了采用超声波辅助水浴提取-HPLC检测饮料中DEHP的含量。水浴加热超声提取取代室温条件下提取饮料中的DEHP,极大地缩短了超声时间、提高了萃取效率。采用HPLC-UV检测提取液中DEHP的含量,取得了满意的实验结果。
1 实验部分
1.1 试剂与仪器
Summit 680型高效液相色谱仪(紫外检测器,美国 Dionex Inc);Pyramid水系 C18色谱柱(250 mm×4.6 mm i.d.,5 μm,北京振翔公司);离心机(TDL-80-2B,上海安亭科学仪器厂);旋转蒸发仪(RE-52AA,上海亚荣生化仪器厂);超声清洗器(KQ-100E,昆山市超声仪器有限公司);电子天平(Sartorius,赛多利斯科学仪器有限公司);过滤膜(Nylon66 0.22 μm,上海全岛公司)。
邻苯二甲酸二(2-乙基)己基酯(DEHP)为标准品(Sigma公司,色谱纯),乙腈、甲醇(天津四友公司,色谱纯),正己烷、丙酮、乙酸乙酯、环己烷、盐酸、氢氧化钠均为分析纯试剂。所用水为二次蒸馏水,所用玻璃仪器均在二次蒸馏水冲洗后,烘干5 h。本试验避免使用塑料器具。
1.2 标准溶液的配置
称量10 mg的DEHP标品于10 mL的容量瓶中,用甲醇定容,配置1 000 mg/L的储备液。将储备液用甲醇稀释,分别配置浓度为 0.05、0.5、1、2、5 mg/L 的系列标准溶液。
1.3 液相色谱条件
Pyramid水系 C18色谱柱(250 mm×4.6 mm i.d.,5 μm);流动相:乙腈与水(体积比为 95 ∶5),流速:0.6 mL/min,柱温:30℃,检测波长为 224 nm,进样量:20 μL;
1.4 样品的前处理
量取体积为2 mL的样品置于三角烧瓶中,分别加入0.06 g氯化钠,5 mL的正己烷于40℃的水温下超声波辅助提取10 min,在3 500 r/min下离心15 min;取上层正己烷提取液2 mL,在低于40℃的条件下,旋转蒸发至干后用甲醇溶解定容于2 mL的容量瓶中。经0.22 μm滤膜过滤,注入HPLC色谱仪中。
2 结果与讨论
2.1 实验条件的优化
2.1.1 提取液的选择
DEHP难溶于水,易溶于乙腈、甲醇等有机溶剂。本文考察了乙腈、甲醇、正己烷、环己烷、乙酸乙酯、丙酮等有机溶剂对样品中DEHP的提取效果,结果见图1。
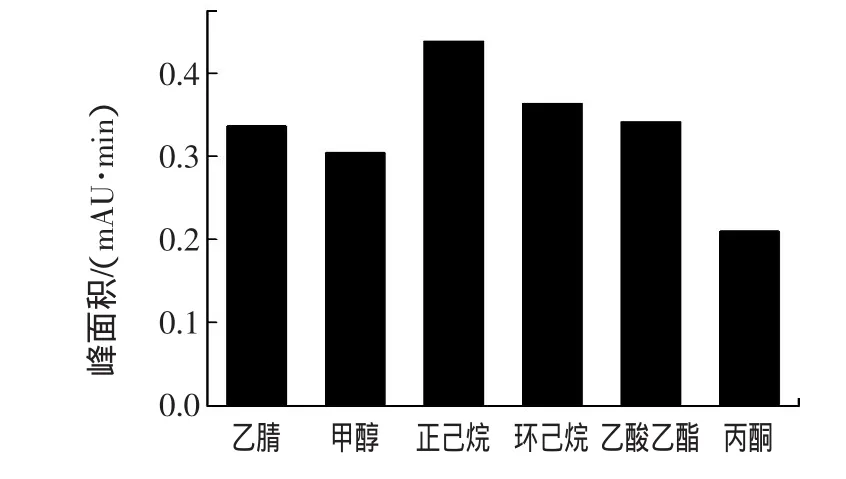
图1 溶剂的选择Fig.1 Effect of extracting solvent
结果表明:在同样的实验条件下,使用正己烷作为提取液,效果更好。
2.1.2 盐效应影响
NaCl通过盐析作用可以促使样品中DEHP进入正己烷层。本实验通过分别向样品中加入0~0.1 g的NaCl,考察加入盐的量对提取DEHP效果的影响。实验结果表明,加入0.06 g的NaCl时,得到的目标物含量较高。结果见图2。
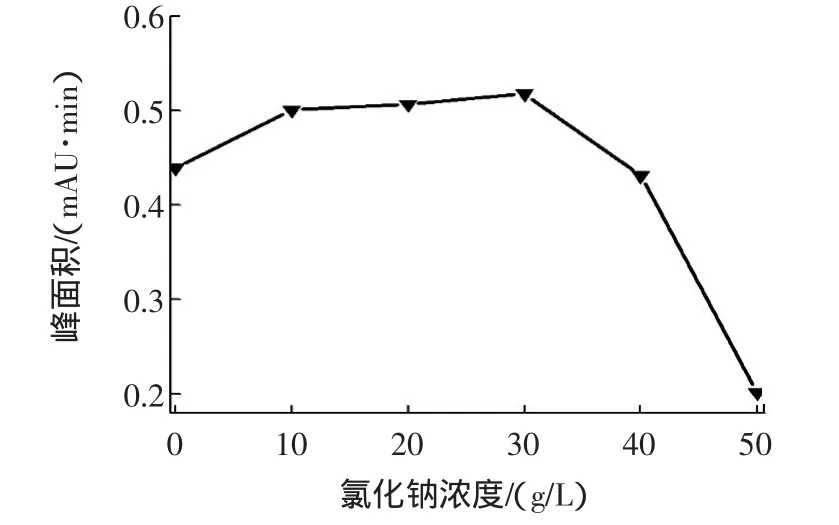
图2 NaCl盐效应的影响Fig.2 Salting effect of NaCl
2.1.3 提取液体积的选择
本实验在2 mL样品体积中,加入正己烷提取液的体积在3 mL~7 mL范围内变化,通过对提取效果的比较,选择最佳正己烷的体积。实验结果表明,当加入正己烷的体积为5 mL时,提取目标物的含量最高。结果见图3。
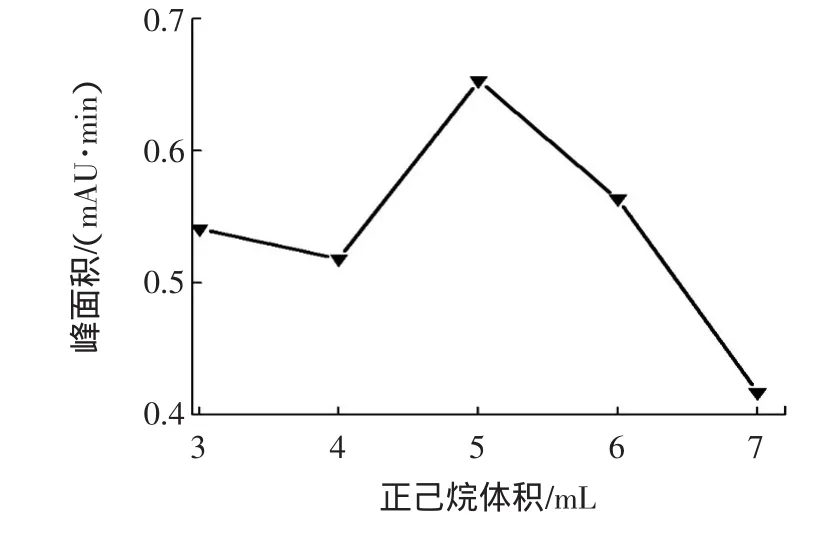
图3 不同体积正己烷的影响Fig.3 Effect of the volume of n-hexane
2.1.4 超声时间的选择
本实验采用超声波辅助提取技术,超声提取速度快、容易操作。文献报道一定超声条件可导致PAEs降解[22]。因此,我们在采用超声提取时,注意控制超声频率、功率及超声时间。在室温的条件下,超声35 min,提取效果最佳。温度的提高可以加速DEHP的提取,本实验又考察了控温在40℃的条件下,超声10 min达到的效果优于在不控温下超声35 min的结果,但将温度继续升至60℃时,萃取的效果反而下降。图4所示,本实验采用的超声提取条件为超声频率40 kHz,功率200 W,控温40℃下,超声提取10 min。
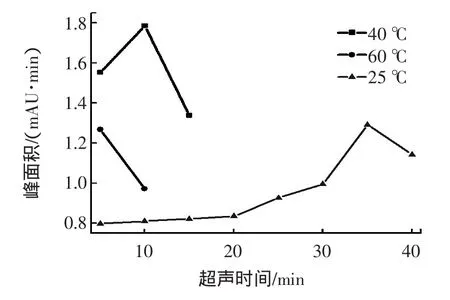
图4 不同温控和不同超声时间的影响Fig.4 Effect of the ultrasonic time and temperature
2.1.5 溶液pH的影响
在一定的条件下,溶液酸碱性影响着有机化合物的提取。在本实验中,考察具有不同的pH条件下,对DEHP提取效果的影响。实验结果见图5可知,当pH为5时,提取效果最佳。
2.1.6 离心时间的影响
一般情况下,离心时间增长,有助于样品的分离和净化。但离心时间过长时,目标物可能会聚沉,反而不利于样品的分离。因此,分别对样品采取在5 min~25 min不同范围的离心时间进行考察。实验表明,在3 500 rpm的条件下离心15 min效果最佳。结果见图6。
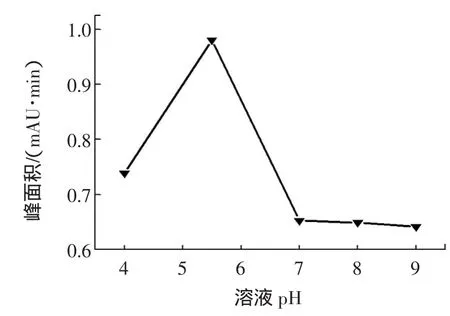
图5 不同pH条件下的提取效果Fig.5 Effect of pH on extraction efficency
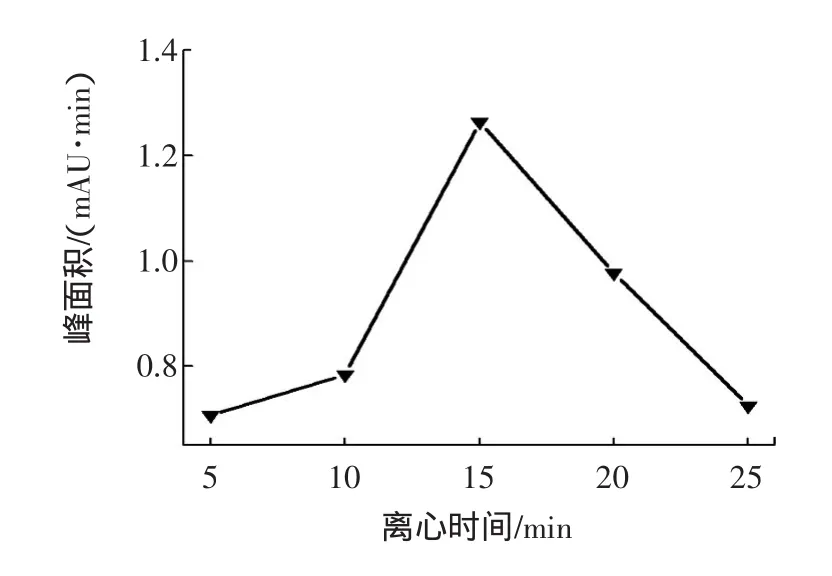
图6 不同离心时间的影响Fig.6 Effect of the centrifugal time
2.2 标准曲线
在最优实验条件下,分别对浓度为 0.05、0.5、1、2、5 mg/L的标准溶液进样得到相应的液相色谱图,图7不同浓度标准溶液的液相色谱图。图8中,以DEHP浓度(mg/L)为横坐标,以对应浓度的峰面积为纵坐标,拟合线性回归方程为Y=0.749 45*X+0.072 83,相关系数R为0.999 95。结果表明:该方法在0.05 mg/L~5 mg/L的浓度范围内线性相关性良好;由3倍信噪比(S/N=3),得到该方法中DEHP的最低检测限(LOD)为0.000 5 mg/L。

图7 不同浓度的DEHP标准溶液的色谱图Fig.7 Chromatograms of standard solution of DEHP
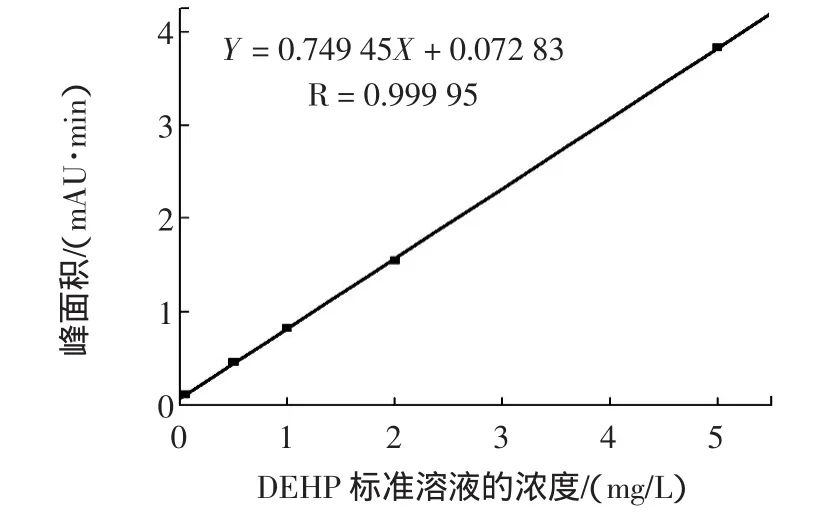
图8 DEHP标准溶液的标准曲线Fig.8 Calibration curve of standard DEHP
2.3 添加回收率和精密度
准确添加不同浓度DEHP的标准溶液至样品中,按照1.4所述对样品进行处理,在优化的实验条件下进液相色谱仪测定,考察方法的精密度(RSD)和回收率,得到方法的回收率在90.2%~101%之间,RSD为2.32%~5.17%之间。结果如表1所示,每个添加水平做7次平行实验。
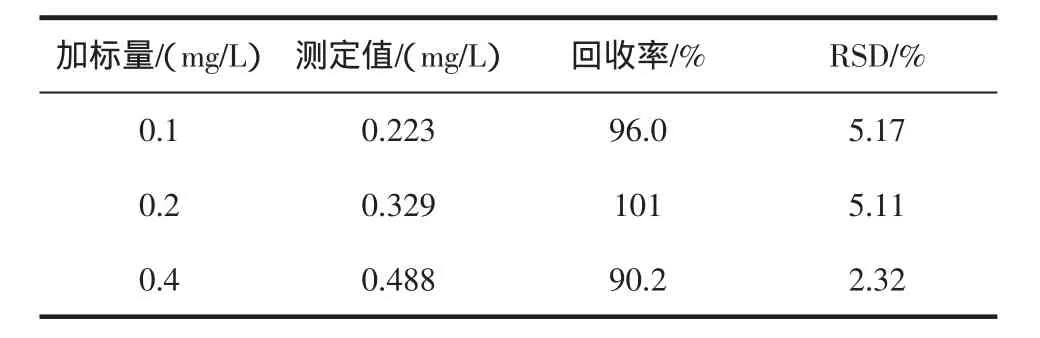
表1 不同添加水平下饮用水中DEHP的回收率及RSD(n=7)Table 1 Recoveries and RSD of DEHP in the water with different amounts(n=7)
我们将本实验采用的方法与已经报道的一些常用检测各类饮料中DEHP方法的最低检测限和RSD进行比较,如表2所示。
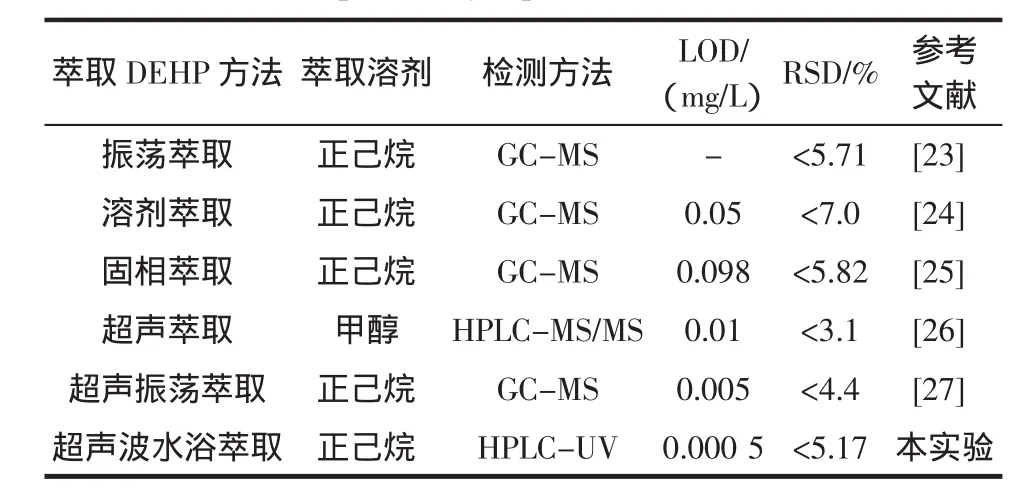
表2 本实验与已有文献检测方法的比较Table 2 Comparison of the presented method with some previously reported works
通过对比表明多数研究小组采用MS检测方法测定饮料中的DEHP,而我们采用成本较低的HPLC;同时我们的实验方法得到非常低的检测限,适用于检测DEHP含量较低的饮料,且本实验有较好的RSD,对检测饮料中DEHP的含量具有一定的可靠性。
2.4 实际样品的测定
在最优实验条件下,将处理好的实际样品进高效液相色谱仪,得到液相色谱图,图9中(a)为汽水样品的色谱图,(b)为汽水样品中加标的色谱图。通过加标样品和标准溶液进液相色谱,从而确定该饮料样品色谱图中目标峰的出峰时间为14.70 min,定量其浓度为0.289 mg/L。由图9可知,本文建立的方法能够实现样品中DEHP与基体中其他组分很好的分离。
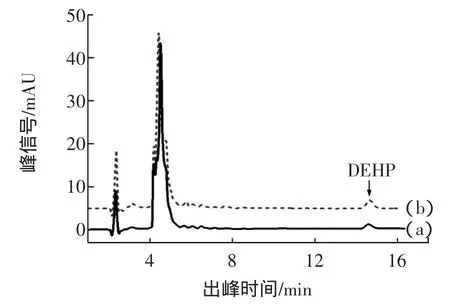
图9 汽水样品(a)及其加标样品(b)液相色谱图Fig.9 Liquid chromatograms of drinks(a)and adding standard(b)
我们用建立的方法分析了多种不同类型饮料样品,每个样品做7次平行实验,检测结果见表3。
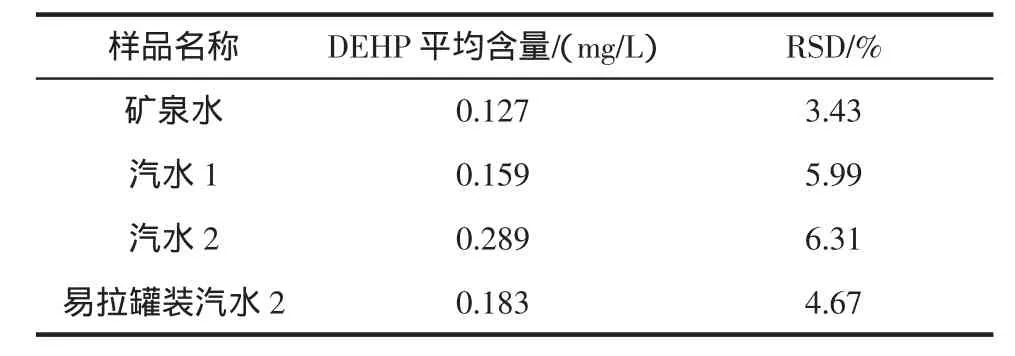
表3 各类饮料样品的分析结果(n=7)Table 3 Analytical results of several different kinds of drink samples(n=7)
实验结果表明汽水饮料样品中DEHP的检测含量在0.127 mg/L~0.289 mg/L之间,RSD 为 3.43%~6.31%之间。本实验对塑料瓶和易拉罐不同包装的汽水均检测出少量的DEHP,而塑料包装的汽水中DEHP的含量约为易拉罐包装的2倍。易拉罐包装的汽水中的DEHP可能是由于在生产过程中接触到塑料材质而引入的。
3 结论
本文建立了加热超声提取-HPLC方法检测饮料中DEHP的含量。40℃下加热辅助超声萃取具有缩短了萃取时间、提高了萃取效果等优势。实验结果表明,DEHP在0.05 mg/L~5 mg/L浓度范围内线性关系良好,相关系数R=0.999 95;检测限为0.000 5 mg/L;加标回收率为90.2%~101%;相对标准偏差(RSD)为2.32%~5.17%。该方法简便、快速、可靠、高灵敏、分离度较好等特点,适用于饮料中DEHP含量的测定。
[1]吴惠勤,朱志鑫,黄晓兰,等.不同类别食品中21种邻苯二甲酸酯的气相色谱-质谱测定及其分布情况研究[J].分析测试学报,2011,30(10):1079-1087
[2]徐磊,夏宁.在线固相萃取/高效液相色谱法测定环境水样中的4种痕量邻苯二甲酸酯[J].分析测试学报,2011(5):558-561
[3]陈如,蒋晓琪,王建平.邻苯二甲酸酯及其生态毒性[J].印染助剂,2010(9):52-56
[4]赵文华,王永凤,赵冬梅.邻苯二甲酸酯环境行为和毒理性研究[J].福建分析测试,2010(2):22-25
[5]蔡晶,柴丽月,胡秋辉.食品中邻苯二甲酸酯的检测及安全评价[J].食品科学,2005,26(12):242
[6]陈波,倪静.邻苯二甲酸酯的毒理学效应及对人体健康的影响[J].化工技术与开发,2010,39(11):46-48
[7]柴丽月,辛志宏,蔡晶.食品中邻苯二甲酸酯类增塑剂含量的测定[J].食品科学,2008,29(7):362-365
[8]王超英,李碧芳,李攻科.固相微萃取/高效液相色谱联用分析水样中邻苯二甲酸酯[J].分析测试学报,2005,24(5):35-38
[9]Castle L,Mercer A J,Startin J R,et al.Migration from plasticized films into foods 3.Migration of phthalate,sebacate,citrate and phosphate esters from films used for retail food packaging[J].Food Add Cont 1988,5(1):9-20
[10]Guilan Huang,Hai-Fang Li,Bo-Tao Zhang,et al.Vortex solvent bar microextraction for phthalate esters from aqueous matrices[J].Talanta,2012(100):64-70
[11]Xu-Liang Cao.Determination of phthalates and adipate in bottled water by headspace solid-phase microextraction and gas chromatography/mass spectrometry[J].Journal of Chromatography A,2008(1178):231-238
[12]Mario Vincenzo Russo,Ivan Notardonato,Giuseppe Cinelli,et al.E-valuation of an analytical method for determining phthalate esters in wine samples by solid-phase extraction and gas chromatography coupled with ion-trap mass spectrometer detector[J].Anal Bioanal Chem 2012(402):1373-1381
[13]国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 21911-2008食品中邻苯二甲酸酯的测定[S].北京:中国标准出版社,2008:1-6
[14]王鑫.食品中邻苯二甲酸酯类污染物分析方法及迁移规律的研究[D].江南大学,2008
[15]Elias Ranjbari,et al.Magnetic stirring-assisted dispersive liquidliquid microextraction followed by high performance liquid chromatography for determination of phthalate esters in drinking and environmental water samples[J].Talanta,2012(100):447-453
[16]Ya-Qi Cai,Gui-Bin Jiang,Jing-Fu Liu,et al.Multi-walled carbon nanotubes packed cartridge for the solid-phase extraction of several phthalate esters from water samples and their determination by high performanceliquidchromatography[J].Analytica Chimica Acta,2003(494):149-156
[17]中华人民共和国出入境检验检疫行业标准.SN/T 1779-2006,塑料血袋中邻苯二甲酸酯类增塑剂的测定气相色谱串联质谱法[S].北京:中国标准出版社,2006:1-5
[18]马康,汤福寿,何雅娟,等.食品包装材料中13种增塑剂的毛细管气相色谱法测定[J].分析测试学报,2011,30(3):284-288
[19]王成云,张绍文,张伟亚.PVC玩具和儿童用品中6种限用邻苯二甲酸酯类增塑剂的同时测定[J].聚氯乙烯,2008,36(2):30-33
[20]中华人民共和国出入境检验检疫行业标准.SN/T 2249-2009,塑料及其制品中邻苯而甲酸酯类增塑剂的测定气相色谱质谱法[S].北京:中国标准出版社,2006:1-6
[21]李波平,林勤保,宋欢,等.快速溶剂萃取-高效液相色谱测定塑料中邻苯二甲酸酯类化合物[J].应用化学,2008,25(1):63-66
[22]Elefteria Psillakis,Dionissios Mantzavinos,Nicolas Kalogerakis.Monitoring the sonochemical degradation of phthalate esters in water using solid-phase microextraction[J].Chemosphere,2004(54):849-857
[23]李彩均,奉夏平,唐丽娜,等.气相色谱-质谱法测定酒类产品中的塑化剂含量[J].基础科学,2013,4:115-116
[24]邵栋梁.GC-MS法测定白酒中邻苯二甲酸酯残留量[J].化学分析计量,2010,19(6):33-35
[25]陈冰冰,李军伟,陈欣欣,等.固相萃取-气相色谱-质谱联用法检测饮料中的邻苯二甲酸二酯[J].温州医学院学报,2013,43(1):22-25
[26]刘杰,郁宏燕,鲍立杰,等.液相色谱-串联质谱法测定饮料中16种邻苯二甲酸酯[J].食品科学,2012,33(18):211-215
[27]张则菊,杨梅,徐健峰,等.GC-MS测定五类饮料中邻苯二甲酸酯类化合物[J].广州化工,2013,41(4):140-142
