组织激肽释放酶与基质金属蛋白酶抑制剂在血管重构中的研究进展
2014-07-26潘玮朱鹏立综述余惠珍审校
潘玮 朱鹏立 综述 余惠珍 审校
(福建省立医院老年医学研究室 福建医科大学省立临床医学院福建省临床老年病研究所,福建福州 350001)
血管重构(vascular remodeling,VR)是血管为适应内外环境变化而发生的结构和功能改变,结构变化包括血管平滑肌细胞(vascular smooth muscle cells,VSMCs)过度增殖,并向内膜迁移,细胞外基质(extra-cellular matrix,ECM)如胶原、蛋白聚糖等大分子物质合成、降解及重新排列,通过与细胞表面受体相互作用以及滞留多种生物活性分子等方式参与细胞行为的调节(包括基因的表达,VSMCs增殖、迁移、分化和凋亡等过程);功能变化表现为血管顺应性降低及对血管活性物质的反应性发生改变等,是高血压、动脉粥样硬化、血管再狭窄、子痫前期等血管重塑性疾病的病理基础,取决于局部生长因子、血管活性物质以及血流动力学之间动态的相互作用[1]。组织激肽释放酶和基质金属蛋白酶抑制剂可以通过不同机制抑制病理生理变化的过程改善血管重构。
1 激肽释放酶-激肽系统与血管重构
1.1 激肽释放酶-激肽系统的概述
激肽释放酶-激肽系统(kallikrein-kinin system,KKS)广泛存在于许多组织和器官中,由前激肽释放酶(prekallikrein)、激肽释放酶(kallikrein,KLK)、激肽原(kininogen)、激肽(kinin)和激肽受体(kinin receptor)和激肽酶(kininaseⅠ、Ⅱ)组成。研究发现在血浆、肾脏、血管等均存在 KKS,见下图 1[2]。
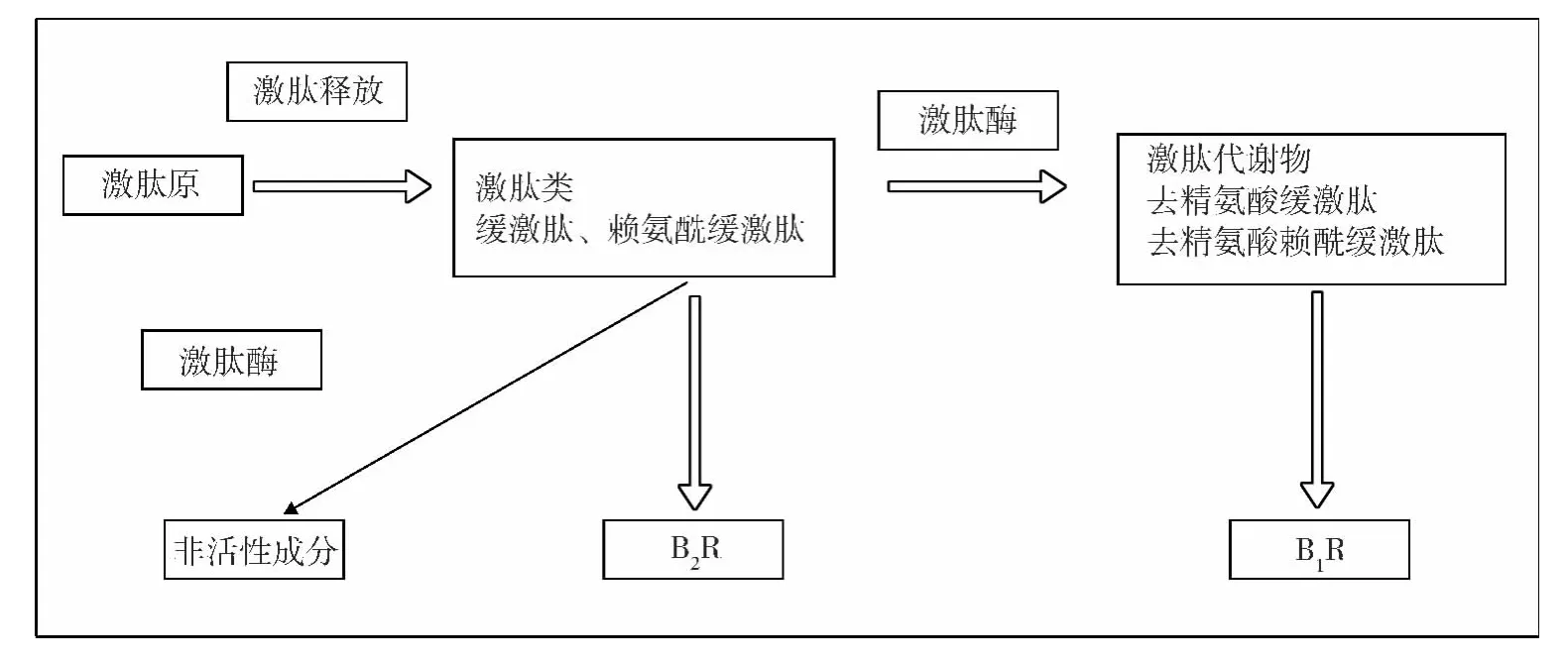
图1 激肽释放酶系统
激肽原是一种单链糖蛋白,哺乳动物体内已发现3种激肽原:(1)T-激肽原仅存在于大鼠体内;(2)高分子量激肽原(HMWK);(3)低分子量激肽原(LMWK)。KLK是一组丝氨酸蛋白酶,分为血浆型激肽释放酶(plasma kallikrein,PK)和组织型激肽释放酶(tissue kallikrein,TK)。PK主要存在于血浆中,又称Fletcher因子,单基因编码,该基因位于4q35染色体上,由15个外显子、14个内含子组成;TK存在于胰腺、肾脏、血管、肺、肾上腺、前列腺等组织,现已发现TK基因家族至少拥有15个成员,排列于同一个染色体位点19q13.4上,其差异大多在于内含子的长度不同,依次命名为KLKI~KLK15。在组织损伤和机体应激等情况下,HMWK由PK作用转换为缓激肽(bradykinin,BK,Arg-Pro-Gly-Phe-Ser-Pro-Phe-Arg) 和活性高分子量激肽原(HKα),LMWK则由TK作用转化为赖氨酰缓激肽(kallidin,Pro-Pro-Gly-Phe-Set-ProPhe-Arg) 和精氨酸缓激肽,赖氨酰缓激肽在氨基肽酶的催化下切去赖氨酸而成为缓激肽。目前比较清楚的激肽受体有B1和B2,它们都是G蛋白偶联受体。一般认为,BK与B2受体结合,刺激第二信使如一氧化氮(NO)/环磷酸腺苷(cGMP)和前列环素(PGI2)/环磷酸鸟苷(cAMP)的释放,从而扩张小动脉,增加局部血流,抑制肾素分泌,增加血管通透性,调节血压和心血管功能。B1受体仅在细菌脂多糖(内毒素)、白介素刺激、创伤、感染、炎症等多种致病因素作用下通过激活下游磷脂酶C(pbospholipase C,PLC)、蛋白激酶C、磷脂酶A及内皮型一氧化氮合酶(eNOS)等多种途径,刺激平滑肌细胞增殖,胶原形成,从而在血管通透性变化、炎症反应、疼痛及参与新生血管的形成过程中发挥作用[3]。BK及其类似物在激肽酶的作用下降解失活。激肽酶主要有两类,即激肽酶Ⅰ和Ⅱ,其中激肽酶Ⅱ即是血管紧张素转换酶。
1.2 激肽释放酶-激肽系统在血管重构中的作用及其分子机制的研究
VSMCs作为血管壁中的主要细胞成分,其表型转化及伴随出现的生物学行为改变是血管重塑的重要病理学基础。VSMCs发生表型转化,即由收缩型转换为合成型,从而含有大量核糖体、高尔基体和粗面内质网等细胞器,具有合成和分泌细胞外基质和血管活性物质的功能[4];在血小板活化脱颗粒释放的各种细胞因子[如血小板源性生长因子(platelet-derived growth factor,PDGF)、转化生长因子、表皮生长因子]以及自身分泌和巨噬细胞分泌的各种细胞因子的作用下,不断地增殖并向内膜迁移[5],从而促进血管重构。
Murakami等[6]研究用腺病毒介导的人KLK1基因转移抑制原代培养SD大鼠的VSMCs增殖,改善球囊损伤后SD大鼠的颈动脉新生血管内膜形成,提示KLK可能可以抑制VSMCs增殖与迁移抗血管重构。已知PDGF是最强的VSMCs体外化学趋化剂和丝裂原。余惠珍[7]研究显示人 KLK1基因转移可抑制PDGF-BB诱导的VSMCs增殖与迁移;由于KLK活化激肽原后产生的活性产物赖氨酸-缓激肽(Lys-BK)同样可显著抑制PDGF-BB诱导的大鼠VSMCs增殖与迁移,而在B2R基因敲除模型小鼠里,KLK的保护作用被明显减弱[8],故推测KLK抑制VSMCs增殖与迁移与B2受体有关,可能通过:(1)BK作用于B2受体,通过G蛋白介导激活磷脂酶C(PLC),后者可将磷脂酰肌醇水解为 1,4,5-三磷酸肌醇(IP3)和二酰甘油(DAG),使细胞内 Ca+释放,激活 NOS,释放 NO[9]。Sun等[10]的研究显示,NO对VSMCs迁移的抑制作用呈剂量依赖性;(2)BK作用于B2受体,抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路。Redondo等[11]研究显示,VSMCs的增殖过程需要p38 MAPK参与。近期的研究[12]发现腺病毒介导的h-KLK基因转移至球囊损伤血管段,血管内可表达KLK,局部BK水平也增高,通过B2受体介导,再激活受体下游的信号转导通路,抑制MAPK磷酸化,上调细胞周期素依赖性激酶抑制蛋白p27Kipl和p21Cipl表达,使细胞阻滞于G0/G1期,从而抑制VSMCs增殖。此外,Morissette等[13]研究发现,在 PDGF-BB 诱导的迁移实验中,B1受体阻滞剂明显逆转赖氨酸-缓激肽抑制迁移效应,而B2受体阻滞剂Hoel40则不影响这种抑制效应,提示BK通过B1受体抑制平滑肌细胞迁移的作用。
目前临床上最常用的KLK是来源于猪的胰激肽释放酶,由于动物来源的胰激肽释放酶对人类是一种异种蛋白,静脉给药具有很强的免疫原性;而口服给药因蛋白酶解作用会极大降低药物的利用率,所以基因治疗引起人们的关注,但利用h-KLK进行血管重塑性疾病的基因治疗存在如下问题:(1)重复性问题,没有证据证明重复多次给予KLK基因以后KLK基因降压效应不会降低;(2)安全性问题,没有证据证明长期、多次及重复给予KLK基因后不会有相应抗体产生,病毒载体安全性仍无保证;(3)时效问题,近来有研究考虑应用人KLK基因大量生产蛋白质产物人源性组织激肽释放酶来抗血管重构,但仍需进一步研究可行性。
2 基质金属蛋白酶及其抑制物系统与血管重构
2.1 基质金属蛋白酶的概述
基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类降解细胞外基质和基底膜成分的锌离子(Zn2+)依赖性内肽酶家族,根据降解的底物不同及序列的相似性,分成6类:(1)胶原酶类(collagenases)(MMP-1,8,13,18),降解间质胶原;(2)明胶酶类(gelatinases),包括 MMP-2 及 MMP-9,降解变性的胶原及基膜的IV型胶原;(3)基质分解素(stromelysins),MMP-3 与 MMP-10;(4)基质溶解因子(matrilysins),MMP-7 及 MMP-26;(5)膜型基质金属蛋白酶(membrane-type,MT-MMPs),此组中共有 6 个成员,4 个是 I型跨膜蛋白(MMP-14,15,16,24),两个是 GPI锚连蛋白(MMP-17 及 MMP-25);(6)其他种类的 MMPs。
2.2 基质金属蛋白酶抑制剂的概述
基质金属蛋白酶抑制剂(matrix metalloproteinases inhibitors,MMPIs)分为体内天然的抑制剂以及人工合成的抑制剂。组织基质金属蛋白酶抑制剂(tissue inhibitors of MMPs,TIMPs)和 α-2 巨球蛋白是 MMPs的天然抑制物[14],TIMPs抑制 MMPs的激活机制:(1)在酶原活化阶段,TIMPs与基质金属蛋白酶前体(pro-MMP)可形成稳定的复合体,阻碍pro-MMP的酶原自我激活;(2)在活化的MMP阶段,TIMP可直接与活化的MMP形成紧密的1∶1复合体,抑制其活性。目前已证实的 TIMPs有4 种(TIMP-1,2,3 和4),TIMP-1 相对分子质量为 28 500,它可与活化的 MMP-1,3,9 和除MT-MMP外大多数MMPs形成1∶1的复合物,降低细胞外基质的降解;TIMP-2相对分子质量为21 000,主要抑制MMP-2活性,同时能阻断所有被激活的MMPs的水解酶活性。TIMP-3是一种结合于细胞外基质的非可溶性蛋白,Huang等[15]研究表明 TIMP-3 是 MMP-9的特异性抑制物,除MMPs外还可以抑制去整合素和金属蛋白酶(A disintegrin and metalloprotease,ADAM)的功能。由于有更广泛的抑制谱,TIMP-3基因敲除的小鼠可以引起肺气肿样的肺泡损伤[16],并加速断奶后乳腺上皮细胞的凋亡。TIMP-4抑制新生血管的形成,抑制VSMCs迁移。
人工合成的MMPIs在结构上都具有2个共同特点:(1)含有一个 Zn2+结合基团(zinc-binding-groups,ZBG),可与MMP活性中心的 Zn2+配位结合进而使MMPs失活;(2)分子骨架富含能形成氢键的原子或基团,以增加整个分子与酶的亲和力,决定MMPIs的选择性以及药代动力学特性。基于Zn2+结合基(ZBGs)的结构特点,分为5类:(1)异羟肟酸类;(2)反式异羟肟酸类;(3)非异羟肟酸类;(4)各种天然产物MMPIs;(5)非Zn2+结合基MMPIs。
2.3 基质金属蛋白酶与基质金属蛋白酶抑制剂在血管重构中的作用及其分子机制的研究
细胞外基质是存在于组织细胞表面或细胞之间的一组蛋白大分子,主要包括胶原蛋白、非胶原糖蛋白和蛋白多糖。血管重构实质由细胞外基质的降解和合成失衡引起,当血管损伤时,血管壁细胞受多种细胞因子和生长因子的刺激,分泌大量的细胞外基质。在大量细胞外基质合成的同时,VSMCs和内皮细胞合成MMPs增加,导致原有基质发生特异性降解,细胞外纤维连接蛋白沉淀,被激活细胞侵入病变区,Ⅰ和Ⅳ型胶原沉积增加,最后形成典型胶原纤维交互联结;血管在这种细胞外基质降解和新的基质成分沉积增加的过程中发生重构。MMPs、TIMPs影响细胞外基质的降解与重合成对维持血管正常的形态及功能非常重要。(1)在血管重塑性疾病中,MMPs在损伤血管中高表达,高表达的MMPs反过来进一步通过降解细胞外基质促进炎症细胞的迁移、黏附[17],参与血管内皮细胞及平滑肌细胞的增殖、迁移与凋亡。(2)MMPs通过促进多潜能干/祖细胞的迁移参与血管重构。Laxton 等[18]发现 MMP-8 可以促进多能干/祖细胞从动脉管腔或动脉外膜迁移,参与动脉粥样硬化斑块的形成,ApoE和MMP-8双基因敲除的小鼠动脉粥样硬化斑块的形成减少。(3)血管内皮细胞被活化表达MMPs,活化的MMPs降解血管基膜和细胞外基质,使血管内皮细胞分离,从而促进细胞的增殖、迁移及凋亡,引起血管重构。有研究证明活化的MMP-1促进血管内皮生长因子受体(vascular endothelial growth factor receptors,VEGFR)的表达,通过与血管内皮生长因子作用,介导蛋白酶活化受体-1和核转录因子(NF-κB)信号通路促进血管内皮细胞增殖[19]。(4)MMPs促进中膜VSMCs增殖与迁移参与血管重构。Kim等[20]发现体外培养的平滑肌细胞在MMP-2的作用下进行有丝分裂和迁移,使血管壁增厚,而MMP-2缺乏会减少颈动脉结扎后的VSMCs的迁移,抑制内膜的增生。
体内外实验发现MMPI基因转染可以抑制VSMCs的迁移和新生内膜的形成。Ramirez等[21]通过球囊拉伤的方法建立大鼠颈动脉再狭窄模型后,给予携带TIMP-1基因的腺病毒进行干预,观察发现,携带TIMP的腺病毒能够成功转染VSMCs,并在动脉壁中持续表达数周,病理切片发现转染TMIP-1的大鼠损伤部位2周后内膜中膜厚度比减少70.5%,1个月后减少58.5%,2个月后减少52.4%。Dollery和Ramirez等得出相同的结果。Tong等[22]用腺病毒介导TIMP-4基因转染发现TIMP-4同样具有抑制VSMCs迁移的作用。同时TIMP转染的内皮细胞的迁移率也明显降低,细胞外基质的合成也明显受抑制。
目前MMPIs临床上主要用于治疗关节炎、肿瘤等疾病。巴马司他(batimastat)是第一个进入临床试验治疗癌症的MMPs抑制剂。
3 基因治疗与血管重构
3.1 基因治疗的概述
基因治疗是应用基因工程和细胞生物技术治疗疾病的一种方法。1990年9月14日美国官方首例批准用基因方法治疗由腺苷脱氨酶(adenosine deaninase,ADA)基因缺陷引起的重度联合免疫缺陷病(SCID),开拓了基因治疗的历史。近来携带有低密度脂蛋白(low-density lipoprotein,LDL)受体基因的逆转录病毒载体导入肝细胞可以有效清除LDL,降低高脂血症,已用于临床[23]。
随着人类基因组计划顺利完成和功能基因组计划的发展,多基因疾病的研究已成为当前和今后一段相当长时期内倍受关注的焦点。多基因疾病受多个基因控制,其复杂的表型性状虽然表现出一定的家族聚集倾向性,但并不完全符合孟德尔遗传规律,受环境及其他非遗传因素和潜在的患病风险基因共同作用。近年来发现,由于转染效率不足,功能基因表达水平低下等原因单基因转移极大地限制了基因治疗的临床疗效,采用多基因治疗有望在相同的DNA递送效率下增加外源基因的有效转录,提高其表达水平,并使之产生协同作用,为多基因疾病治疗的临床方案提供依据。
国内外开展的多基因共表达已广泛用于肿瘤疾病的治疗,Xu等[24]用 MDA-7/IL-24双基因共表达靶向抗结肠肿瘤。Dong等[25]用MDA-7/IL-24双基因共表达靶向治疗白血病。除了靶向抗肿瘤外,双基因共同表达还可以增强新生血管成骨作用。Mattar等[26]用BMP-2/VEGF-165双基因共转染大鼠骨髓基质干细胞促进血管成骨作用,从而为激素性股骨头坏死(SANFH)提供新的治疗思路。双基因共表达还可以治疗血管性疾病,范波胜等[27]构建神经生长因子(NGF)与血管内皮生长因子(VEGF)165双基因共同表达载体pIRES-NGF-VEGF165以期达到治疗脑梗死的目的。Jazwa等[28]运用VEGF-A和FGF-4双基因共同表达促进急性肢体缺血的恢复。Rayssac等[29]研究发现,采用纤维生长因子2和Cyr61双基因共同表达载体,可明显增加小鼠缺血下肢的新生血管密度。
3.2 多基因共同表达在血管重构中的研究进展
大多数血管重塑性疾病为多基因疾病。早期Ohno等[30]以双球囊导管将携有单纯疱疹病毒-胸苷激酶(HSV-TK)基因的腺病毒载体定位转移至小型猪球囊扩张损伤的冠状动脉段,连续6 d静脉注射抗病毒药物丙氧鸟苷,结果显示治疗VSMCs增殖活动明显减弱,动脉内膜与中膜比值缩小。Olivier等严格地比较了腺病毒介导的PAI-1、NOS及TK基因转染配合丙氧鸟苷对损伤后再狭窄形成的防治作用,发现TK/GCV组的疗效最好。在此基础上,Cao等[31]研究共同表达CD和TK双自杀基因对平滑肌细胞的杀伤作用大于CD或TK单自杀基因。类似的双基因共同表达的研究在国内也有报道。Zhang等[32]研究证明VEGF和PDGF双基因共同表达在体外可明显促进VSMCs的增殖,促进血管重构。Nakanishi等[33]构建 MAPKAPK3和FHL5双基因共同表达载体,抑制血管内膜增生,抑制血管重构。KLK和TIMP基因分别具有抑制血管平滑肌增殖和迁移的作用,结合多基因共同表达载体构建技术的发展,考虑可以协同KLK和TIMP构建双基因共同表达载体抑制VSMCs的增殖与迁移,抗血管重构。
4 展望
从1990年美国进行基因治疗至今已有23年时间,心血管基因治疗领域已有很大的发展。基因转染与其他遗传学技术结合已证实可用于制造各种心血管病的动物模型,可以对心血管系统的各种表选蛋白的功能进行深入研究。基因治疗不仅能治疗成年人的心血管疾病,还可应用基因工程方法生产出各种基因药物治疗心血管疾病。心血管系统基因治疗的领域无限广阔,KLK和MMPI基因在血管重构中的作用以及双基因共同表达载体的构建技术将为治疗血管重塑性疾病提供新的治疗前景,但仍需要进一步实验研究探讨其可行性。
[1]Gao J,Sun L,Huo L,et al.CYLD regulates angiogenesis by mediating vascular endothelial cell migration[J].Blood,2010,1(15):4130-4137.
[2]Savard M,Barbaz D,Bélanger S,et al.Expression of endogenous nuclear bradykinin B2 receptors mediating signaling in immediate early gene activation[J].Cell Physiol,2008,216(1):234-244.
[3]Wu D,Lin X,Bernloehr C,et al.Effects of a novel bradykinin B1 receptor antagonist and angiotensinⅡ receptor blockade on experimental myocardial infarction in rats[J].PLoS One,2012,7(12):e51151.
[4]Smiljanic K,Dobutovic B,Obradovic M,et al.Involvement of the ADAM l2 in thrombin-induced rat's VSMCs proliferation[J].Curr Med Chem,2011,18:3382-3386.
[5]Cersosimo E,Xu X,Musi N.Potential role of insulin signaling on vascular smooth muscle cell migration,proliferation,and inflammation pathways[J].Am J Physiol Cell Physio1,2012,302:C652-C657.
[6]Murakami H,Miao RQ,Chao L,et al.Adenovirus-mediated kallikrein gene transfer inhibits neointima formation via increased production of nitric oxide in rat artery[J].Immunopharmacology,1999,44(1-2):137-143.
[7]余惠珍.hKLK1基因转移对血管平滑肌细胞增殖、迁移和球囊损伤后SHR颈动脉新生内膜的影响[D].福建医科大学,2008.
[8]Jaffa MA,Kobeissy F,Al Hariri M,et al.Global renal gene expression profiling analysis in B2-kinin receptor null mice:impact of diabetes[J].PLoS One,2012,7(9):e44714.
[9]Maslov LN,Hedrick JP,Krylatov AV,et al.Receptor and signalling mechanisms of antiarrhythmic effects of ischemic pre-conditioning[J].Ross Fiziol Zh Im I M Sechenova,2013,99(3):320-338.
[10]Sun L,Zhao R,Zhang L,et al.Salvianolic acid A inhibits PDGF-BB induced vascular smooth muscle cell migration and proliferation while does not constrain endothelial cell proliferation and nitric oxide biosynthesis[J].Molecules,2012,17(3):3333-3347.
[11]Redondo A,Estrella N,Lorenzo AG,et al.Quercetin and catechin synergistically inhibit angiotensin Ⅱ-induced redox-dependent signalling pathways in vascular smooth muscle cells from hypertensive rats[J].Free Radic Res,2012,46(5):619-627.
[12]Yu HZ,Xie LD,Zhu PL,et al.Human tissue kallikrein 1 gene delivery inhibits PDGF-BB-induced vascular smooth muscle cells proliferation and upregulates the expressions of p27Kip1 and p2lCip1[J].Mol Cell Biochem,2012,360(1-2):363-371.
[13]Morissette G,Sabourin T,Adam A,et al.Inhibition of human rabbit arterial smooth muscle cell migration mediated by the kinin B1 receptor:role of receptor density and released mediators[J].J Physiol Pharmacol,2006,84:1107-1119.
[14]Benjamin MM,Khalil RA.Matrix metalloproteinase inhibitors as investigative tools in the pathogenesis and management of vascular disease[J].EXS,2012,103:209-279.
[15]Huang R,Deng L,Shen A,et al.Associations of MMP1,3,9 and TIMP3 genes polymorphism with isolated systolic hypertension in Chinese han population[J].Med Sci,2013,10(7):840-847.
[16]Ebrahem Q,Qi JH,Sugimoto M,et al.Increased neovascularization in mice lacking tissue inhibitor of metalloproteinases-3[J].Invest Ophthalmol Vis Sci,2011,52(9):6117-6123.
[17]Henriksen NA,Sørensen LT,Jorgensen LN,et al.Circulating levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in patients with incisional hernia[J].Wound Repair Regen,2013,21(5):661-666.
[18]Laxton RC,Hu Y,Duchene J,et al.A role of matrix metalloproteinase-8 in atherosclerosis[J].Circ Res,2009,9(105):921-929.
[19]Mazor R,Alsaigh T,Shaked H,et al.Matrix metalloproteinase-1-mediated upregulation of vascular endothelial growth factor-2 in endothelial cells[J].J Biol Chem,2013,288(1):598-607.
[20]Kim YH,Lee SJ,Seo KW,et al.Platelet activating factor enhances MMP-2 production in rat aortic primary vascular smooth muscle cells via a β-arrestin2-dependent ERK signaling pathway[J].J Lipid Res,2013,54(10):2678-2686.
[21]Ramirez Correa GA,Zacchigna S,Arsic N,et al.Potent inhibition of arterial intimal hyperplasia by TIMP1 gene transfer using AAV vectors[J].Mol Ther,2004,9(6):876-884.
[22]Tong W,Xiong F,Li Y,et al.Hypoxia inhibits cardiomyocyte proliferation in fetal rat hearts via upregulating TIMP-4[J].Am J Physiol Regul Integr Comp Physiol,2013,304(8):R613-620.
[23]di Lello FA,Caruz A,Rallon NI.Effects of the genetic pattern defined by lowdensity lipoprotein receptor and IL28B genotypes on the outcome of hepatitis C virus infection[J].Eur J Clin Microbiol Infect Dis,2013,32(11):1427-1435.
[24]Xu SL,Oshima T,Imada T,et al.Stabilization of MDA-7/IL-24 for colon cancer therapy[J].Cancer Lett,2013,335(2):421-430.
[25]Dong CY,Zhang F,Duan YJ,et al.mda-7/IL-24 inhibits the proliferation of hematopoietic malignancies in vitro and in vivo[J].Exp Hematol,2008,36(8):938-946.
[26]Mattar T,Friedrich PF,Bishop AT.Effect of rhBMP-2 and VEGF in a vascularized bone allotransplant experimental model based on surgical neoangiogenesis[J].J Orthop Res,2013,31(4):561-566.
[27]范波胜,娄季宇,白宏英.神经生长因子与血管内皮生长因子165双基因共表达载体的构建及鉴定[J].中华老年心脑血管病杂志,2013,15(4):427-429.
[28]Jazwa A,Tomczyk M,Taha HM,et al.Arteriogenic therapy based on simultaneous delivery of VEGF-A and FGF4 genes improves the recovery from acute limb ischemia[J].Vasc Cell,2013,5(1):13.
[29]Rayssac A,Neveu C,Pucelle M,et al.IRES-based vector coexpressing FGF2 and Cyr61 provides synergistic and safe therapeutics of lower limb ischemia[J].Mol Ther,2009,17(12):2010-2019.
[30]Ohno T,Gordon D,San H,et al.Gene therapy of vascular smooth muscle cell proliferation after arterial injury[J].Science,1994,265(5173):781-784.
[31]Cao HQ,Meng XM,Liu DQ,et al.Killing effect of coexpressing cytosine deaminase and thymidine kinase on rat vascular smooth muscle cells[J].Chin Med J,2004,117(10):1464-1470.
[32]Zhang H,Jia X,Han F,et al.Dual-delivery of VEGF and PDGF by doublelayered electrospun membranes for blood vessel regeneration[J].Biomaterials,2013,34(9):2202-2212.
[33]Nakanishi K,Saito Y,Azuma N,et al.Cyclic adenosine monophosphate response-element binding protein activation by mitogen-activated protein kinaseactivated protein kinase 3 and four-and-a-half LIM domains 5 plays a key role for vein graft intimal hyperplasia[J].Vasc Surg,2013,57(1):182-193.
