EPO单克隆抗体抑制CFU-E研究
2014-07-25黄学文李素芝谢晓饿刘厚东闫春城石泉贵丁浩平
黄学文,李素芝,黄 跃,谢晓饿,刘厚东,闫春城,石泉贵,丁浩平,何 锋,陈 有
EPO单克隆抗体抑制CFU-E研究
黄学文,李素芝,黄 跃,谢晓饿,刘厚东,闫春城,石泉贵,丁浩平,何 锋,陈 有
目的 探讨EPO单克隆抗体是否具有抑制红系集落形成单位(CFU-E)形成的功能。方法 对大鼠骨髓进行定向体外CFU-E培养,按以下条件进行分组培养:空白对照组(不加EPO)、常规组(加EPO,不加EPO单克隆抗体)、EPO单克隆抗体干预组(EPO+EPO单克隆抗体)。培养168 h后,观察各组CFU-E数量。结果 空白对照组、常规组、EPO单克隆抗体干预组的CFU-E集数落分别为0.0±0.0、151.8±23.3和10.7±3.9。EPO单克隆抗体干预组与常规组比较,CFU-E集落数存在非常显著性差异(P<0.01)。结论 该EPO单克隆抗体可明显抑制CFU-E形成,即抑制红细胞系的增殖,是治疗高原红细胞增多症的可能药物。
红系集落形成单位;促红细胞生成素;抗体;骨髓;大鼠
在高原由于缺氧红细胞增高,部分人员过度增高形成高原红细胞增多症(high altitude polycthemia,HAPC)。HAPC发病率高达到2.51%[1],可以引起全身多器官损害,症状重,是危害高原人群健康的一种常见慢性高原病。目前对HAPC的治疗还缺乏特效的方法与药物[1],急需要研究出有效的治疗药物。红细胞生成素(erythropoietin,EPO)在HAPC的发病机理中起着重要作用,减低它的生物活性,可以调控红细胞的生成,达到治疗HAPC的目的。EPO多克隆抗体虽然可以减低EPO的生物活性[2],但多克隆抗体有很多缺点,在临床中使用受到限制,因此,开发EPO单克隆抗体是必然趋势。前期本研究利用杂交瘤细胞技术制备出了EPO单克隆抗体[3],本实验对该EPO单克隆抗体抑制EPO促红细胞系形成的生物效能进行了研究。
1 材料与方法
1.1 主要试剂 Rh-EPO(金坦生物技术有限公司),EPO单克隆抗体(本院制备)。
1.2 实验动物 SD大鼠共20只,均为雄性,体重143~155 g,从四川大学华西动物实验中心购买。
1.3 研究方法
1.3.1 骨髓有核细胞悬液的制备 将SD大鼠处死取出股骨,DMEM细胞培养液冲洗出骨髓。将淋巴细胞分离液移入离心管中,加骨髓液形成界面,两液体的体积比为1∶2。18 ℃、400g水平恒温离心,吸取最上面一层。用DMEM液稀释后重复以下操作2次:18 ℃、400g水平恒温离心。最后采用逐步稀释法,将细胞密度调至2.5×108/L。用2%台盼蓝检测,活细胞率>95%。
1.3.2 实验分组 将上述分离的细胞随机分为3组,即:空白对照组(不加EPO)、常规组(加EPO,不加EPO单克隆抗体)和EPO单克隆抗体干预组(EPO+EPO单克隆抗体)。分别进行红系集落形成单位(CFU-E)培养,空白对照组不加EPO;常规组加EPO,但不加EPO单克隆抗体;EPO单克隆抗体干预组加EPO和EPO单克隆抗体。各组加入的EPO及EPO单克隆抗体的浓度及量见表1。CFU-E培养采用甲基纤维素培养体系[4]。
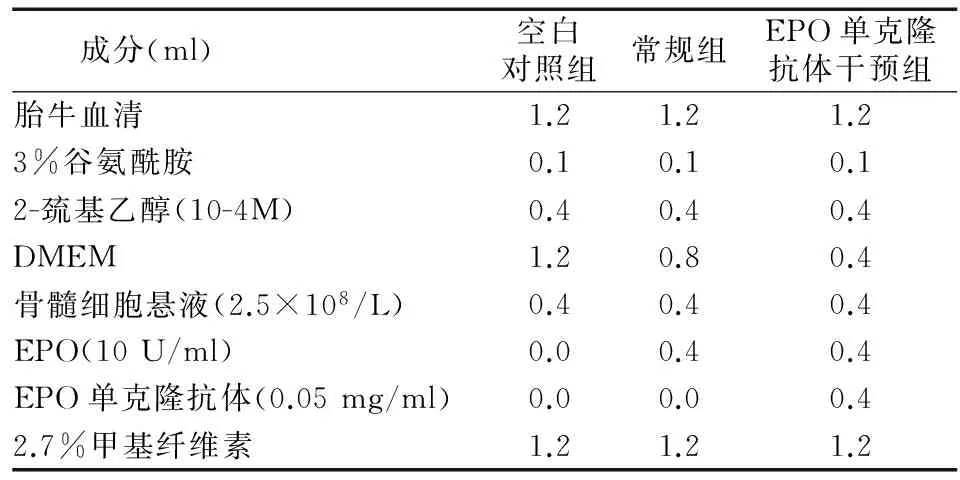
表1 各组培养液体系成分
1.3.3 培养条件及时间 从表1各组甲基纤维素培养体系液分别取0.2 ml加入培养板一个孔中,每组加20个孔。在饱和湿度、5%CO2、37 ℃的CO2培养箱中培养168 h。
1.4 CFU-E集落判定标准及计数 CFU-E集落判定标准:细胞为橘红色,集落内细胞数≥8个。CFU-E集落计数方法:在显微镜下计数每单个培养孔全视野内的CFU-E集落数量。
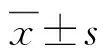
2 结果
空白对照组无CFU-E集落形成;常规组CFU-E集落数较多,每个培养孔CFU-E集落数平均值为151.8±23.3;EPO单克隆抗体干预组CFU-E集落数明显减少(图1),每个培养孔CFU-E集落数平均值为10.7±3.9。EPO单克隆抗体干预组与常规组比较,CFU-E集落数非常显著减少(P<0.01)。
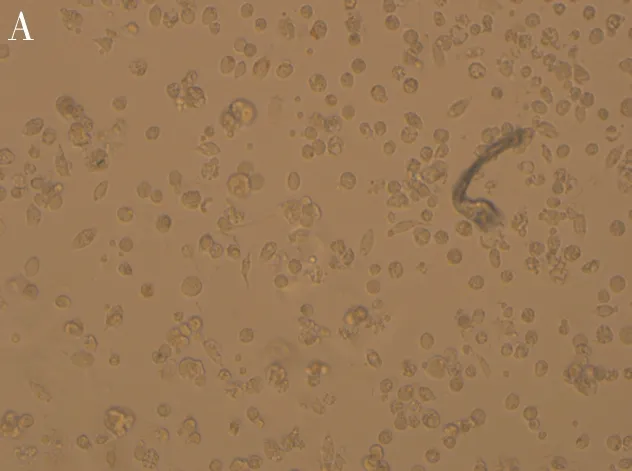
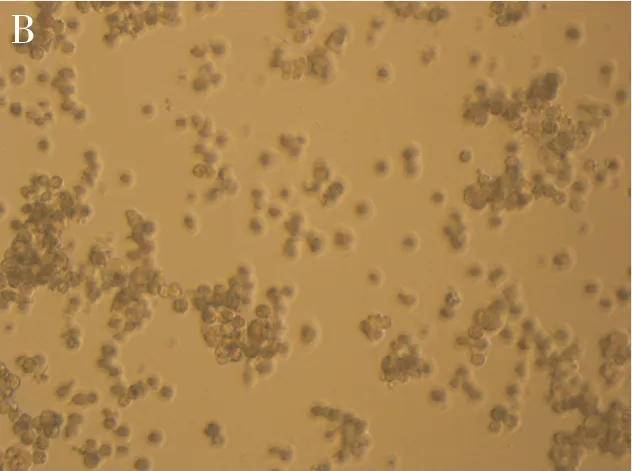
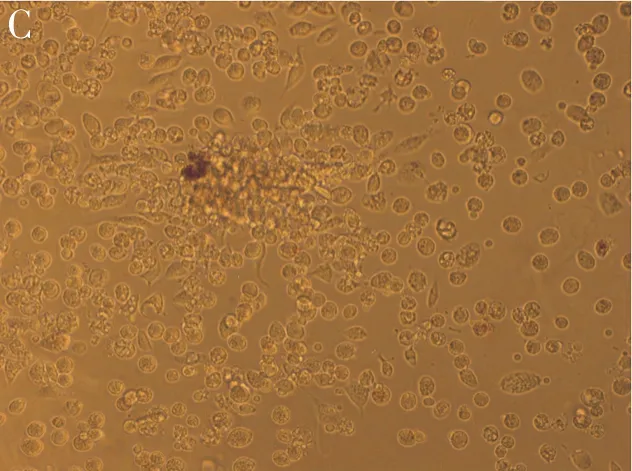
图1 各组CFU-E培养结果
A:空白对照组,无CFU-E集落;B:常规组,CFU-E集落数较多;C:EPO单克隆抗体干预组,CFU-E集落数减少
3 讨论
HAPC血液学特点是红细胞过度增多,红细胞压积增高,红细胞变形能力减低,血液黏度增高,血液流动阻力增加,血液运氧能力下降,引起全身多器官、组织缺氧,对身体危害特别大。但目前在高原环境,由于缺氧这个发病的根本原因未消除,HAPC的治疗还缺乏特效的方法[1],急需要研究出有效的新药物。另一方面,HAPC本质上是一种继发性红细胞增多,其发病机制与真性红细胞增多症有本质的区别。当HAPC患者回到低海拔地区一定时间缺氧得到改善后,红细胞可恢复到正常,其红细胞增多是可逆的,也就是可以调控的,HAPC是可以治疗的。
在红细胞系的形成与成熟过程中,要经过造血干细胞、红系祖细胞、红系前体细胞、网织红细胞,最终形成成熟红细胞。造血干细胞是一种多能干细胞,大部分处于静止期,部分处于增殖状态,造血干细胞向何种细胞系分化、增殖,细胞因子起决定作用。当EPO与造血干细胞上的受体结合后传导信号,造血干细胞向红系祖细胞分化与增殖[5]。红系祖细胞上也存在EPO受体,在EPO的作用下,红系祖细胞进一步向前增殖与分化。可见EPO在红细胞系的形成中起重要作用,是HAPC发病的重要机制。在平原人群中,EPO的正常浓度为10~26 U/L,到高原后的几小时内已开始明显增加,此后一直高于平原水平[6]。在大部分HAPC患者,血浆EPO值显著高于非HAPC人群。如果将EPO的生物活性降低,红细胞的生成将减少,HAPC将得到根本意义上的治疗。
当EPO与EPO抗体结合后,可出现以下改变:EPO空间结构发生改变;出现空间位阻效应;抗体至少是二价的特性,使一个抗体同时和两个抗原结合,进而最后形成数个EPO抗原与EPO抗体结合,形成免疫复合物[7]。由于以上改变,影响EPO与其受体的结合或影响受体的二聚化,使信号传道受阻,其生物活性降低或丧失,进而阻碍骨髓红细胞系的形成。
CFU-E是一种比较成熟的红系祖细胞[8],是红细胞系的生成过程的重要标志。在本研究中,空白对照组无CFU-E集落形成,而常规组CFU-E形成良好,单个培养孔CFU-E集落数平均值达到151.8±23.3;而在EPO单克隆抗体干预组,当培养体系中加入EPO单克隆抗体后,每个培养孔CFU-E集落数平均值下降到10.7±3.9,说明该EPO单克隆抗体可以抑制CFU-E形成,即抑制红细胞系的形成。该EPO单克隆抗体有望用于HAPC的治疗。
单克隆抗体用于临床治疗已有成功的范例,根据不完全统计,到2010年全球已经上市的单克隆抗体至少有100多个[9]。该EPO单克隆抗体是使用杂交瘤细胞技术制备的抗体[3,5],具有性质均一稳定、特异性强的特点,可通过细胞株体外培养长期获得,应用前景广阔。但是其为鼠源性抗体,是一种异种蛋白,可能产生免疫应答,不能直接使用于人体。下一步将使用基因工程技术对其进行人源化改造,降低其抗原性,以期用于临床。
[1] 牟信兵,李素芝.高原病学[M].拉萨:西藏人民出版社,2001:257,327.
[2] 黄学文,李素芝,高钰琪,等.EPO多克隆抗体对抗EPO活性的研究[J].西南国防医药,2006,16(1):23.
[3] 李素芝,黄学文,黄跃,等.EPO单克隆抗体的制备[J].高原医学杂志,2010,20(1):12.
[4] 刘秀珍.造血干细胞培养技术[M].北京:北京人民出版社,1993:46.
[5] Lacombe C,Mayeux P.Bology of erythropoietin[J].Haematologica,1998,83:724.
[6] Reynfarje CJ,Ramos J.Humoral control of erythropoietic activity in man during and after altitude exposure[J].Proc Soc Exp Biol Med,1994,116:49-65.
[7] 何维,高晓明.医学免疫[M].北京:人民卫生出版社,2005:71.
[8] 陆再英,钟南山.内科学[M].北京:人民卫生出版社,2011:564.
[9] 朱保泉.生物制药技术[M].北京:化学工业出版社,2004:270.
Research on suppression of colony-forming unit-erythroid by EPO monoclonal antibody
Huang Xuewen,Li Suzhi,Huang Yue,Xie Xiaoe,Liu Houdong,Yan Chuncheng,Shi Quangui,Ding Haoping,He Feng,Chen You
Department of Mountain Sickness,General Hospital of Tibet Military Command,Lhasa,Tibet,850000,China
Objective To study whether EPO monoclonal antibody can inhibit the formation of colony-forming unit-erythroid(CFU-E).Methods Marrow samples collected from rats
oriented culture for CFU-E.According to the different culture conditions,the samples were divided into blank control group(without EPO),conventional group(with EPO,but without EPO monoclonal antibody),and intervention group with EPO monoclonal antibody(EPO+EPO monoclonal antibody).After the culturing for 168 hours,the levels of CFU-E in each group were observed.Results The average colony counts of CFU-E in the blank control group,conventional group,and EPO monoclonal antibody intervention group were 0.0±0.0,151.8±23.3,and 10.7±3.9,respectively.There were significant differences in the colony counts of C-FUE among the three groups(P<0.01).Conclusion EPO monoclonal antibody can significantly inhibit the formation of CFU-E and the erythron proliferation.It is a possible medicine for the treatment of high altitude polycythemia.
colony-forming unit-erythroid;erythropoietin;antibody;marrow;rat
拉萨市科技局资助合作项目(2004078)
850000 拉萨,西藏军区总医院高山病科
R 594.3
A
1004-0188(2014)01-0014-04
10.3969/j.issn.1004-0188.2014.01.006
2013-12-05)
