随访21-羟化酶缺乏症1例
2014-07-19齐璇
齐 璇
随访21-羟化酶缺乏症1例
齐 璇
21羟化酶缺乏症;青春发育期;先天性肾上腺皮质增生
21羟化酶缺乏症(21-hydroxylase deficiency, 21-OHD)在先天性肾上腺皮质增生中最为常见,其发病率约2万分之一[1],表现为生殖器发育畸形。笔者报道1例21-OHD治疗后妊娠并分娩的患者。
1 病例报告
患者,18岁,女,主因初潮后逐渐出现阴蒂肥大,全身多毛,声音低沉及月经色淡,量偏少,于2005-05-18入院,患者初潮16岁,平素月经不规则,行经(3~5)/(28~180)d,经量少,无血块,无痛经。患者既往史、家族史均无特殊,父母否认近亲结婚。入院后查体:身高为159 cm,外貌似男性,可见喉结(图1A),无明显胡须,体毛稍浓,肩宽,肌肉发达,乳房发育TannerⅠ级,心肺(-)。妇科检查:阴毛呈男性分布,阴蒂长4 cm, 直径2.5 cm,似阴茎,小阴唇不明显(图1B)。肛查:子宫偏小,双附件区未及异常。B超检查:子宫前位,宫体大小35 mm×30 mm×28 mm,宫颈长28 mm。子宫形态规则,肌层回声均匀,内膜线居中。右卵巢25 mm×20 mm×15 mm,左卵巢20 mm×18 mm×15 mm,提示子宫偏小,子宫及附件未见明显异常。双肾、输卵管、膀胱未见明显异常。外院查染色体核型为46XX,入院后查游离睾酮3.0 nmol/L(正常值<2.1 nmol/L),硫酸脱氢表雄酮8.9 μmol/L(2.1~8.8 μmol/L),雄烯二酮36.2 nmol/ml(4.0~6.6 nmol/ml),皮质醇194nmol/L(248~660 nmol/L),促肾上腺皮质激素(ACTH)155 pmol/L(2.2~17.6 pmol/L),血17-羟孕酮5112nmol/L(248~580 nmol/L),24 h尿17-羟孕酮21.8 μmol(5.5~22.1 μmol),24 h尿17-酮类固醇70.3 mol/d(21~52 μmol),FSH 4.2 U/L,LH 8.1 U/L。行地塞米松抑制试验,测ACTH、睾酮、血17-羟孕酮均正常。诊断:先天性肾上腺增生21羟化酶缺乏。完善各项术前常规检查无手术禁忌证,于2005-05-25,在连续硬膜外麻醉下行保留阴蒂头及其背侧皮神经的阴蒂部分切除术及阴唇融合切开整形术,手术顺利,术后恢复佳,阴蒂头血运好,伤口愈合好。术后服用地塞米松治疗,初始剂量为0.75 mg/d,根据患者血清17-羟孕酮下降及第二性征发育情况,以及内分泌情况调整服药剂量,逐渐减至0.25 mg,2/d 维持。术后3个月月经规律来潮,乳房逐渐发育。复查游离睾酮0.99 nmol/L,雄烯二酮5.5 nmol/ml,17-羟孕酮311 nmol/L,皮质醇303 nmol/L,ACTH 10.2 pmol/L。24岁结婚,婚后3个月自然受孕,孕期正常,孕39+2周于2011-08-22剖宫产分娩一个成熟女婴,重3100 g,发育正常。随访至今,女孩发育无异常。
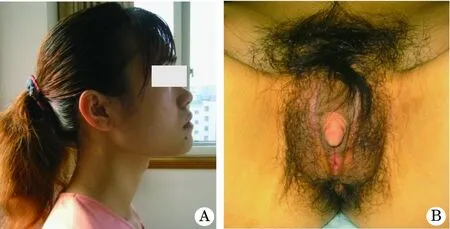
图1 21羟化酶缺乏症
2 讨 论
先天性肾上腺皮质增生(congenital adrenal hyperplasia,CAH)为常染色体隐性遗传性疾病,其中21-OHD最常见,占90%~95%[2]。病因为基因突变,21-羟化酶基因位于第6号染色体短臂上(6p21),是位于肾上腺皮质内质网的一种细胞色素P450 酶[3]。21-羟化酶缺乏,皮质醇合成减少,对下丘脑和垂体负反馈作用消失,导致垂体促肾上腺皮质激素分泌增加,刺激肾上腺增生,促进皮质醇分泌同时也刺激肾上腺网状带产生大量雄烯二酮和睾酮,致使女性胎儿外生殖器不同程度男性化。1865年Decrecodo首先报道本症以男性化和无排卵为特征[4],新生儿中的发病率为1∶5000~1∶15000,女婴内生殖器在胚胎第10周分化,外阴至胚胎17周时未完全发育,肾上腺皮质功能自胚胎12周后发育,所以21-OHD不影响女性内生殖器的发育。外阴男性化的程度取决于妊娠期间雄激素的水平及其开始升高的时间。高雄激素水平发生越早,畸形越严重。临床分为经典型和非经典型:经典型异常表现出现早,CAH女性胎儿出生后表现为一系列睾酮过多症状,外阴畸形伴低血压、失盐的表现,2~4 岁就出现阴毛、腋毛、体毛过多、胡须,痤疮,声音低沉,骨龄过早发育,患者童年身材硕长,成年后反而身材矮小,原发性闭经和不育[5]。非经典型异常表现出现较晚,往往要到青春期才有男性化表现,伴有月经紊乱和不孕等。文献[6]将外阴不同程度的男性化分为Ⅴ型:Ⅰ型,阴蒂稍大,阴道与尿道口正常;Ⅱ型,阴蒂较大,阴道口为漏斗形,但阴道与尿道口仍分开;Ⅲ型,阴蒂显著增大,阴道与尿道开口于一个共同的尿生殖窦;Ⅳ型,阴蒂显著增大似阴茎,阴茎基底部为尿生殖窦,类似尿道下裂,生殖隆起部分融合;Ⅴ型,阴蒂似男性阴茎,尿道口在阴茎头部,生殖隆起完全融合。通过染色体核型鉴定,实验室血雄激素、ACTH、17α-羟孕酮、皮质醇及尿17-酮等检测,可明确诊断。
本病根本治疗方法是长期使用糖皮质激素替代抑制治疗,且越早越好。1950年Wilkins就开始用氢化可的松治疗CAH,通过补充皮质醇,抑制ACTH的过量产生,使肾上腺雄激素水平降至正常。临床上首选氢化可的松片剂,也可用同等剂量的地塞米松等[8]。Speiser等[9]推荐对于生长发育阶段的21-OHD患者使用氢化可的松片剂,在新生儿期同时补充氟氢可的松和氯化钠。对于失盐型患者还需根据电解质情况补盐2~5 g/d。 对于成年患者,可选地塞米松终生服用。对于有性器官发育异常患者需手术治疗,包括保留阴蒂头及其背血管神经束的阴蒂成形术和外生殖器重建[10]。需充分利用阴蒂包皮和会阴皮瓣再造阴唇和阴道,保留阴蒂头部及其背侧皮神经,缩小增大的阴蒂,扩大融合的会阴,术中需保留性敏感器官阴蒂。生殖器的外观改善后,患者性交功能及性心理改善,配合糖皮质激素药物规范治疗后,患者的妊娠率和活产率明显改善。有报道21-OHD患者妊娠活产率8/12,单纯男性化型患者活产率为5/6[1]。本例患者手术后配合药物治疗,皮肤变得细嫩,乳房发育, 3个月后月经规律来潮并排卵,原来窄小的阴道及子宫均明显发育,性生活满意, 感觉良好。婚后自然受孕,剖宫产分娩。
对21-OPH患者只要及时诊断、早期系统规范治疗,在外观及生理上均可改善,且能恢复生育功能。此外,在及时诊断治疗的同时,临床医师要加强对患者的宣教及心理疏导,增强患者配合治疗的信心。鼓励并帮助患者结婚受孕,加强孕期指导可以获得满意的妊娠结局。
[1] 禹 虹,边旭明,刘俊涛,等. 21-羟化酶缺乏症合并妊娠八例临床分析[J].中华妇产科杂志, 2012, 47(9): 651-654.
[2] 宁 光,杨 军. 非经典型21-羟化酶缺陷症的诊治[J].中国实用内科杂志,2007,27( 23):1816.
[3] 余 莎,谢梅青,谢增霞.先天性肾上腺皮质增生症致女性假两性畸形7例分析[J].中山大学学报(医学科学版), 2008,29(s1): 122-124.
[4] 陈如钧,江 鱼.不孕不育治疗学[M].上海:上海科学技术出版社,2000: 18.
[5] Speroff L, Fritz M A.临床妇科内分泌学与不孕[M].2版. 李继俊,译.济南:山东科学技术出版社,2006:260-261
[6] 曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1999: 2257-2263.
[7] Miller W L. Molecular biology of steroid hormone synthesis[J]. Endocr Rev, 1988, 9(3): 295.
[8] Ross R J, Rostami-Hodjegan A. Timing and type of glucocorticoid replacement in adult congenital adrenal hyperplasia [J].Horm Res, 2005,64(Suppl 2): 67-70.
[9] Speiser P W,Azziz R,Baskin L S,etal. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an endocrine society clinical practice guideline [J].J Clin Endocrinol Metab,2010,95( 9):4133
[10] 朱选文,张峰彬,汪超军,等.先天性肾上腺皮质增生致女性假两性畸形的诊治:附4例报告[J].中华泌尿外科杂志,2004,25(7): 442-444.
(2013-09-08收稿 2013-11-25修回)
(责任编辑 武建虎)
齐 璇,本科学历,主任医师,E-mail:qxljy111@163.com
201103,武警上海总队医院妇产科
R725.8
