Ebselen预处理对大强度耐力训练大鼠骨骼肌结构和功能的保护及可能机制研究
2014-07-19刘军
刘 军
Ebselen预处理对大强度耐力训练大鼠骨骼肌结构和功能的保护及可能机制研究
刘 军1,2
目的:通过研究Ebselen在大强度耐力训练大鼠疲劳发生过程中对于骨骼肌活性氧和活性氮自由基的清除,细胞凋亡的调控等方面的作用机制,为Ebselen应用于抗疲劳领域提供实验依据。方法:雄性健康SD大鼠30只,跑台预适应淘汰不适应跑台运动者后,将剩余大鼠随机分为安静对照组(CG)、运动对照组(TG)和Ebselen预处理运动组(TEG),每组8只。Ebselen预处理运动组灌服Ebselen+DMSO生理盐水溶液,安静对照组和运动对照组灌服等量DMSO生理盐水。8周大强度耐力跑台运动训练后,分别检测大鼠股四头肌内源性抗氧化酶SOD、GSH-Px,活性氮自由基、凋亡调控蛋白Bcl-2、Bax等指标,TUNEL检测细胞凋亡,透射电子显微镜观察骨骼肌超微结构。结果:大强度耐力训练后大鼠骨骼肌内源性抗氧化酶SOD、GSH-Px活性下降(P<0.05),总抗氧化能力TAOC下降,自由基代谢产物MDA水平升高(P<0.01);活性氮自由基NO及NOS含量升高;Bax/Bcl-2下降(P<0.01),凋亡指数AI升高(P<0.01),骨骼肌超微结构完整性明显受损;相比运动对照组,Ebselen预处理后,运动大鼠骨骼肌SOD、GSH-Px活性升高(P<0.05),TAOC升高,MDA及NO水平下降(P<0.05),Bax /Bcl-2上升,凋亡指数AI降低(P<0.01),骨骼肌超微结构得到明显保护。结论:Ebselen可以发挥拟似GSH-Px活性,提高骨骼肌内源性抗氧化酶活性,加快运动中活性氧与活性氮自由基降解,降低脂质过氧化产物生成,抑制抗凋亡蛋白Bcl-2的下调,发挥抗细胞凋亡作用,延长大鼠跑台运动至力竭的时间,有效保护骨骼肌结构的完整性。
Ebselen;大强度耐力训练;骨骼肌;内源性抗氧化酶;细胞凋亡;鼠;动物实验
运动疲劳是运动医学研究的经典领域,最早始于1880年,莫索(Mosso)以骨骼肌为研究对象开创疲劳研究[26]。来自大脑的神经信号使肌肉收缩产生张力,作用于骨骼并使其围绕关节发生运动,完成运动指令。后来,学界将疲劳按发生的部位分为中枢疲劳和外周疲劳,有研究者将中枢神经系统对运动神经元的有效募集失败归为中枢疲劳[38],而发生在神经肌肉接头处或者骨骼肌本身的影响肌肉做功的因素则归为外周疲劳。所以,运动中保持骨骼肌结构和功能的完整性对运动能力的影响至关重要。
有研究表明[3,7],过量运动可引起骨骼肌线粒体Ca2+增加,自由基产生增多并诱发骨骼肌细胞凋亡,进而影响运动能力。Ebselen又称PZ51,化学名称2-phenyl-1,2-benzisoselenazol-3[2H]- one,是一种脂溶性的小分子有机硒化合物,在体内能够模拟谷胱甘肽过氧化物酶(GSH-Px)的活性,具有抗炎、抗氧化和防止缺血与氧应激导致的细胞凋亡等功能[1,16,29],由此开展的相关研究包括其对神经细胞氧化损伤的保护[31],如临床研究显示,Ebselen早期干预可以有效改善急性脑缺血、中风[45]和阿尔茨海默病等神经退行性疾病[43]的预后,还可通过抗氧化阻止酒精导致的早期肝损伤发生[22]。近期也有研究表明,Ebselen对骨骼肌软组织损伤后的微循环重建有良好疗效,可以通过降低炎症细胞反应而防止骨骼肌免受白细胞依赖的继发性炎症组织损伤,改善骨骼肌效能[19]。以上研究提示,Ebselen可能能够通过清除自由基、抑制细胞凋亡等功能而对运动导致的骨骼肌损伤产生保护作用。本研究以大鼠为研究对象,建立大强度耐力训练疲劳模型,同时服用Ebselen,观察对大强度耐力训练大鼠骨骼肌超微结构、细胞内源性抗氧化物(native antioxidants,AOX)、对活性氧(reactive oxygen species, ROS) 及活性氮(Reactive nitrogen species,RNS)自由基的清除能力、细胞凋亡及其调控蛋白的影响,为寻找更多的抗疲劳药物,使Ebselen应用于延缓运动疲劳领域提供实验依据。
1 材料与方法
1.1 实验动物及跑台运动疲劳模型的建立
雄性健康Sprague-Dawley(SD)大鼠30只,体质量180~220 g,动物购自陕西中医研究所实验动物中心。自由饮食,分笼饲养备用。动物适应性饲养3天后,进行为期3天的运动筛选,运动负荷为15 m/min,5 min/天。淘汰不能适应跑台训练的大鼠。剩余大鼠随机分为安静对照组(CG)、运动对照组(TG)和Ebselen预处理运动组(TEG),每组8只。跑台运动时,当大鼠臀部压在笼具后壁,跟不上预定速度并随转动皮带后拖30 s、经毛刷刺激驱赶仍然不能运动时界定为疲劳状态[5]。训练前,先以15 m/min的速度适应5 min,训练方案基于Bedford等模型[8,11]修改,为期8周,每周训练5天,周末休息。实验方案如下:第1周速度为15 m/min,运动时间为20 min/天;第2周速度为20 m/min,运动时间20 min/天;第3周速度为25 m/min,运动时间为20 min/天;第4周速度为25 m/min,运动时间为30 min/天;第5周速度为30 m/min,运动时间为30 min/天;第6周速度为30 m/min,运动时间为40 min/天;第7周速度为35 m/min,运动时间为40 min/天;第8周速度为35 m/min,运动时间为40 min/天。第8周最后1天使动物跑台运动至力竭,记录力竭运动时间后麻醉取材。
1.2 Ebselen及补充方法
Ebselen购自成都兢鹏生化科技有限公司,纯度大于98%。将药物溶于5%的DMSO(sigma)生理盐水溶液中[2],对Ebselen预处理运动组大鼠在跑前30 min实施灌胃,根据文献将有效剂量确定为50 mg/kg/天[6,14],另外,2组灌服等量的DMSO生理盐水作为对照,灌胃量均为1 mL/100 g体质量[2]。
1.3 实验动物取材及样品处理方法
实验动物完成运动疲劳建模最后1天,将大鼠称重后乙醚麻醉,断头处死,迅速剥离股四头肌,切取2 mm×2 mm×2 mm的组织块,立即置于2.5%戊二醛固定液中4℃固定用于透射电子显微镜观测;切取部分组织于4%的中性甲醛溶液中固定以备免疫组织化学检测。其余组织制备组织匀浆,离心后分离出上清液-20℃冰箱保存备用。
1.4 测试指标及方法
1.4.1 自由基及抗氧化指标测试
称取0.2~1 g骨骼肌,按比例加入0.86%冷生理盐水,重量体积比为1∶9,将组织块用眼科剪刀剪碎,手工研磨制备匀浆液,低温离心(3 000转/min,15 min)后吸取上清液-20 ℃保存备用。
丙二醛(MDA)、总抗氧化能力(TAOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮合酶(NOS)、诱导性一氧化氮合酶(iNOS)、一氧化氮(NO)测试均采用南京建成生物工程研究所提供的试剂盒,蛋白定量采用双缩脲法。
1.4.2 骨骼肌细胞凋亡的检测
1.切片制备与免疫组织化学染色
Bcl-2、Bax蛋白表达检测采用武汉博士德生物工程有限公司提供的试剂盒。标本经固定、石腊包埋、连续切片、贴片。切片脱腊至水后经抗原修复,封闭,一抗、二抗孵育等过程。染色采用SABC法,DAB显色。每次染色时用PBS取代一抗成阴性对照一张。封片,显微镜观察后扫描灰度值。
2.原位缺口末端标记法(TUNEL)检测骨骼肌凋亡细胞
骨骼肌标本经固定后包埋。TUNEL检测试剂盒购自武汉博士德生物工程有限公司。严格按照实验流程操作,DAB显色后在显微镜下观察阳性细胞个数。当细胞核中有棕黄色颗粒时视为阳性细胞。每张切片在高倍镜下随机选取5个视野,对阳性细胞进行计数。选取凋亡指数反应骨骼肌细胞的凋亡情况。凋亡指数(AI)具体计算方法为视野内凋亡骨骼肌细胞数/视野内所有细胞数×100%。
1.4.3 透射电子显微镜的观测
骨骼肌样品经固定、包埋、定位(光学显微镜下),切片(50~70 nm)、染色(1%醋酸铀2 h,柠檬酸铅)、拍照观察(日本日立 H-600透射电子显微镜)。
1.5 图像分析与统计学处理
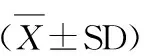
2 实验结果
2.1 Ebselen预处理对大强度耐力训练大鼠骨骼肌AOX和RNS的影响
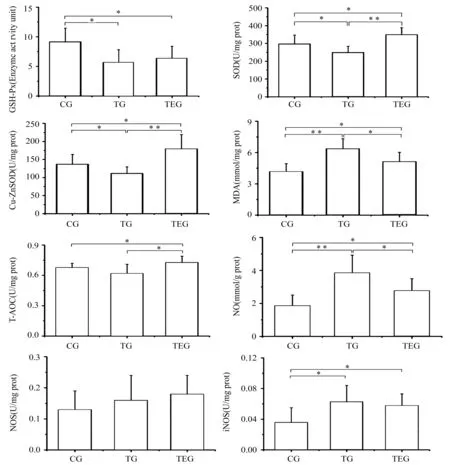
图 1 本研究Ebselen预处理对大鼠骨骼肌AOX和RNS的影响示意图Figure 1. Effects of Ebselen Pretreatment on the AOX and RNS of Skeletal Muscle in Rats
注: *表示P<0.05,**表示P<0.01(下同)。
由图1可知,相比CG,TG股四头肌内抗氧化酶GSH-Px、SOD、Cu-ZnSOD等活性均显著下降,自由基代谢产物MDA含量显著升高,总抗氧化能力下降但不具有显著性差异,NOS升高(P>0.05),iNOS显著升高,NO含量显著升高;相比TG,TEG GSH-Px、SOD、Cu-ZnSOD等酶活性均有显著性改变,但GSH-Px仍未达到安静时水平;MDA含量显著下降且仍然高于安静时水平;总抗氧化能力有所回升,且高于CG水平,差异具有显著性,NOS仍然升高,iNOS有下降但不具显著性差异,NO含量下降但仍然显著高于CG。
2.2 Ebselen预处理对大强度耐力训练大鼠骨骼肌细胞凋亡及调控蛋白的影响
由图2可知,大强度耐力训练导致大鼠骨骼肌细胞Bcl-2的灰度值显著升高(P<0.05),Bax显著性下降(P<0.01),Bax /Bcl-2显著下降(P<0.01);AI显著升高(P<0.01);相比TG,TEG Bcl-2灰度值显著下降(P<0.01),Bax显著升高(P<0.01),Bax /Bcl-2显著升高(P<0.01);AI显著升高(P<0.01)。
图 2 本研究Ebselen预处理对大鼠骨骼肌细胞凋亡及调控蛋白的影响示意图Figure 2. Effects of Ebselen Pretreatment on the Apoptosis and Regulatory Protein of Skeletal Muscle in Rats
2.3 Ebselen预处理对跑台训练大鼠力竭时间的影响
由图3可知, Ebselen预处理显著延长了大鼠跑台运动至力竭的时间(P<0.05),相比TG,提高了26.98%。
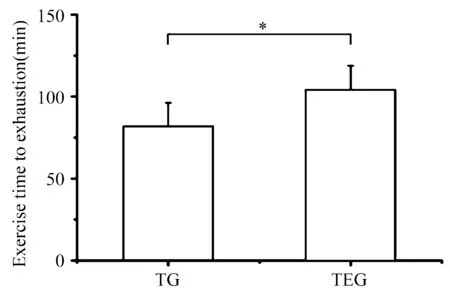
图 3 本研究Ebselen预处理对大鼠跑台运动至力竭时间的影响示意图Figure 3. Effects of Ebselen Pretreatmenton Exercise Time to Exhaustion of Rats
2.4 骨骼肌的透射电镜观察
Ebselen预处理对大鼠骨骼肌超微结构的影响如图4所示。
3 分析与讨论
3.1 Ebselen对大强度耐力训练大鼠骨骼肌ROS与AOX的影响

图 4 本研究Ebselen预处理对大鼠骨骼肌超微结构的影响示意图Figure 4. Effects of Ebselen Pretreatmenton Skeletal Muscle Ultrastructure in Rats
注:线粒体(Mitochondrion,Mi); 内质网(Endoplasmic Reticulum,ER); 糖原颗粒(Glycogen,Gn); 细胞核(Nuclear,N)。
研究人类运动促进氧应激的报道出现至少已经超过30年,ROS在肌肉疲劳发展中的角色一直受人关注。肌肉疲劳是一种运动导致的产生最大肌肉力量的能力降低的生理现象[17]。在肌肉处于静息状态时活性氧产生率较低,而在收缩状态时产生较高[27]。肌肉中ROS的产生与热应激、缺血再灌注损伤、肌肉刺激等因素有关。运动时高水平ROS产生可以损害细胞成份[33]。ROS的主要形式过氧化氢和过氧化物在很多生物进程中都扮演重要角色,有研究显示,运动期间自由基和ROS产物的大部分是由骨骼肌产生[31],研究其可能来自于从呼吸链到氧的单电子泄露,在呼吸过程中,很多氧在氧化磷酸化期间通过生成水的方式降解,但仍然有一小部分(约0.15%)的氧可以生成超氧化物和过氧化氢的形式降解[49]。
研究显示,黄嘌呤氧化酶和NADPH氧化酶在骨骼肌重复性收缩和力竭运动中具有重要作用。来自于黄嘌呤氧化酶的ROS生成与严重的压力应激如力竭运动关系更为密切[42]。在肌肉收缩时,ROS产生和抗氧化剂的活性能够影响肌肉力量的产生。因为氧化应激导致ROS和AOX水平之间的失衡,尤其当ROS生成过多,不再能被AOX很好地缓冲,这可能降低肌肉的收缩功能,更大强度地刺激或不能恢复的疲劳运动方案会引起肌肉收缩减弱,导致ROS生成的显著性增加,使得AOX在疲劳发展过程中起到显著性作用。细胞内AOX主要包括SOD、CAT、GSH和硫氧还蛋白氧化还原系统等[30]。通过清除过多的ROS,细胞内这些抗氧化剂修饰细胞氧化还原状态和氧化还原敏感的代谢过程,降低肌肉损伤,在代谢失衡的情况下保护最大能源供给,因为上述这些被纠正的因素在疲劳情况下都可能发生[13]。
本研究中,大强度跑台耐力训练后疲劳大鼠的自由基代谢产物MDA生成增加,SOD、GSH-Px等AOX抗氧化酶显著降低,表明这些酶参与了疲劳发生过程中自由基的清除。Cu-ZnSOD是SOD的一种亚型,是SOD的主要存在形式,在胞液中催化由线粒体电子转移链、肌浆网NADPH氧化酶系统和磷脂酶A2(PLA2)依赖的进程中等产生的超氧阴离子[17]。本实验中,该酶也显著减少,而总抗氧化能力降低。在服用Ebselen干预后,上述各项指标均发生比较好的改变,体内主要的AOX酶如SOD和GSH-Px均显著增加,这可能与Ebselen可以模拟胞内内源性抗氧化剂,协助GSH去清除H2O2等有关。Li Zuo[48]等在非洲爪蟾蜍分离出来的完整肌纤维中,在肌肉强直收缩时实时测得ROS,并且观察到相比静息状态,收缩活动会诱导ROS产生显著增加,而ebselen处理可以降低ROS的产生,这与本实验研究结果部分一致。
此外,研究发现,Ebselen还是一种硫氧还蛋白还原酶(TrxR)的优良底物,能够降低Trx的一种高效氧化剂,可以催化H2O2还原[46]。在较低浓度时,它还可抑制一系列与炎症相关的酶,包括脂氧合酶、NOS、NADPH氧化酶、PKC、H+/K+-ATP酶等从而发挥作用,它还可以通过TRX过氧化物酶抑制细胞内非酶和酶的脂质过氧化[37]。
3.2 Ebselen对大强度耐力训练大鼠骨骼肌RNS的影响
在运动中,骨骼肌除产生活性氧自由基外还有RNS自由基,后者主要来源于NO。NO既可以在一些重要的细胞进程中作为信号分子,又是体内RNS的主要来源[41]。在骨骼肌收缩等生理功用中扮演重要角色,它由NOS合成,NOS有3种亚型,分别是神经型(nNOS)、内皮型(eNOS) 和诱导型NOS(iNOS),在骨骼肌中均有表达,但炎症时更多表达的为iNOS[40]。NOS亚型的活性则主要受胞内Ca2+浓度调节[47]。与ROS的损害在动物肌肉疲劳中的直接作用相比,NO的产生直接导致疲劳的发展方面的证据仍然有限。理论上,NO作用于肌肉中的效应蛋白如收缩和钙调控蛋白而产生力量,因此,似乎能够促使肌肉疲劳,然而,文献并不支持NO直接导致肌肉疲劳[28]。NO和超氧阴离子的反应生成过氧亚硝酸盐,后者正是NO产生毒效应的作用途径之一。过氧亚硝酸基是一个强力的硝化和氧化剂,它可以导致胞内损伤和细胞死亡,因其可引起巯基、脂质过氧化物的氧化和蛋白质酪氨酸残基的硝化而形成硝基酪氨酸。RNS也影响肌肉兴奋——收缩耦联功能,后者是近年来研究中一致认为在骨骼肌疲劳中收缩能力下降的因素之一。RNS还作用于肌浆网阿诺碱受体(Ryanodine receptors,RyR),调节胞内Ca2+释放,通过cGMP依赖的信号通路影响骨骼肌收缩能力[15]。
大强度运动训练时,骨骼肌处于相对缺氧状态,组织相对缺氧可能损害胞内钙稳态,从而通过NOS增加NO的产生。这与本研究结果一致:运动组大鼠相比安静组NO显著升高,NOS相应也升高。在药物干预后,运动大鼠的这一趋势则明显受到抑制。有文献证实,低氧可以增加心肌细胞活性氧的产生,而抗氧化剂能够改善收缩能力[20]。也有文献证实,在缺氧时抑制NOS可以改善大鼠膈肌收缩能力[10],而Ebselen进入胞内,可以通过模拟GSH-Px活性,催化过氧硝酸盐降解;或者可以催化H2O2的降解,从而被认为间接清除超氧阴离子,完成对过氧硝酸盐和NO的清除。
3.3 Ebselen对大强度耐力训练大鼠骨骼肌细胞凋亡及调控蛋白Bcl-2、Bax蛋白表达的影响
由细胞内ROS/RNS的过度产生或者/和胞内抗氧化防御能力的下降所产生的刺激,都可能导致细胞凋亡[25]。Bcl-2家族是体内调节细胞凋亡的一组蛋白,根据其结构和功能可以分为2个亚群,抗凋亡成员如Bcl-2,促凋亡成员如 Bax等。其家族成员之间能形成二聚体/多聚体从而调节细胞的存活与凋亡。如果Bcl-2表达的水平高于Bax,那么,细胞可以存活,反之则死亡。
有研究显示,运动后骨骼肌发生细胞凋亡或者产生有益的抗凋亡作用,与运动强度、运动持续时间、运动后的恢复状态等相关[4,39]。细胞凋亡引起骨骼肌细胞的微细结构损伤,使肌肉收缩能力和损伤后恢复能力下降[23]。本研究显示,大强度耐力训练后,运动对照组大鼠骨骼肌Bcl-2表达显著下降(灰度值升高),而Bax表达显著升高;运动同时服用Ebselen后则有效逆转这种趋势。
Ebselen作为治疗药物保护由过氧化物释放、获得性免疫缺陷综合症、辐射暴露和其他病理条件下细胞免受凋亡之困方面的研究由来已久[34]。近来研究又提示,Ebselen在对抗嗜铬细胞瘤细胞(PC12)中NO诱导的细胞凋亡[36]、神经细胞凋亡[44]等均有良好效果,其机制可能与Ebselen抑制了NO诱导的磷脂酰丝氨酸的暴露,细胞色素氧化酶C的释放和Caspase-3的激活等有关。此外,也有可能与Ebselen阻碍了凋亡信号调节激酶1(Apoptosis signal-regulating kinase 1,ASK1)的激活,抑制P38丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)和c-Jun 氨基末端蛋白激酶(JNK)的磷酸化有关。还可能与其激活P44/42MAPK,抑制抗凋亡蛋白Bcl-2的下调有关[44]。
3.4 Ebselen对大强度耐力训练大鼠骨骼肌超微结构及跑台运动能力的影响
本研究提示,在结构上,Ebselen预处理后明显保护了大强度耐力训练大鼠骨骼肌细胞结构的完整性,肌纤维排列整齐,没有染色质凝集、核碎裂等出现,凋亡细胞数量明显减少;功能上,有效延缓了疲劳的发生,使大鼠跑台运动至力竭时间延长了近1/4。机制除上述研究中提到的清除ROS、RNS和抑制抗凋亡蛋白Bcl-2的下降等之外,还可能与Ebselen可产生具有催化活性的硒醇而摸拟GPx活性[9,12],清除H2O2防止AMPK的过度激活[21],进而影响骨骼肌中葡萄糖的转运能力[35],降低血管内血栓形成和P选择素在血小板上表达从而防止缺血再灌注损伤[24],还可以在肌肉损伤后让白细胞和血小板隔离,降低炎症反应[18]。
4 结论
1.Ebselen可以有效保护大强度耐力训练大鼠骨骼肌的结构和功能的完整性,显著提高大强度耐力训练大鼠跑台运动至疲劳的时间。
2.这种保护机制可能是其发挥拟似GSH-Px活性,提高细胞抗氧化能力,加快运动中活性氧和活性氮自由基的降解,防止细胞过分暴露而受氧自由基、NO及其衍生物的毒害,抑制抗凋亡蛋白Bcl-2的下调,降低脂质过氧化产物的生成,进而通过凋亡调控蛋白Bax/Bcl-2而发挥抗细胞凋亡作用,有效保护骨骼肌结构和功能的完整。
[1]刘军,熊正英,刘小杰.Ebselen的药理作用及其在运动医学领域的应用[J].北京体育大学学报,2007,30(9):1237-1239.
[2]荣琳,邵丽华,郗德凤,等.依布硒啉对肝性脑病大鼠的保护作用[J].山东大学学报(医学版),2010,48(5):154-156.
[3]时庆德,张勇,文立,等.运动性疲劳的线粒体膜分子机制研究:运动性氧自由基代谢途径再探讨[J].中国运动医学杂志,2000,19(1):43-45.
[4]宋卫红,汤长发,刘文锋.离心运动对大鼠骨骼肌细胞凋亡和增殖的影响[J].中国应用生理学杂志,2013,29(1):86-90.
[5]肖明珠,郭庆芳.动物运动性疲劳方法学研究之一 ——不同刺激方法对大鼠跑台运动疲劳及恢复糖代谢的影响[J].中国运动医学杂志,1998,17(4):334-338.
[6]解砚英,徐淑兰,王芃,等.依布硒啉(Ebselen)的抗炎作用[J].山东医药工业,1999,18(3):46-47.
[7]周婕,汤长发,李善妮,等.不同强度运动对大鼠骨骼肌细胞凋亡的影响[J].体育科学,2005,25(5):55-58.
[8]徐晓阳,张爱芳,武桂新,等.扶正理气中药对大强度耐力训练大鼠糖代谢某些指标的影响[J].中国运动医学杂志,1998,17(3):220-224.
[9]ANTONY S,BAYSE C A.Modeling the mechanism of the glutathione peroxidase mimic ebselen[J].Inorg Chem,2011,50(23):12075-12084.
[10]BECKMAN J S,KOPPENOL W H.Nitric oxide,superoxide,and peroxynitrite:the good,the bad,and ugly[J].Am J Phys,1996,271(5):C1424-1437.
[11]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Phys,1979,47(6):1278-1283.
[12]BHABAK K P,MUGESH G.Synthesis,characterization,and antioxidant activity of some ebselen analogues[J].Chemistry,2007,13(16):4594-4601.
[13]CLANTON T L,ZUO L,KLAWITTER P.Oxidants and skeletal muscle function:physiologic and pathophysiologic implications[J].Proc Soc Exp Biol Med,1999,222(3):253-262.
[14]DAWSON D A,MASAYASU H,GRAHAM D I,etal.The neuroprotective efficacy of ebselen (a glutathione peroxidase mimic) on brain damage induced by transient focal cerebral ischaemia in the rat[J].Neurosci Lett,1995,185(1):65-69.
[15]EU J P,XU L,STAMLER J S,etal.Regulation of ryanodine receptors by reactive nitrogen species[J].Bio Pharmacol,1999,57(10):1079-1084.
[16]FUJISAWA S,KADOMA Y.Kinetic studies of the radical-scavenging activity of ebselen,a seleno-organic compound[J].Anticancer Res,2005,25(6B):3989-3894.
[17]GANDEVIA S C.Spinal and supraspinal factors in human muscle fatigue[J].Physiol Rev,2001,81(4):1725-1789.
[18]GIERER P,MITTLMEIER T,BORDEL R,etal.Selective cyclooxygenase-2 inhibition reverses microcirculatory and inflammatory sequelae of closed soft-tissue trauma in an animal model[J].J Bone Joint Surg Am,2005,87(1):153-160.
[19]GIERER P,RÖTHER J,MITTLMEIER T,etal.Ebselen reduces inflammation and microvascular perfusion failure after blunt skeletal muscle injury of the rat[J].J Trauma,2010,68(4):853-858.
[20]HEUNKS L M,MACHIELS HA,DE ABREU R,etal.Free radicals in hypoxic rat diaphragm contractility:no role for xanthine oxidase[J].Am J Phy Lung Cell Mol Phy,2001,281(6):L1402-1412.
[21]JESSEN N,GOODYEAR L J.Contraction signaling to glucose transport in skeletal muscle[J].J Appl Phys,2005,99(1):330-337.
[22]KONO H,ARTEEL GE,RUSYN I,etal.Ebselen prevents early alcohol-induced liver injury in rats[J].Free Radic Biol Med,2001,30(4):403-411.
[23]LIM J H,KIM D Y,BANG M S.Effects of exercise and steroid on skeletal muscle apoptosis in the mdx mouse[J].Muscle Nerve,2004,30(4):456-462.
[24]LINDENBLATT N,SCHARECK W,BELUSA L,etal.Anti-oxidant ebselen delays microvascular thrombus formation in the rat cremaster muscle by inhibiting platelet P-selectin expression[J].Thromb Haemost,2003,90(5):882-892.
[25]MARZETTI E,LEEUWENBURGH C.Skeletal muscle apoptosis,sarcopenia and frailty at old age[J].Exp Gerontol,2006,41(12):1234-1238.
[26]MOSSO A.Fatigue[M].New York:General Books,2012.
[27]MURRANT C L,REID M B.Detection of reactive oxygen and reactive nitrogen species in skeletal muscle[J].Microsc Res Tech,2001,55(4):236-248.
[28]OTTENHEIJM C A,HEUNKS L M,GERAEDTS M C,etal.Hypoxia-induced skeletal muscle fiber dysfunction:role for reactive nitrogen species[J].Am J Phy Lung Cell Mol Physiol,2006,290(1):L127-35.
[29]PARNHAM M J,SIES H.The early research and development of ebselen[J].Bio Pharmacol,2013,86(9):1248-1253.
[30]PETERNELJ T T,COOMBES J S.Antioxidant supplementation during exercise training:beneficial or detrimental[J].Sports Med,2011,41(12):1043-1069.
[32]POWERS S K,JACKSON M J.Exercise-induced oxidative str-ess:cellular mechanisms and impact on muscle force production[J].Phy Rev,2008,88(4):1243-1276.
[33]POWERS S K,NELSON W B,HUDSON M B.Exercise-induced oxidative stress in humans:cause and consequences[J].Free Radic Biol Med,2011,51(5):942-950.
[34]RAMAKRISHNAN N,KALINICH J F,MCCLAIN D E.Ebselen inhibition of apoptosis by reduction of peroxides[J].Bio Pharmacol,1996,51(11):1443-1451.
[35]SANDSTRÖM M E,ZHANG S J,BRUTON J,etal.Role of reactive oxygen species in contraction-mediated glucose transport in mouse skeletal muscle[J].J Phy,2006,575(Pt 1):251-262.
[36]SARKER K P,BISWAS K K,ROSALES J L,etal.Ebselen inhibits NO-induced apoptosis of differentiated PC12 cells via inhibition of ASK1-p38 MAPK-p53 and JNK signaling and activation of p44/42 MAPK and Bcl-2[J].J Neurochem,2003,87(6):1345-1353.
[37]SAKURAI T,KANAYAMA M,SHIBATA T,etal.Ebselen,a seleno-organic antioxidant,as an electrophile[J].Chem Res Toxicol,2006,19(9):1196-1204.
[38]SECHER N H,QUISTORFF B,DALSGAARD M K.The muscles work,but the brain gets tired [J].Ugeskr Laeger,2006,168(51):4503-4506.
[39]SIU P M,BRYNER R W,MARTYN J K,etal.Apoptotic adaptations from exercise training in skeletal and cardiac muscles[J].FASEB J,2004,18(10):1150-1152.
[40]STAMLER JS,MEISSNER G.Physiology of nitric oxide in skeletal muscle[J].Phy Rev,2001 81(1):209-237.
[41]TENGAN CH,RODRIGUES GS,GODINHO RO.Nitric oxide in skeletal muscle:role on mitochondrial biogenesis and function[J].Int J Mol Sci,2012,13(12):17160-17184.
[42]VINA J,GIMENO A,SASTRE J,etal.Mechanism of free radical production in exhaustive exercise in humans and rats;role of xanthine oxidase and protection by allopurinol[J].IUBMB Life,2000,49(6):539-544.
[43]XIE L,ZHENG W,XIN N,etal.Ebselen inhibits iron-induced tau phosphorylation by attenuating DMT1 up-regulation and cellular iron uptake[J].Neurochem Int,2012,61(3):334-340.
[44]XU JH,HU HT,LIU Y,etal.Neuroprotective effects of ebselen are associated with the regulation of Bcl-2 and Bax proteins in cultured mouse cortical neurons[J].Neurosci Lett,2006,399(3):210-214.
[45]YAMAGATA K,ICHINOSE S,MIYASHITA A,etal.Protective effects of ebselen,a seleno-organic antioxidant on neurodegeneration induced by hypoxia and reperfusion in stroke-prone spontaneously hypertensive rat[J].Neurosci,153(2):428-435.
[46]ZHAO R,HOLMGREN A.A novel antioxidant mechanism of ebselen involving ebselen diselenide,a substrate of mammalian thioredoxin and thioredoxin reductase[J].J Bio Chem,2002,277(42):39456-39462.
[47]ZHU X,HEUNKS L M,VERSTEEG E M,etal.Hypoxia-induced dysfunction of rat diaphragm:role of peroxynitrite[J].Am J Phy Lung Cell Mol Phy,2005,288(1):L16-26.
[48]ZUO L,NOGUEIRA L,HOGAN M C.Reactive oxygen species formation during tetanic contractions in single isolated Xenopus myofibers[J].J Appl Phy,2011,111(3):898-904.
[49]ZUO L,PASNICIUC S,WRIGHT V P,etal.Sources for superoxide release:lessons from blockade of electron transport,NADPH oxidase,and anion channels in diaphragm[J].Antiox Redox Signal,2003,5(5):667-675.
ProtectiveEffectsandPossibleMechanismofEbselenPretreatmentontheRatSkeletalMuscleStructureandFunctioninHighIntensityEnduranceTraining
LIU Jun1,2
Objective:Through analyzing the functional mechanism of ebselen in scavenging skeletal muscular reactive oxygen and reactive nitrogen and in regulating cell apoptosis during the process of fatigue in high-intensity endurance training,the research can provide experimental basis for ebselen to applied into the field of anti-fatigue.Methods:Thirty healthy male SD rats were randomly divided into the control group,exercise group and ebselen pretreatment exercise group after eliminate inadaptation treadmill exercise rats (n=8).Ebselen pretreatment add exercise group was gaster-poured by ebselen dissolved in 5% physiological saline solution with DMSO (50 mg/kg/d),and the rest group were poured with the same amount of placebo only.After intensive endurance training on the treadmill for 8 weeks,In situ DNA nick-end labeling (TUNEL) was used to detect apoptotic changes as an indicator of apoptosis.SOD,Cu/Zn-SOD,GSH-Px,MDA,TAOC,NO,NOS,iNOS express levels were determined by kits.Bcl-2 and Bax protein levels were estimated by immunohistochemistry.And skeletal muscle ultrastructure were illustrated with Transmission Electron Microscopy.Results:After intensive endurance training,the activity of endogenous antioxidant enzymes SOD,GSH-Px in the rat skeletal muscle decreased (P<0.05),total antioxidant capacity TAOC decreased,the level of MDA increased (P<0.01);the content of NO and NOS was elevated and Bax/Bcl-2 decreased (P<0.01),apoptosis index AI increased (P<0.01),the integrity of skeletal muscle ultrastructure was damaged significantly;Compared to the control exercise group,Ebselen pretreatment can increase the skeletal muscle SOD,GSH-Px activtiy,TAOC (P<0.05) and Bax/Bcl-2 (P<0.01),decrease the level of MDA,NO and AI (P<0.01),the ultrastructure of skeletal muscle
obvious protection.Conclusion:These findings may suggest that ebselen can protect the skeletal integrity of structure effectively,prolong the time that rat run on the treadmill until exhausted.The reason may be associated with that Ebselen can mimic activity of glutathione peroxidase,increase endogenous antioxidant enzyme activity in skeletal muscle,accelerate the degradation of reactive oxygen and reactive nitrogen species in the exercise,reduce the production of lipid peroxidation,inhibit the down-regulation of anti-apoptosis protein Bcl-2.
ebselen;highintensityendurancetraining;skeletalmuscle;nativeantioxidants;apoptosis;rat;animalexperiment
1000-677X(2014)07-0091-07
2013-11-08;
:2014-04-17
陕西省自然科学基金资助项目(2012JM4014)。
刘军(1980-),男,甘肃民勤人,在读博士研究生,主要研究方向为运动疲劳的机制与调控,Tel:(029)88409449;E-mail:liujun_0215@hotmail.com。
1.西安体育学院 健康科学系,陕西 西安 710068;2.北京师范大学 体育与运动学院,北京 100875 1.Xi’an Physical Education University,Xi’an 710068,China;2.Beijing Normal University,Beijing 100875,China.
G804.7
:A
