豆渣DNA及其酶解物的体内抗氧化作用
2014-07-18董和亮柴菜建邵美丽
董和亮,柴菜建,邵美丽,*
(1.黑龙江省垦区质量技术监督检验检测中心,黑龙江哈尔滨150090;2.东北农业大学食品学院,黑龙江哈尔滨150030)
豆渣DNA及其酶解物的体内抗氧化作用
董和亮1,柴菜建2,邵美丽2,*
(1.黑龙江省垦区质量技术监督检验检测中心,黑龙江哈尔滨150090;2.东北农业大学食品学院,黑龙江哈尔滨150030)
研究豆渣DNA及其酶解物对正常小鼠的体内抗氧化作用。将80只昆明小鼠随机分为8组,每天分别灌胃VE(30mg/kg)、生理盐水(NS)、不同剂量的DNA(30、60、120mg/kg)及DNA酶解物(30、60、120mg/kg)。30天后,取血、肝脏和脑,测定其中SOD、CAT、GSH-Px的活性及MDA含量。试验结果表明豆渣DNA及其酶解物均可以提高正常小鼠血清、肝脏和脑中SOD、CAT及GSH-Px活性,降低MDA含量,尤以DNA酶解物组效果为佳。此说明豆渣DNA及其酶解物均具有一定的抗氧化能力,且豆渣DNA酶解物的抗氧化能力强于豆渣DNA。
豆渣;DNA;酶解物;抗氧化
核酸(DNA和RNA)是构成生物细胞最重要的物质基础[1],它与人类生命的延续、疾病的预防与治疗、生物细胞的衰老、蛋白质的合成等有着密切的联系[2],在国外医学营养学中已将核酸列为第七种必需营养素[3]。近几年,DNA的抗氧化功能已成为国内外的研究热点[4-6]。刘润芝等[7]研究发现,鲤鱼精巢DNA对机体自由基有明显的清除作用;唐孝礼[8]研究发现鲤鱼精巢DNA可以明显提高自然衰老小鼠体内的抗氧化酶活性;Ames等[9]研究证明核酸及其衍生物可作为内源性自由基清除剂和抗氧化剂。食用性DNA主要从海产品和花粉等核酸含量较高的材料中获得[10],资源有限。有研究表明,豆渣中含有1%左右的核酸,是一种十分理想的核酸源[11],且国内外对于植物性DNA的抗氧化功效研究甚少[12-13],更未有过对DNA酶解前、后抗氧化功能的比较。故本研究以实验室前期制备的豆渣DNA及其酶解物为对象,进行了小鼠的体内抗氧化试验,比较了DNA酶解前后的抗氧化性,旨为豆渣DNA的药用价值和功能性食品开发提供参考。
1 材料与方法
1.1 材料与设备
豆渣DNA、DNA酶解物:均由东北农业大学食品学院食品科学实验室制备、保存;昆明小鼠:哈药试验动物中心;丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒:南京建成生物研究生生产;其余试剂:均为分析纯。
AL-104型精密电子天平:上海精密科学仪器有限公司;TDL-40B低速离心机:上海安亭科学仪器厂;UVmini1240紫外可见分光光度计:日本岛津公司;HH-4数显恒温水浴锅:常州国华电器有限公司。
1.2 方法
1.2.1 试验动物的分组及饲喂
选取健康昆明小白鼠80只,体重(20.0±2.0)g,雌雄各半。用全价颗粒饲料预饲一周后,进入正式试验。随机分为8组:空白对照组(等体积生理盐水)、VE对照组(30mg/kg)、DNA剂量组(30、60、120mg/kg)及DNA酶解物剂量组(30、60、120mg/kg),每组10只,雌雄各半,每天经口灌胃一次,每次0.5mL,连续30 d,自由采食和饮水。
1.2.2 样品采集
饲喂30 d后,禁食12 h,摘除眼球进行眼眶取血,并迅速颈椎脱臼法处死小鼠,取肝脏和脑,用预冷的生理盐水漂洗,剔除脂肪及结缔组织,滤纸吸干表面水分,置于-20℃保存备用。
血清的制备:将血液在3 000 r/min下离心15min,用无菌注射器取出血清,收集于干净的离心管中,-4℃保存待测。
组织匀浆的制备:将器官组织置于玻璃匀浆器中,加入一定量预冷的PBS缓冲液,在0℃~4℃下制成质量分数为10%的组织匀浆,在4℃,3 000 r/min下离心15min,取上清液于-4℃保存待测。
1.2.3 指标测定
按照南京建成生物研究所试剂盒说明书,分别测定SOD、CAT和GSH-Px的活力以及MDA含量。
1.2.4 统计分析
试验结果以X±SD形式表示,采用SPSS16.0统计软件进行统计分析。
2 结果与分析
2.1 小鼠体内MDA含量
经过30 d试验后,各组小鼠血清、肝脏和脑中MDA含量见表1。
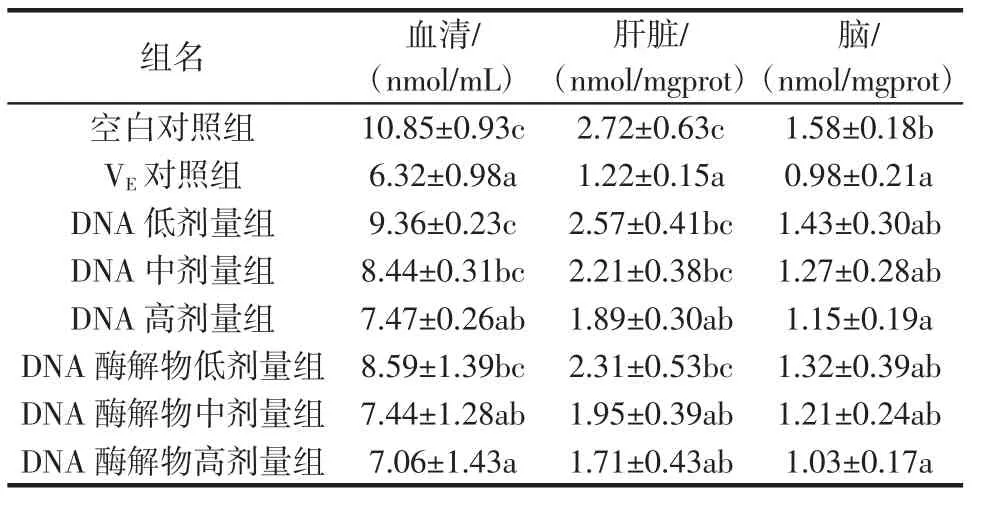
表1 各组小鼠组织中的MDA含量Tab le1 The contentofMDA inm ice tissueof allgroups
MDA即脂质过氧化物的代谢产物之一,MDA的高低可以反映出机体脂质过氧化程度。由表1可知,各试验组小鼠血清、肝脏及脑中的MDA含量均低于空白对照组,且DNA高剂量组和DNA酶解物高剂量组与空白对照组相比,差异显著(P<0.05)。同时,各试验组小鼠血清、肝脏及脑中的MDA含量均高于VE对照组,但DNA高剂量组和DNA酶解物中、高剂量组与VE对照组相比,差异不显著(P>0.05)。这说明DNA及其酶解物均可抑制小鼠血清、肝脏及脑MDA的产生,具有一定的抗氧化能力,尤其是DNA高剂量组和DNA酶解物中、高剂量组效果较好。
DNA低、中、高剂量组小鼠血清、肝脏及脑中的MDA含量均随浓度增高而降低,DNA酶解物组亦相同。此说明在一定浓度范围内,DNA及其酶解物的抗氧化能力与其浓度呈正相关。
DNA组与DNA酶解物组相比,在相同剂量下,酶解物组小鼠血清、肝脏及脑的MDA含量要明显低于DNA组,说明豆渣DNA酶解物的抗氧化能力优于豆渣DNA。
2.2 小鼠体内SOD活性
经过30 d试验后,小鼠血清、肝脏和脑中SOD活性变化见表2。
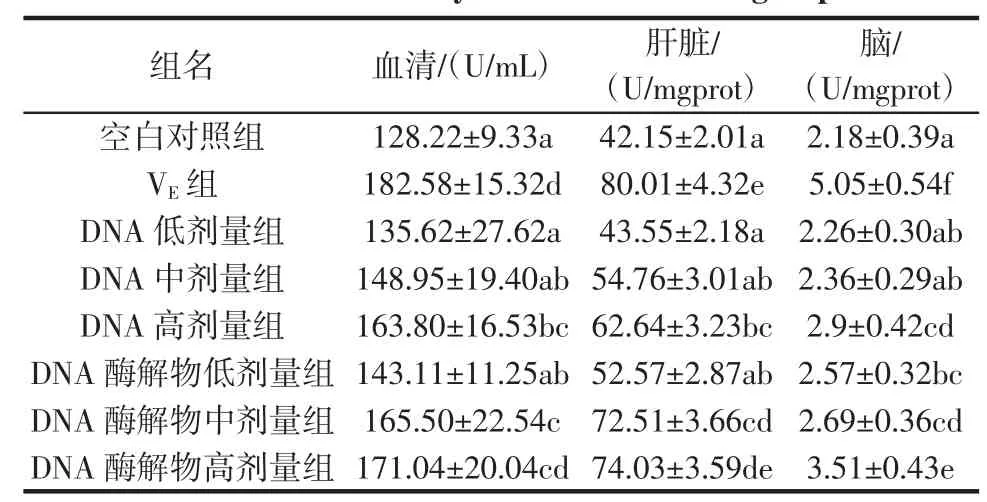
表2 各组小鼠组织中的SOD活性Table2 SOD activity inm ice tissueofallgroups
SOD是机体内一类重要的氧自由基清除酶,可以作为抗氧化的重要指标[14]。由表2可知,各试验组小鼠血清、肝脏及脑中的SOD活性均高于空白对照组,且DNA高剂量组和DNA酶解物高剂量组与空白对照组相比,差异显著(P<0.05)。同时,各试验组小鼠血清、肝脏及脑中的SOD活性均低于VE对照组,但DNA酶解物高剂量组小鼠血清和肝脏中SOD活性与VE对照组相比,差异不显著(P>0.05)。这说明DNA及其酶解物均可提高小鼠血清、肝脏及脑内SOD活性,尤其是DNA酶解物高剂量组对小鼠血清及肝脏中SOD活性影响最大。
DNA低、中、高剂量组小鼠血清、肝脏及脑中的SOD活性均随浓度增大而升高,DNA酶解物组亦相同。此说明在一定浓度范围内,DNA及其酶解物对小鼠血清、肝脏及脑中的SOD活性的提高与其浓度呈正相关。
DNA组与DNA酶解物组相比,在相同剂量下,酶解物组小鼠血清、肝脏及脑中的SOD活性要明显高于DNA组。且DNA酶解物中、高剂量组小鼠肝脏和脑中SOD活性显著高于相同剂量的DNA组(P<0.05)。这表明豆渣DNA酶解物对小鼠血清、肝脏及脑中SOD活性的提高效果优于豆渣DNA。
2.3 小鼠体内GSH-Px活性
经过30 d试验,小鼠血清、肝脏和脑中GSH-Px活性变化见表3。
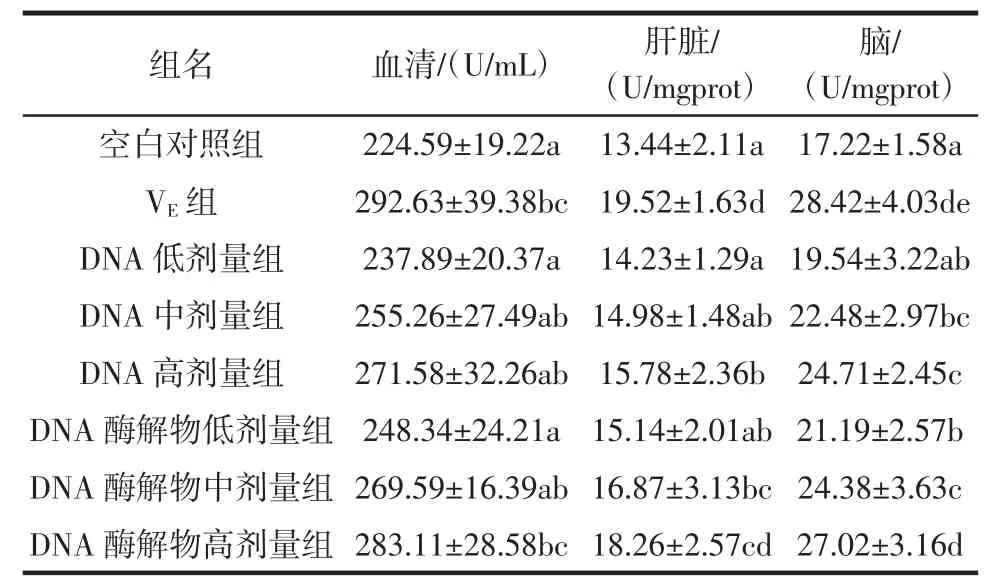
表3 各组小鼠组织中的GSH-Px活性Table3 GSP-Px activity inm ice tissueof allgroups
GSH-Px是机体内的一种重要的抗氧化酶,能够特异性催化GSH对氢过氧化物的还原反应,阻断体内脂质过氧化。GSH-Px活性的变化可以反映机体抗氧化能力[15]。由表3可知,各试验组小鼠血清、肝脏及脑中的GSH-Px活性均高于空白对照组,且血清中,DNA酶解物高剂量组与空白对照组相比,差异显著(P< 0.05);肝脏中,DNA高剂量组和DNA酶解物中、高剂量组与空白对照组相比,差异显著(P<0.05);脑中,DNA中、高剂量组和DNA酶解物低、中、高剂量组与空白对照组相比,差异显著(P<0.05)。同时,各试验组小鼠血清、肝脏及脑中的GSH-Px活性均低于VE对照组,但DNA酶解物高剂量组小鼠血清和肝脏中GSHPx活性与VE对照组相比,差异不显著(P>0.05)。以上说明DNA及其酶解物均可提高小鼠血清、肝脏及脑内GSH-Px活性,尤其对小鼠脑中GSH-Px活性影响最大。
DNA低、中、高剂量组小鼠血清、肝脏及脑中的SOD活性均随浓度增大而升高,DNA酶解物组亦相同。这表明在一定浓度范围内,DNA及其酶解物对小鼠血清、肝脏及脑中的GSH-Px活性的提高与其浓度呈正相关。
DNA组与DNA酶解物组相比,在相同剂量下,酶解物组小鼠血清、肝脏及脑中的GSH-Px活性要明显高于DNA组。且高剂量组相比,差异显著(P<0.05)。这进一步说明豆渣DNA酶解物对小鼠血清、肝脏及脑中GSH-Px活性的提高效果优于豆渣DNA。
2.4 小鼠体内CAT活性
经过30 d的试验后,小鼠血清和肝脏中CAT活性变化见表4。
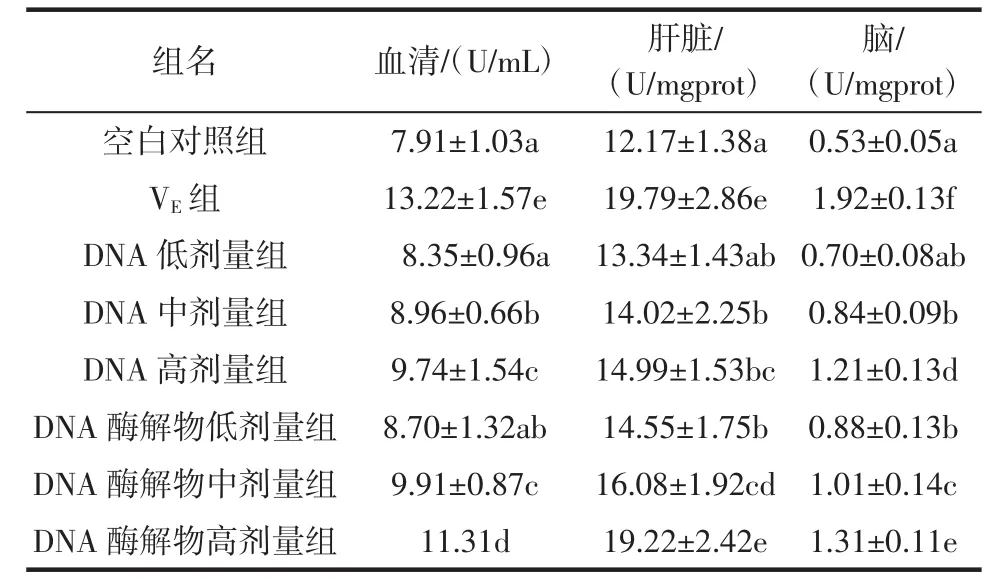
表4 各组小鼠组织中的CAT活性Table4 CAT activity inm ice tissueof allgroups
作为机体细胞中的一种重要抗氧化酶,CAT的活力水平直接影响了机体的抗氧化能力。由表4可知,各试验组小鼠血清、肝脏及脑中的CAT活性均高于空白对照组,且DNA中、高剂量组和DNA酶解物中、高剂量组与空白对照组相比,差异显著(P<0.05)。同时,各试验组小鼠血清、肝脏及脑中的CAT活性均低于VE对照组,但DNA酶解物高剂量组小鼠肝脏中CAT活性与VE对照组相比,差异不显著(P>0.05)。以上说明DNA及其酶解物均可提高小鼠血清、肝脏及脑内CAT活性,尤其是DNA酶解物高剂量组对小鼠血肝脏中CAT活性影响最大。
DNA低、中、高剂量组小鼠血清、肝脏及脑中的CAT活性均随浓度增大而升高,DNA酶解物组亦相同。这说明在一定浓度范围内,DNA及其酶解物对小鼠血清、肝脏及脑中的CAT活性的提高与其浓度呈正相关。
DNA组与DNA酶解物组相比,在相同剂量下,酶解物组小鼠血清、肝脏及脑中的CAT活性要明显高于DNA组。且中、高剂量组相比,差异显著(P<0.05),说明豆渣DNA酶解物对小鼠血清、肝脏及脑中CAT活性的提高效果优于豆渣DNA。
3 结论
各剂量组与空白对照组相比,小鼠体内SOD、GSH-Px和CAT活性均有不同程度的升高,MDA含量也明显下降,且在30mg/kg~120mg/kg的给药范围内,豆渣DNA及其酶解物的浓度与抗氧化能力呈现量效关系。在相同浓度下,DNA酶解物组中SOD、GSH-Px和CAT活性的增加幅度以及MDA含量的减少幅度都明显优于DNA组,且在高剂量组之间达到了显著水平,说明DNA酶解后的抗氧化水平明显高于DNA。与VE相比,DNA酶解物高剂量组虽弱于VE的抗氧化水平,但差异并不显著。因此豆渣DNA及其酶解物具有一定的抗氧化功效,且后者优于前者。
[1]戴秋萍,厉曙光,余金明.核酸抗氧化作用的研究[J].卫生研究, 2003,32(16):578-580
[2]Jonsson R.Dietary nucleotides and human immune cells[J].Nutrition,2006,34(4):729-736
[3]Peng L.Nucleotide nutrition in fish:Current knowledge and future applications[J].Aquaculture,2006,251(2):141-152
[4]PerezM J,SanchezM F,TorresM,et al.Dietary Nucleotides Enhance the LiverRedox Stateand Protein Synthesis in Cirrhotic Rats[J].Nutration,2004,134(10):2504-2508
[5]李蓉,佟晓永,赵鑫,等.饮食核酸对不同龄小鼠免疫功能的影响[J].营养学报,2010,31(11):275-278
[6]Mafra I,Susana A S,Elsa JM,etal.Comparative study ofDNA extractionmethods for soybean derived food products[J].Food Control, 2008,29(25):1183-1190
[7]刘润芝.抗衰老保健的核酸食品的开发利用[J].生物工程进展, 2011(11):305-308
[8]周永红,唐孝礼,许实波.鲤鱼类精巢DNA对自由基的消除作用[J].中国老年学杂志,2010,19(1):104-107
[9]AmesW.Dietary nucleotides prevent decrease in cellular immunity in ground-basedmicrogravity analog[J].Journalof Applied Physiology,2003,81:673-682
[10]GAN JH.Chemicaland structuralbiology ofnucleic acidsand protein-nucleic acid complexes for novel drug discovery[J].Science China,2011,54(1):3-23
[11]IsabelM,Susana A,Elsa J,etal.Comparative study ofDNA extraction methods for soybean derived food products[J].Food Control, 2008(25):1183-1190
[12]Sonoda T.Metabolic fate of pyrimidines and purines in dietary nucleic acids ingested bymice[J].Biochim Biophys Acta,2005,34(4): 417-419
[13]Uauy R.Nonimmune system responses to dietary nucleotides[J]. ScienceChina,2002(22):148-152
[14]赵永芳.生物化学技术原理及应用[M].北京:科学出版社,2002
[15]Finkel T,Holbrook N J.Oxidants,oxidative stress and the biology of ageing[J].Nature,2010,408(68):239-247
Antioxidative Activity of DNA and its Hydrolysates from Soybean Dregs in Vivo
DONGHe-liang1,CHAICai-jian2,SHAOMei-li2,*
(1.Heilongjiang Province Quality and Technical Supervision and Inspection Center,Harbin 150090,Heilongjiang,China;2.College of Food Science,Northeast Agriculture University,Harbin 150030,Heilongjiang,China)
Theantioxidantactivity ofDNA and itshydrolysates from soybean dregs inmicewere studied.Eighty mice were divided into eight groups random ly,and administered with Vitamin E(VE),normal saline(NS),differentdosesofDNA(30,60,120mg/kg)and hydrolysates(30,60,120mg/kg)day respectively.Themice were decollated and blood serum,liver,brain were collected after 30 days,then CAT,SOD,GSH-Px activity and MDA contentin serum,liverand brain ofmicewere examined.The resultsshowed DNA and itshydrolysates from soybean dregs could improve the activity of SOD,CAT and GSH-Px in the serum,liver and brain and decrease the contentsofMDA in themice,especially the hydrolysates.In conclusion,DNA and itshydrolysates from soybean dregshad thesignificantlyantioxidantactivity in vivo,and thehydrolysateswerebetter than DNA.
soybean;DNA;hydrolysates;antioxidant
2014-05-15
10.3969/j.issn.1005-6521.2014.23.002
黑龙江省博士后科研启动基金(LBH-Q10152)
董和亮(1980—),男(汉),工程师,学士,研究方向:食品中活性物质检测、分析。
*通信作者
