大鼠服用丹酚酸B合用匹伐他汀后药动学和肝细胞摄取能力的改变
2014-07-18魏筱华盛向远钟海利邹德琴郑雪莲彭洪薇温金华
肖 频,魏筱华,盛向远,钟海利,邹德琴,郑雪莲,彭洪薇,蔡 军,温金华
大鼠服用丹酚酸B合用匹伐他汀后药动学和肝细胞摄取能力的改变
肖 频1,魏筱华2,盛向远2,钟海利2,邹德琴2,郑雪莲2,彭洪薇2,蔡 军2,温金华2
目的研究大鼠服用丹酚酸B合用匹伐他汀后药动学及肝细胞摄取能力的改变。方法将SD雄性大鼠随机分为两组,每组6只,实验一组单用丹酚酸B (2.5 g/kg)给药;另一组丹酚酸B合用匹伐他汀(0.5 mg/kg)。两药合用时先丹酚酸B后匹伐他汀相继灌胃,间隔15 min,眼球静脉取血,探讨有机阴离子转运多肽 (organic anion transporting polypeptides, OATP)底物匹伐他汀对丹酚酸B的药动学影响。然后,游离大鼠原代肝细胞,考察匹伐他汀对大鼠原代肝细胞摄取丹酚酸B的影响。结果丹酚酸合用匹伐他汀后,丹酚酸B的药动学特性发生明显变化,AUC(0-t)、AUC(0-∞)和Cmax分别增加了54.63%、69.72%、50.56%。随着匹伐他汀浓度增加,其对大鼠原代肝细胞摄取丹酚酸B的抑制作用逐渐增强,IC50为(5.21±1.68)μmol/L。结论丹酚酸B肝脏转运机制可能与OATP密切相关。
丹酚酸B;肝脏;转运;匹伐他汀
丹酚酸B是丹参的有效水溶性成分,具有保护心肌、保护心脏、抗纤维化、抗肿瘤等多种药理活性[1,2]。丹酚酸B在肝脏分布较广[3],但分布机制尚不明确。探明该机制对研究丹酚酸B的药理学活性及其临床应用具有较重要的意义。
有研究发现,维拉帕米(转运蛋白抑制药)在大鼠体内对丹酚酸的药动学有明显的影响:Cmax与AUC显著增大,而清除率CL显著降低[4]。由于维拉帕米可对药物转运体如P-糖蛋白(P-glycoprotein, P-gp)、乳腺癌耐药转运体 (breast cancer resistance protein, BCRP)、有机阴离子转运多肽 (organic anion transporting polypeptides, OATP)均具有抑制作用,因此,该研究提示丹酚酸B亦有可能是这些药物转运体的底物。有研究提示丹酚酸B在大鼠肝脏内的转运可能与有OATP1B1(编码基因SLCO1B1,是一种特异性分布于肝细胞基底膜上的一种转运蛋白)密切相关[5-7]。本研究拟建立大鼠体内及大鼠原代肝细胞模型,以此为基础探讨丹酚酸B肝脏转运的初步研究。
1 材料与方法
1.1 材料
1.1.1 主要药品与试剂 丹酚酸B,纯度>98.0%,成都曼思特生物科技有限公司,批号MUST-13082008。匹伐他汀(内标)含量为95.6%,批号为0703001,广东东阳光药业有限公司。甲醇(高效液相色谱分析用)含量>99.9%,西陇化工股份有限公司。胎牛血清(fetal bovine serum,FBS),杭州四季青公司。Ⅳ型胶原酶,美国Gibco公司。
1.1.2 实验动物 Wistar大鼠,雄性,体重210~230 g,南昌大学实验动物中心提供,动物生产合格证号SYXK(赣)2010-0002。
1.1.3 仪器 安捷伦Agilent-1260高效液相色谱仪;色谱柱(Agilent HC-C18,4.6 mm×150 mm, 5 μm);上海飞鸽牌高速台式冷冻离心机(GL-20G-Ⅱ);METTLER TOLEDO 802电子天平;深圳市洁泰超声清洗机JPS-20;美国涡旋震荡仪Vortex-2;德国贺利氏CO2培养箱150; 日本Olympus CKX-41型倒置光学显微镜。
1.2 方法
1.2.1 色谱条件 甲醇∶水(200 ml+200 μl磷酸)=48∶52(v/v),波长286 nm;柱温35 ℃;流速1.0 ml/min,进样量为20 μl。
1.2.2 样本处理 100 μl血样或细胞裂解液,加入10 μl 10%盐酸,振荡混匀;加入乙酸乙酯3.0 ml,涡旋振荡1 min,离心10 min,去上层有机溶剂于30 ℃氮气流吹干。加流动相60 μl 溶解,涡旋振荡1 min,离心10 min,直接进样40 μl。
1.2.3 分组及给药 健康雄性 Wistar 大鼠12 只,禁食不禁水12 h,随机分为两组,每组6只,实验时一组单用丹酚酸B (2.5 g/kg)给药,另一组丹酚酸B合用匹伐他汀(0.5 mg/kg)。两药合用时先丹酚酸B后匹伐他汀相继灌胃,间隔15 min,在灌胃给药前0 h与给药后0.15、0.3、0.5、1、1.5、2、 3、4、6 h 于眼底静脉丛取血约0.25 ml,置肝素处理的Eppendorf 管中,3000 r/min, 离心10 min,分离血浆,置-20 ℃冰箱保存。
1.2.4 大鼠肝细胞的分离提取 大鼠经5%戊巴比妥钠(100 μl/100 g)尾静脉麻醉并注射肝素1000 U/kg抗凝后,沿腹壁正中切开腹腔,门静脉插管结扎,灌注37 ℃ 0.02%无钙EDTA-PBS液(20~40 ml/min, 5~10 min),直至下腔静脉中流出的液体变清时,再用0.04% Ⅳ型胶原酶原位灌注(15~20 ml/min, 6 min),至肝脏变软肿大,压之凹陷不易恢复。取出肝脏,去掉肝脏表面的包膜,在DMEM温孵液中分离细胞,所得的肝细胞混悬液用DMEM温孵液洗涤,低速离心分离后(500 r/min, 5 min)重复3次,获得纯化的肝细胞用含10%胎牛血清的DMED培养液重悬,制备成游离肝细胞悬液。
1.2.5 丹酚酸B的摄取动力学及温度、浓度和pH值对摄取的影响 将用24孔板培养至良好状态的肝细胞用37 ℃ 的Hank液浸泡20 min,除去细胞表面的杂质,加入37 ℃含丹酚酸B的Hank液1 ml,置37 ℃ 的培养箱中分别孵育10、30、60、90、120 min,取出后吸出药液,以4 ℃空白Hank’s液冲洗3遍,加入“三蒸水”1 ml,反复冻融3次,破碎细胞,制成细胞溶液,处理后进行检测。温度的影响:改为在4 ℃冰箱中孵育,分别孵育10、20、30、40、60、90 min,其余操作同上。药物浓度的影响:对肝细胞分别给予含丹酚酸B 0.25×10-3、0.5×10-3、1×10-3、2×10-3、4× 10-3、8×10-3、16×10-3mmol /L的Hank液1 ml,置37 ℃的培养箱中孵育120 min,其余操作同上。pH的影响:对肝细胞分别给予不同pH (6.0、6.5、7.0、7.5) 的丹酚酸B(1×10- 3mol/L)的Hank液1 ml,置37 ℃的培养箱中孵育120 min,其余操作同上。
1.2.6 细胞悬液蛋白质的测定 采用考马斯亮兰法测定细胞悬液中蛋白质的含量, 细胞悬液取样量为50 μl。
1.2.7 匹伐他汀对原代肝细胞摄取丹酚酸B的影响 用DMEM培养液将肝细胞悬液稀释为1×106/ml,加入到24孔培养板内,每孔2 ml。实验分为空白组、丹酚酸B对照组及丹酚酸B加系列浓度匹伐他汀组;加入20 μl对应的药物稀释液,使丹酚酸B终浓度为4 mmol/L,匹伐他汀终浓度分别为10、20、40 μmol;每组设4个复孔。置37 ℃的培养箱中分别孵肓40 s,定时缓慢吸弃细胞上层培养液,加入4 ℃PBS液洗涤4次后加入0.5 ml无菌水于-80 ℃超低温冰箱反复冻融3次。取细胞破碎液100 μl按“样本处理”操作后进行分析。
1.3 统计学处理 实验数据采用DAS2.1药动学软件的非房室模型法分析(统计矩法)进行药动学参数计算。药动学参数间的比较运用SPSS12.0软件采用配对t检验。用MINIIC50软件计算丹酚酸B对匹伐他汀在原代肝细胞的摄取抑制参数IC50。
2 结 果
2.1 大鼠肝细胞形态学特征 单用丹酚酸B大鼠原代肝细胞呈条索状或圆块状,细胞透亮,边界清楚,胞质丰富,泡浆内有许多小颗粒,可见空泡,细胞核中等大小,圆形或椭圆形,核多偏位,可见双核甚至多核,以单核多见(图1A)。丹酚酸B合用匹伐他汀大鼠原代肝细胞形态均一,大多数细胞呈单个分散状态,也呈现小小的细胞团。随着细胞培养时间延长,细胞贴壁,伸展,变薄,体积明显变大,部分细胞呈多边形展开,有些细胞呈岛状连接(图1B)。
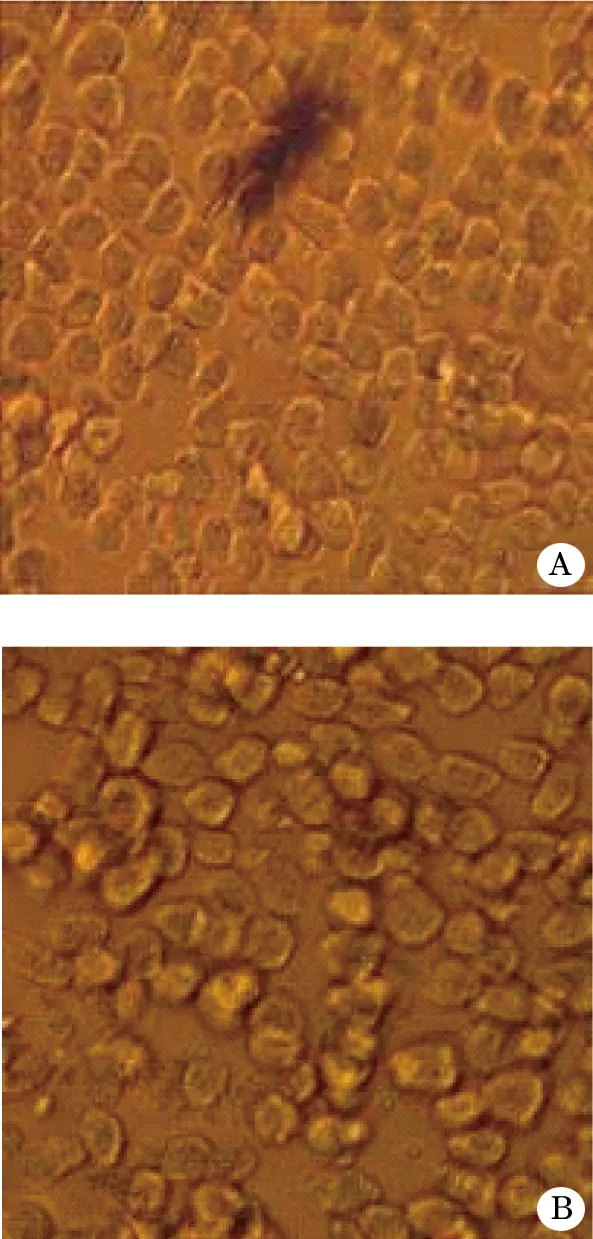
图1 倒置显微镜下大鼠原代肝细胞 (HE,×400)
2.2 匹伐他汀对丹酚酸B的药动学影响 丹酚酸B合用匹伐他汀后,丹酚酸B的药动学特性发生明显变化,AUC(0-t)、AUC(0-∞)和Cmax均明显增加,均值分别增加了54.63%、69.72%、50.56%;且合用后丹酚酸B的半衰期亦增加,与单用丹酚酸B比较,呈现统计学差异(表1)。达峰时间并未呈现统计方面的差别(图2)。
2.3 丹酚酸B的摄取动力学 肝细胞对丹酚酸B的摄取在30 min基本达到平衡,此后摄取量趋于饱和,在4 ℃ 时,肝细胞摄取量为(13.38±4.75)μg/mg protein,而37℃ 时为(8.36±2.35)μg/mg protein,可见随着温度升高摄取量反而减少,差别有统计学意义(P<0.05)。在pH=7.5时,肝细胞摄取量为(10.89±3.86)μg/mg protein,在pH=6时,则为(14.38±5.06)μg/mg protein,后者高于前者,差异有统计学意义(P<0.05)。肝细胞对丹酚酸B的摄取量与给药浓度呈正比,当浓度为 8×10-3mmol/L达到饱和现象(图3)。
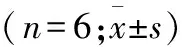
参数单用丹酚酸B丹酚酸B合用匹伐他汀PAUC(0⁃t)2.05±0.243.17±0.300.0002AUC(0⁃∞)2.25±0.253.53±0.400.0003t1/20.89±141.14±0.140.0390Tmax0.47±0.080.43±0.100.6101Cmax1.78±0.272.68±0.310.0002

图2 灌服匹伐他汀前后丹酚酸B的平均药时曲线下面积
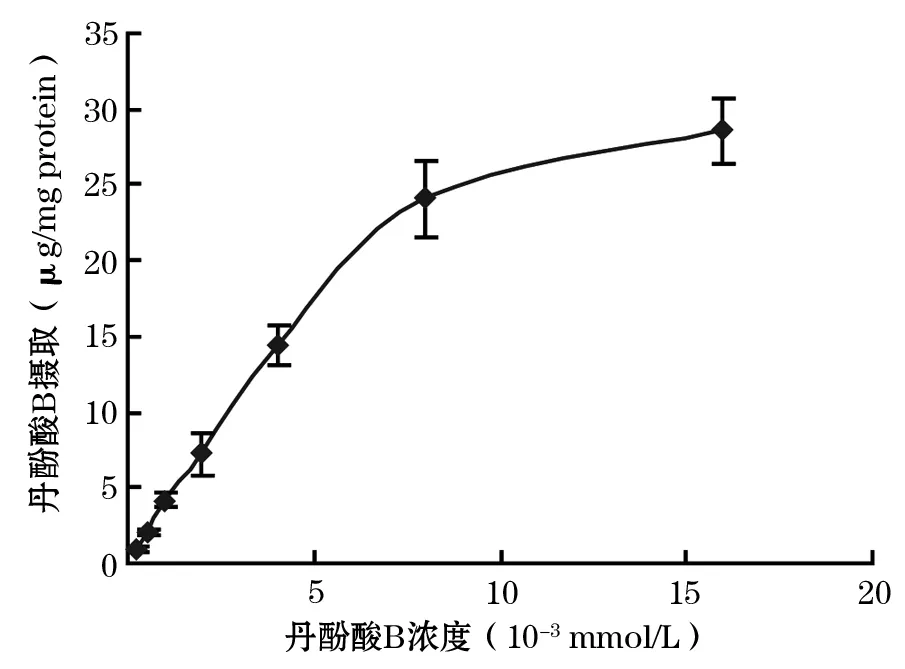
图3 丹酚酸B在大鼠肝细胞中的摄取
2.4 匹伐他汀对原肝细胞摄取丹酚酸B的影响 单用丹酚酸B时,肝细胞摄取丹酚酸B为(14.36±0.83)μg/mg protein,而当加用2、5、10 μmol 匹伐他汀时,摄取能力降低,依次为(10.83±1.07)、(7.65±0.89)、(5.96±0.67)μg/mg protein,与单用丹酚酸B比较,差别均有统计学意义(P<0.01)。IC50为(5.21±1.68)μmol/L。
3 讨 论
目前,国内外对丹酚酸B的研究主要集中于其分离、提取、鉴定和药理学效应,而对丹酚酸B在体内药物转运机制的研究甚少。进入体内后丹酚酸的分布如下心>肝>肺>肠>肾>脾>胃[3]。丹酚酸B在大鼠体内主要通过肝脏甲基化代谢成活性代谢产物M1 (3-甲基-丹酚酸B ) ,M2(3,3‴-二甲基-丹酚酸B ) ,M3( 3,3″,3‴-三甲基-丹酚酸B ) ,M4(3,3″-二甲基-丹酚酸B)[7]。目前,肝脏内对丹酚酸B的摄取机制尚不明确。笔者前期研究发现,丹参素在大鼠体内可显著影响瑞舒伐他汀的药动学[5],并且该影响与丹参素在肝脏竞争抑制OATP1B1介导的瑞舒伐他汀的转运密切相关[5]。丹酚酸B与丹参素均是丹参水溶性成分,有研究显示丹参素是丹酚酸B在大鼠体内的代谢成分[6,7]。本研究通过整体动物及肝细胞两方面来初步探讨丹酚酸B肝脏转运机制。
本研究结果表明,匹伐他汀可以明显影响丹酚酸B在大鼠体内的药动学,但由于体内影响因素诸多,尚不能明确具体的原因。匹伐他汀在肝脏亦具有较高的药物浓度,可以说后者是其作用的主要靶器官,因此,随后主要围绕大鼠肝细胞进行相关研究,并发现匹伐他汀对肝细胞摄取丹酚酸B表现出明显的抑制作用。由于匹伐他汀主要通过OATP1B1摄取进入肝细胞,匹伐他汀是OATP1B1的底物[8,9],因此丹酚酸B亦有可能是OATP1B1的底物,从而引发底物的竞争,导致匹伐他汀对肝细胞摄取丹酚酸B的影响。由于肝细胞上其他转运体如BCRP、NTCP、MRP等均有表达[10],因此,丹酚酸B肝脏摄取的相关研究需进一步探讨。
[1] 王 蓉,原永芳. 丹酚酸B 药理作用的研究概况[J]. 中医药导报, 2011, 17(4): 130-132.
[2] 陈 磊,陆 茵,郑仕中. 丹参药理活性成分的整合效应 [J]. 中草药, 2009, 40(3): 476-479.
[3] 侯 俊,张立国,倪力军,等. 双氢丹酚酸B及丹酚酸B在小鼠体内的药动学及组织分布的比较研究[J]. 中药新药与临床药理, 2010, 21(4): 396-399.
[4] ZHAO Di, GAO Zidong, HAN De’en,etal. Influence of rifampicin on the pharmacokinetics of salvianolic acid B may involve inhibition of organic anion transporting polypeptide (Oatp) mediated influx [J] . Phytother Res, 2012, 26: 118-121.
[5] 温金华, 胡锦芳, 蔡 军, 等. 丹参对瑞舒伐他汀在大鼠体内药代动力学的影响[J]. 第二军医大学学报, 2012, 33(3): 320-323.
[6] 张文静, 曹琦琛, 曹 珂, 等. 丹酚酸B的药动学研究进展[J]. 中国新药杂志, 2011, 20(7): 608-612.
[7] 万仁忠, 许妍妍, 谷 元, 等. 丹酚酸B及其活性代谢产物在大鼠体内药动学研究[J]. 中草药, 2011, 42(2): 335-339.
[8] Wen J H, Wu W, Yang D,etal. The role of OATPs /Oatps in pharmacokinetics and drug-drug interaction of cardiovascular agents [J]. Drug Future, 2013, 38(4):257-262.
[9] Takahashi T, Ohtsuka T, Yoshikawa T,etal. Pitavastatin as an in vivo probe for studying hepatic organic anion transporting polypeptide-mediated drug-drug interactions in cynomolgus monkeys[J]. Drug Metab Dispos, 2013, 41(10): 1875-1882.
[10] Schuetz J D, Swaan P W, Tweedie D J. The role of transporters in toxicity and disease[J]. Drug Metab Dispos, 2014, 42(4): 541-545.
(2014-04-12收稿 2014-05-17修回)
(责任编辑 武建虎)
InvivoPharmacokineticsofsalvianolicacidBcombinedwithpitavastatinanduptakingofsalvianolicacidBinhepatocytesofrats
XIAO Pin1, WEI Xiahua2, SHENG Xiangyuan2, ZHONG Haili2, ZOU Deqin2, ZHENG Xuelian2, PENG Hongwei2, CAI Jun2,and WEN Jinhua2.
1. Department of Pharmacy,Jiangxi Provincial Corps Hospital, Chinese People’s Armed Police Forces, Nanchang 330000,China 2. Department of Pharmacy, the First Affiliated Hospital of Nanchang University, Nanchang 330006,China
ObjectiveTo study the pharmacokinetics of salvianolic acid B combined with pitavastatin and the uptaking of salvianolic acid B in rat hepatocytes.MethodsSD male rats were randomly divided into two groups (n=6).One group was given salvianolic acid B 2.5 g/kg and another group was given salvianolic acid B combined with pitavastatin 0.5 mg/kg. For combined administration, the salvianolic acid B was first gavaged and then pitavastatin. Interval time lasted about 15 min. Blood samples were collected from the orbital vein. The effect of OATP1B1 substrate of pitavastatin on the pharmacokinetics of salvianolic acid B in rats was examined. Then the primary rat hepatocytes were separated, the effect of pitavastatin on the hepatocytes uptaking of salvianolic acid B was studied.ResultsThe pharmacokinetic characteristics of salvianolic acid B significantly changed when salvianolic acid B was combined with pitavastatin, the parameters of AUC (0-t), AUC (0- ∞) and Cmax were significantly increased by 54.63%, 69.72%, and 50.56%. Simulatneously, the inhibitory action for uptaking of salvianolic acid B in rat hepatocytes increased gradually with increasing pitavastatin concentration. The IC50was (5.21±1.68) μmol.ConclusionsThe uptaking of salvianolic acid B in hepatocytes may be closely related to OATP.
salvianolic acid B;hepatocytes;transport;pitavastatin
江西省卫生厅中医药科研计划课题(2012A137)
肖 频,本科学历,副主任药师,E-mail: zpchen_5500@126.com
1.330000南昌,武警江西总队医院药剂科;2. 330006,南昌大学第一附属医院药剂科
温金华,E-mail:wenjh866@163.com
R969
