弗林蛋白酶抑制剂对乳腺癌细胞MCF-7迁移的影响*
2014-07-18任京力孙明振宋国华马永超
任京力, 史 齐 , 孙明振, 宋国华, 马永超
(漯河医学高等专科学校 1医学生物工程重点实验室, 2药学系药理学教研室, 4生物化学教研室,河南 漯河 462000;3新乡医学院病理教研室,河南 新乡 453000)
弗林蛋白酶抑制剂对乳腺癌细胞MCF-7迁移的影响*
任京力1, 2△, 史 齐3, 孙明振2, 宋国华1, 马永超4
(漯河医学高等专科学校1医学生物工程重点实验室,2药学系药理学教研室,4生物化学教研室,河南 漯河 462000;3新乡医学院病理教研室,河南 新乡 453000)
目的: 探讨乳腺癌转移的机制,为深入研究乳腺癌发生、发展机制提供理论基础。方法: 不同浓度的弗林蛋白酶(furin)抑制剂处理人乳腺癌细胞MCF-7 48 h。细胞划痕实验(wound healing assay)和细胞趋化实验(Transwell assay)检测MCF-7细胞迁移和侵袭能力。Western blotting 检测细胞迁移相关蛋白膜型基质金属蛋白酶1(MT1-MMP)、血管内皮生长因子(VEGF)-C和VEGF-D水平。酶联免疫吸附法(ELISA)检测细胞培养液中基质金属蛋白酶(MMP)2和9水平。结果: 与对照组相比,200 nmol/L的furin抑制剂α1-PDX即对细胞迁移及侵袭起显著抑制作用(均P<0.05);细胞迁移相关的MT1-MMP、VEGF-C和VEGF-D表达水平均显著降低(P<0.05);MCF-7细胞上清液中MMP2 和 MMP9的表达均显著降低(P<0.05)。结论: Furin抑制剂通过下调乳腺癌细胞MCF-7的MMPs及VEGFs表达抑制其迁移。
弗林蛋白酶抑制剂; 乳腺肿瘤; 基质金属蛋白酶; 血管内皮生长因子
前蛋白转化酶家族的生物学及其与疾病的关系一直受到广泛关注。弗林蛋白酶(furin)是蛋白前体加工酶家族中的重要成员,其与肿瘤细胞生物学特性的关系是肿瘤研究的重要领域。Furin在细胞定位于反面高尔基体囊膜、内体和细胞表面。细胞内许多重要的多肽与蛋白质激素的合成与分泌、膜受体的成熟、血浆蛋白前体的激活等过程需要furin的参与,这些蛋白质在发挥活性之前需要经过蛋白转化酶对蛋白前体切割,然后才能成为有功能的蛋白质[1]。包括Notch、Wnt、膜型基质金属蛋白酶1(membrane-type 1 matrix metalloproteinase,MT1-MMP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)在内的许多与肿瘤发生发展密切相关的蛋白质在体内成熟过程中,必须经过furin等蛋白转化酶对其前体进行剪切,才能发挥生物学活性[2-3]。这些蛋白质中部分成员与肿瘤的发生、发展密切相关。因此furin酶活性及其对底物剪切的调控应该是肿瘤防治靶点。然而,综合目前的研究,发现在不同的肿瘤,抑制furin的活性对肿瘤生物学行为的改变是不同的[4-5]。有关furin与乳腺癌转移的关系目前还不清楚,我们当前的研究为揭示furin在乳腺癌发生发展中的作用提供了理论依据。
材 料 和 方 法
1 细胞与试剂
人乳腺癌细胞系MCF-7购自中国医学科学院协和细胞库,生长在含有10%胎牛血清(FBS)、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基(Gibco)中,于37 ℃、 5% CO2饱和湿度下培养。Furin抑制剂α1-PDX(Merck)溶于DMSO中,制成5 mmol/L母液。鼠抗人VEGF-C、VEGF-D、MT1-MMP和GAPDH抗体均购自Santa Cruz;抗鼠IgG-HRP和抗兔IgG-HRP购自Sigma;MTT、Hoechst 33342和Transwell试剂购自Promega;基质金属蛋白酶(matrix metalloproteinase,MMP)2和MMP9 ELISA检测试剂盒购自南京建成生物试剂公司;其它试剂均为国产分析纯。
2 方法
2.1 单层细胞迁移实验(wound healing assay) MCF-7细胞接种在6孔板,待生长至融合度达100% 时,用无菌的200 μL的枪头尖制成划痕(wound),并用PBS洗涤细胞碎片。细胞处理同前。在指定的时间用倒置显微镜配备的数码相机拍摄受伤区域的细胞迁移情况。
2.2 Transwell侵袭实验 不同浓度α1-PDX处理的MCF-7细胞(1×105)接种于Transwell小室的上部腔室,含有200 μL的RPMI-1640培养基,但不含10% FBS。Transwell小室下部腔室被填充有500 μL的完整的RPMI-1640培养基,含10%FBS。使细胞迁移48 h,然后用4%甲醛将细胞固定,室温下孵育15 min。去离子水洗涤后,0.1%结晶紫染色。在光学显微镜下拍摄迁移的克隆。
2.3 Western blotting 检测细胞迁移相关蛋白表达水平 MCF-7细胞培养及处理同前。收集细胞加入RIPA缓冲液及蛋白酶抑制剂,冰上孵育30 min,13 200 r/min离心30 min。收集上清并用BCA法(Pierce)测定蛋白浓度。细胞总蛋白经12%的SDS-PAGE分离后转移到PVDF膜,室温下5%脱脂牛奶封闭1 h。在4 ℃下孵育MT1-MMP、VEGF-C、VEGF-D和GAPDH(1∶1 000)的抗体过夜。PBST洗涤后加入HRP标记的羊抗鼠Ⅱ抗,室温下孵育1 h, PBST洗涤后,超敏发光液(Pierce)孵育后,LAS3000成像仪拍照。
2.4 ELISA MCF-7细胞处理同前所述,收集细胞培养上清并根据MMP2和MMP9 ELISA检测试剂盒说明书进行后续检测。每个样品重复5次。
3 统计学处理
应用SPSS 13.0 软件进行统计学处理,数据以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 α1-PDX对MCF-7细胞迁移和侵袭的影响
为检测α1-PDX是否对MCF-7细胞的迁移和侵袭有调节作用,我们用wound healing和Transwell实验检测了MCF-7细胞迁移的情况。2种实验结果均表明α1-PDX显著降低了MCF-7细胞迁移和侵袭能力,见图1、2。
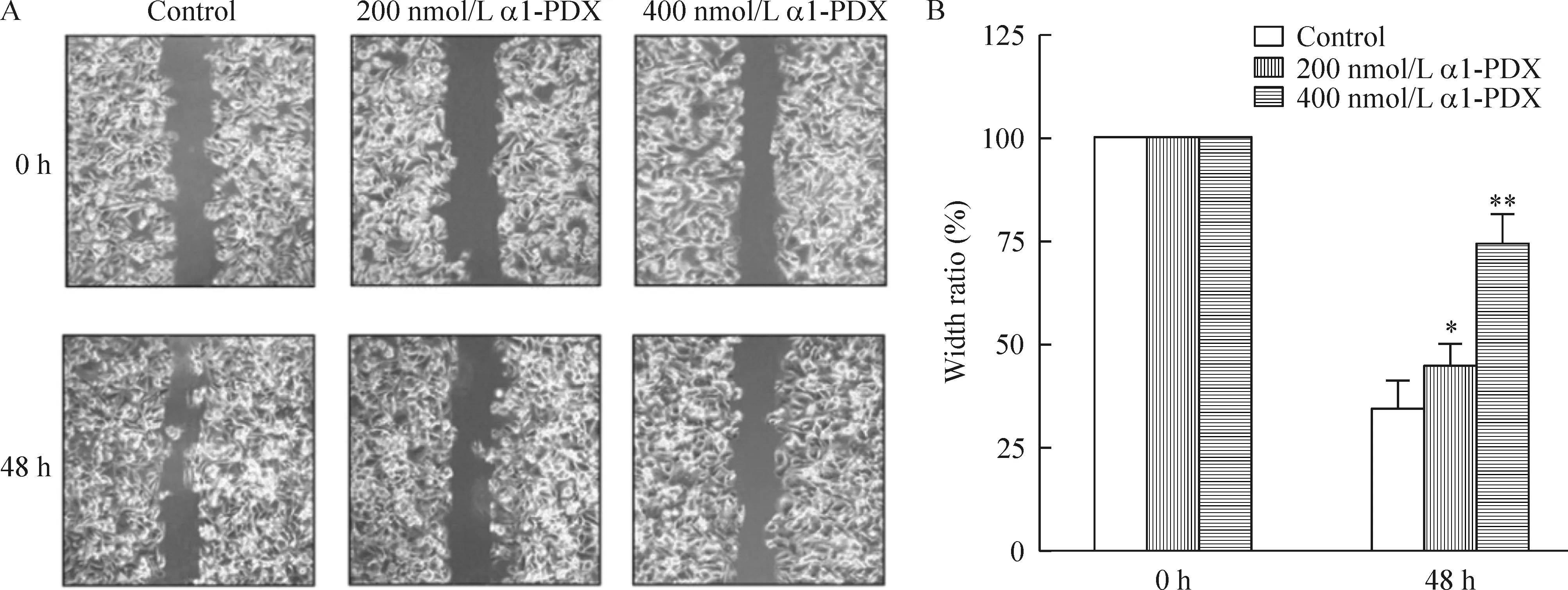
Figure 1.The effects of α1-PDX on the migration of MCF-7 cells. A: original imaging of wounding healing assay upon stimuli of different concentrations of α1-PDX at different time points (×100); B: statistical analysis of the effects of α1-PDX on the migration of MCF-7 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h.
图1 α1-PDX对MCF-7细胞迁移的影响

Figure 2.The effects of α1-PDX on the invasion ability of MCF-7 cells (crystal violet staining,×100). A: control group; B: MCF-7 cells treated with 200 nmol/L α1-PDX for 48 h; C: MCF-7 cells treated with 400 nmol/L α1-PDX for 48 h; D: statistical analysis of the effects of α1-PDX on the invasion ability of MCF-7 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图2 不同浓度α1-PDX对MCF-7细胞侵袭能力的影响
2 α1-PDX对细胞迁移相关蛋白表达的影响
许多蛋白质在体内参与肿瘤细胞迁移的调节。为充分了解α1-PDX调节MCF-7细胞迁移的分子机制,我们通过Western blotting和ELISA法检测了细胞MT1-MMP、MMP2、MMP9、VEGF-C和VEGF-D蛋白表达水平。如图3所示,α1-PDX显著降低了细胞内MT1-MMP、VEGF-C和VEGF-D的表达。同时细胞培养液上清中MMP2和MMP9浓度也明显低于对照组,见图4。这些结果表明,α1-PDX抑制MCF-7细胞迁移可能与降低MT1-MMP、MMP2、MMP9、VEGF-C和 VEGF-D的表达有关。
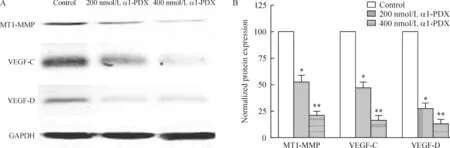
Figure 3.The effects of α1-PDX on the expression of cell migration-associated proteins MT1-MMP, VEGF-C and VEGF-D. A: original Western blotting showing the protein expression of MT1-MMP, VEGF-C and VEGF-D upon treatment with different concentrations of α1-PDX for 48 h; B: statistical analysis of the protein expression levels of MT1-MMP, VEGF-C and VEGF-D upon treatment with different concentrations of α1-PDX for 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图3 α1-PDX对迁移相关蛋白MT1-MMP、 VEGF-C及VEGF-D表达的影响
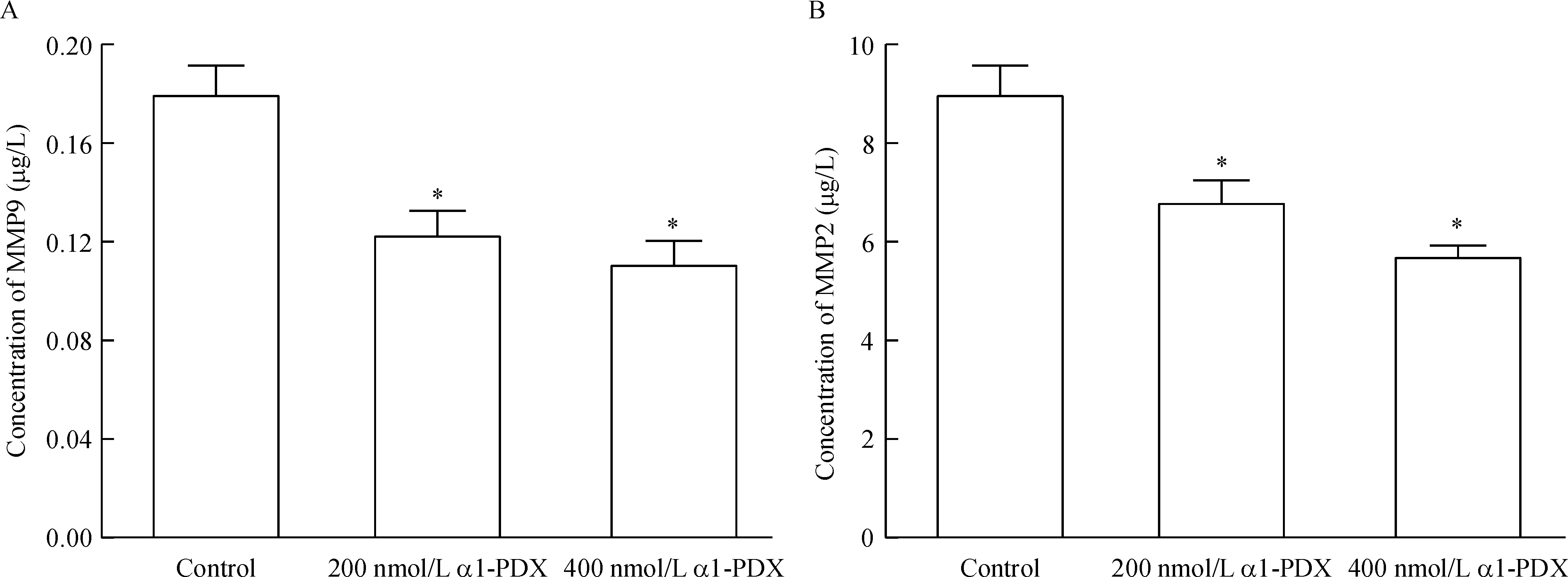
Figure 4.The effects of α1-PDX on the protein levels of MMP9 (A) and MMP2 (B) in the supernatant of MCF-7 cells. Mean±SD.n=5.*P<0.05vscontrol.
图4 α1-PDX对MCF-7细胞上清液中MMP9和MMP2水平的影响
讨 论
乳腺癌是女性最常见的恶性肿瘤之一,其死亡率仅次于肺癌而位居第二,我国虽是乳腺癌低发区,但其发病率也正逐年上升[5],在大城市中已经接近欧美国家的发病水平,故对乳腺癌的研究越来越受到重视。晚期乳腺癌患者中,最常见的并发症为骨、肺和肝等转移。随着对乳腺癌生物学行为研究的不断深入,目前认为乳腺癌发病就是全身性疾病,其主要的死亡原因是远处转移,最常见的远处转移部位是骨骼[6]。因而进行深入研究乳腺癌侵袭和转移的分子机制很有必要。
Furin在肿瘤进展中发挥重要作用,可以作为肿瘤进展过程中的分子标记,在某种程度上可以作为肿瘤预后的指标[7]。许多与肿瘤密切相关的蛋白成熟需经过furin蛋白的剪切加工。所以,furin活性及其与底物蛋白相互作用的调节可以作为肿瘤治疗的靶点。抑制furin活性对抑制肿瘤的迁移和侵袭有积极作用。弗林蛋白酶抑制剂α1-PDX为目前常用的furin抑制剂。α1-PDX为一生物工程重组的α1-蛋白酶突变体,其特殊之处是在其活性位点环中有一段单一最小弗林蛋白酶共享序列(Arg355-Ile-Pro-Arg358),起到抑制furin活性的作用。
在本研究中,我们发现,furin抑制剂α1-PDX可诱导MCF-7细胞增殖抑制和凋亡。此外,我们还发现, MCF-7细胞经α1-PDX孵育后,迁移能力显著降低。但具体的分子机制不清楚。肿瘤转移是一个复杂的多步骤的过程。许多蛋白分子参与肿瘤转移的过程。众所周知,肿瘤细胞外基质消化是肿瘤最常见的侵袭和转移的前提条件,肿瘤细胞分泌的MMPs可以降解所有的细胞外基质的重要组成部分[8-9]。因此,这些基质金属蛋白酶的表达水平可有效反映肿瘤细胞的侵袭能力。已经证明在许多类型的肿瘤中基质金属蛋白酶MMP2和MMP9降解基底膜是促进肿瘤侵袭和转移关键的步骤[10]。MT1-MMP参与激活MMP2和MMP13,降解细胞周围基质[11]。
在我们当前的研究中,α1-PDX不仅能抑制MMP2和MMP9的表达,而且能降低MT1-MMP的表达。由于MT1-MMP是furin的底物,MT1-MMP在成熟前需要furin对前体进行剪切[1]。α1-PDX降低了furin酶活性,进而降低了MT1-MMP 成熟及激活,进一步抑制了MMP2和MMP9的成熟。
VEGF调节肿瘤的转移和血管生成[12]。VEGF-C和VEGF-D的表达增强可促进肿瘤细胞淋巴转移,已经被认为是几种类型癌症的一个预后指标[12]。VEGF-C和VEGF-D 的成熟、激活需要furin对其前体进行剪切[1]。所以,我们同时检测了α1-PDX处理后细胞VEGF-C和VEGF-D的表达。结果表明α1-PDX处理的细胞VEGF-C和VEGF-D蛋白表达显著减少。
总之,这些结果表明,下调furin的活性,从而抑制MCF-7细胞MMPs和VEGFs蛋白的表达可能是其抑制MCF-7细胞生长、侵袭的机制。Furin抑制剂对其它肿瘤细胞迁移抑制作用的研究已经引起人们的重视[13-14]。但在不同的肿瘤细胞系中的作用是不一样的,甚至是相反的[4-5],因此,furin抑制剂在肿瘤中的作用研究仅仅是个开始,还有很多的未知机制需要深入研究。
[1] Thomas G. Furin at the cutting edge: from protein traffic to embryogenesis and disease[J]. Nat Rev Mol Cell Biol, 2002, 3(10):753-766.
[2] Park BH, Kim HG, Jin SW, et al. Metallothionein-III increases ADAM10 activity in association with furin, PC7, and PKCα during non-amyloidogenic processing[J]. FEBS Lett, 2014, 588(14):2294-2300.
[3] 袁 磊,陈旭东,范文娟,等. 沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化[J]. 中国病理生理杂志, 2013, 29(6):1014-1020.
[4] 雷瑞祥,陈 燕,谢 霞,等. 原蛋白转化酶在转化生长因子β1抑制HBV复制效应中的作用[J]. 中国病理生理杂志, 2010, 26(7):1331-1334.
[5] Mack MG, Straub R, Eichler K, et al.Breast cancer metastases in liver: laser-induced interstitial thermotherapy-local tumor control rate and survival data[J]. Radiology, 2004, 233(2):400-409.
[6] Kominsky SL, Davidson NE. A “bone” fide predictor of metastasis? Predicting breast cancer metastasis to bone[J]. J Clin Oncol, 2006, 24(15):2227-2229.
[7] Bassi DE, Mahloogi H, Al-Saleem L, et al. Elevated furin expression in aggressive human head and neck tumors and tumor cell lines[J]. Mol Carcinog, 2001, 31(4):224-232.
[8] Gao J, Ding F, Liu Q, et al. Knockdown of MACC1 expression suppressed hepatocellular carcinoma cell migration and invasion and inhibited expression of MMP2 and MMP9[J]. Mol Cell Biochem, 2013, 376(1-2):21-32.
[9] Hotary KB, Allen ED, Brooks PC, et al. Membrane type I matrix metalloproteinase usurps tumor growth control imposed by the three-dimensional extracellular matrix[J]. Cell, 2003, 114(1):33-45.
[10]Rozanov DV, Golubkov VS, Strongin AY. Membrane type-1 matrix metalloproteinase (MT1-MMP) protects malignant cells from tumoricidal activity of re-engineered anthrax lethal toxin[J]. Int J Biochem Cell Biol, 2005, 37(1):142-154.
[11]Koyama H, Iwata H, Kuwabara Y, et al. Gelatinolytic activity of matrix metalloproteinase-2 and -9 in oesophageal carcinoma; a study usinginsituzymography[J]. Eur J Cancer, 2000, 36(16):2164-2170.
[12]Stacker SA, Caesar C, Baldwin ME. VEGF-D promotes the metastatic spread of tumor cells via the lymphatics[J]. Nat Med,2001, 7(2):186-191.
[13]Bassi DE, Mahloogi H, Lopez De Cicco R, et al. Increased furin activity enhances the malignant phenotype of human head and neck cancer cells[J]. Am J Pathol, 2003, 162(2):439-447.
[14]Bassi DE, Lopez De Cicco R, Mahloogi H, et al. Furin inhibition results in absent or decreased invasiveness and tumorigenicity of human cancer cells[J]. Proc Natl Acad Sci U S A, 2001, 98(18):10326-10331.
Effects of furin inhibitor on metastasis of human breast cancer MCF-7 cells
REN Jing-li1, 2, SHI Qi3, SUN Ming-zhen2, SONG Guo-hua1, MA Yong-chao4
(1KeyLaboratoryofMedicalBioengineering,2DepartmentofPharmacology,FacultyofPharmacy,4DepartmentofBiochemistry,LuoheMedicalcollege,Luohe462000,China;3DepartmentofPathology,XinxiangMedicalUniversity,Xinxiang453000,China.E-mail:renjimmy@sina.com)
AIM: To investigate the mechanism underlying breast cancer metastasis and to provide theoretical data for studying the pathogenesis of breast cancer onset and development. METHODS: Human breast cancer MCF-7 cells were treated with different concentrations of furin inhibitor α1-PDX for 48 h. Wound healing assay and Transwell assay were applied to detect the migration and invasion abilities of the MCF-7 cells. The expression of cell migration-associated proteins, including membrane-type 1 matrix metalloproteinase (MT1-MMP), vascular endothelial growth factor (VEGF)-C and VEGF-D, was determined by Western blotting. The protein levels of MMP2 and MMP9 in the supernatant were measured by ELISA. RESULTS: Compared with control group, 200 nmol/L of furin inhibitor exerted significant inhibitory effects on the cell migration (P<0.05). The expression of cell migration-associated proteins MT1-MMP, VEGF-C and VEGF-D was significantly inhibited after treated with α1-PDX (P<0.05). Significant inhibitory effects of α1-PDX on the expression of MMP9 and MMP2 (P<0.05) in the supernatant were observed. CONCLUSION: Furin inhibitor suppresses the metastasis of MCF-7 cells via down-regulating the expression of MMPs and VEGFs.
Furin inhibitors; Breast neoplasms; Matrix metalloproteinases; Vascular endothelial growth factors
1000- 4718(2014)12- 2267- 05
2014- 07- 17
2014- 09- 04
河南省高校科技创新人才支持计划资助项目(No. 2012HASTIT038)
R73-3
A
10.3969/j.issn.1000- 4718.2014.12.027
△通讯作者 Tel: 0395-3115098; E-mail: renjimmy@sina.com
